Nazwa ogólna: halobetazolu propionian
Postać dawkowania: krem
Medically reviewed by Drugs.com. Ostatnia aktualizacja 21 kwietnia 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Interactions
- More
- Ultravate Cream Description
- Ultravate Cream – Clinical Pharmacology
- Farmakokinetyka
- Wskazania i stosowanie produktu leczniczego Ultravate Cream
- Przeciwwskazania
- Środki ostrożności
- Ogólne
- Informacje dla pacjentów
- Badania laboratoryjne
- Carcinogenesis, Mutagenesis, and Impairment of Fertility
- Ciąża
- Matki karmiące
- Stosowanie u dzieci
- Stosowanie w wieku podeszłym
- Działania niepożądane
- Przedawkowanie
- Ultravate Cream dawkowanie i sposób podawania
- Jak jest dostarczany lek Ultravate Cream
- Przechowywanie
- NAKLEJKA OPAKOWANIA.PRINCIPAL DISPLAY PANEL
- Często zadawane pytania
- Więcej o Ultravate (halobetazol miejscowo)
- Zasoby dla konsumentów
- Zasoby dla profesjonalistów
- Przewodniki dotyczące leczenia
Ultravate Cream Description
Ultravate® (halobetasol propionate cream) Krem, 0.05% zawiera halobetazolu propionian, syntetyczny kortykosteroid do stosowania miejscowego w dermatologii. Kortykosteroidy stanowią klasę głównie syntetycznych steroidów stosowanych miejscowo jako środki przeciwzapalne i przeciwświądowe.
Chemicznie propionian halobetazolu jest 21-chloro-6α, 9-difluoro-11β, 17-dihydroksy-16β-metylopregna-1, 4-dien-3-20-dionem, 17-propionianem, C25H31ClF2O5. Ma on następujący wzór strukturalny:
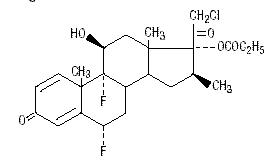
Propionian halobetazolu ma masę cząsteczkową 485. Jest to biały krystaliczny proszek nierozpuszczalny w wodzie.
Każdy gram kremu Ultravate zawiera 0,5 mg/g propionianu halobetazolu w kremowej bazie składającej się z alkoholu cetylowego, gliceryny, izostearynianu izopropylu, palmitynianu izopropylu, stearynianu-21, diazolidynylomocznika, metylochloroizotiazolinonu, (i) metyloizotiazolinonu i wody.
Ultravate Cream – Clinical Pharmacology
Podobnie jak inne miejscowo stosowane kortykosteroidy, halobetazolu propionian wykazuje działanie przeciwzapalne, przeciwświądowe i obkurczające naczynia krwionośne. Mechanizm działania przeciwzapalnego miejscowych glikokortykosteroidów, ogólnie rzecz biorąc, jest niejasny. Uważa się jednak, że kortykosteroidy działają poprzez indukcję białek hamujących fosfolipazę A2, zwanych zbiorczo lipokortynami. Postuluje się, że białka te kontrolują biosyntezę silnych mediatorów zapalenia, takich jak prostaglandyny i leukotrieny, poprzez hamowanie uwalniania ich wspólnego prekursora – kwasu arachidonowego. Kwas arachidonowy jest uwalniany z fosfolipidów błonowych przez fosfolipazę A2.
Farmakokinetyka
Zakres przezskórnego wchłaniania miejscowo stosowanych kortykosteroidów zależy od wielu czynników, w tym od nośnika i integralności bariery naskórkowej. Nie wykazano, aby opatrunki okluzyjne z hydrokortyzonem przez okres do 24 godzin zwiększały penetrację, jednak okluzja hydrokortyzonu przez 96 godzin wyraźnie zwiększa penetrację. Miejscowo stosowane kortykosteroidy mogą być wchłaniane z normalnej, nieuszkodzonej skóry. Stan zapalny i (lub) inne procesy chorobowe w skórze mogą zwiększać wchłanianie przezskórne.
Badania na ludziach i zwierzętach wskazują, że mniej niż 6% zastosowanej dawki halobetazolu propionianu dostaje się do krążenia w ciągu 96 godzin po miejscowym podaniu kremu.
Badania przeprowadzone z produktem leczniczym Ultravate Cream wskazują, że znajduje się on w zakresie superwysokiej siły działania w porównaniu z innymi kortykosteroidami stosowanymi miejscowo.
Wskazania i stosowanie produktu leczniczego Ultravate Cream
Ultravate Cream 0,05% jest kortykosteroidem o superwysokiej sile działania wskazanym do łagodzenia zapalnych i świądowych objawów dermatoz reagujących na kortykosteroidy. Nie zaleca się stosowania leku dłużej niż przez dwa kolejne tygodnie, a całkowita dawka nie powinna przekraczać 50 g/tydzień ze względu na możliwość zahamowania czynności osi podwzgórze-przysadka-nadnercza (HPA). Nie zaleca się stosowania u dzieci w wieku poniżej 12 lat.
Tak jak w przypadku innych silnie działających kortykosteroidów, leczenie należy przerwać po osiągnięciu kontroli. Jeżeli w ciągu 2 tygodni nie nastąpi poprawa, konieczna może być ponowna ocena diagnozy.
Przeciwwskazania
Ultravate Cream jest przeciwwskazany u tych pacjentów, u których w wywiadzie stwierdzono nadwrażliwość na którykolwiek ze składników preparatu.
Środki ostrożności
Ogólne
Systemowe wchłanianie miejscowo stosowanych kortykosteroidów może powodować odwracalną supresję osi podwzgórze-przysadka-nadnercza (HPA) z możliwością wystąpienia niewydolności glikokortykosteroidowej po odstawieniu leczenia. Objawy zespołu Cushinga, hiperglikemia i glukozuria mogą również wystąpić u niektórych pacjentów w wyniku ogólnoustrojowego wchłaniania miejscowo stosowanych glikokortykosteroidów podczas leczenia.
Pacjenci stosujący miejscowo steroid na dużą powierzchnię lub na obszary objęte okluzją powinni być okresowo oceniani pod kątem dowodów supresji osi HPA. Można to zrobić za pomocą testów stymulacji ACTH, kortyzolu w osoczu i wolnego kortyzolu w moczu. Pacjenci otrzymujący kortykosteroidy o bardzo silnym działaniu nie powinni być leczeni jednorazowo przez okres dłuższy niż 2 tygodnie i tylko małe powierzchnie powinny być leczone jednorazowo ze względu na zwiększone ryzyko supresji osi HPA.
Ultravate Cream powodował supresję osi HPA, gdy był stosowany w dawkach podzielonych po 7 gramów na dobę przez jeden tydzień u pacjentów z łuszczycą. Działania te były odwracalne po przerwaniu leczenia.
Jeśli zostanie stwierdzona supresja osi HPA, należy podjąć próbę odstawienia leku, zmniejszenia częstości stosowania lub zastąpienia mniej silnym kortykosteroidem. Powrót czynności osi HPA jest na ogół szybki po przerwaniu stosowania miejscowych kortykosteroidów. W rzadkich przypadkach mogą wystąpić oznaki i objawy niewydolności glikokortykosteroidowej wymagające uzupełnienia kortykosteroidów podawanych ogólnoustrojowo. W celu uzyskania informacji na temat ogólnoustrojowej suplementacji, patrz informacje dotyczące przepisywania tych produktów.
Pacjenci pediatryczni mogą być bardziej podatni na toksyczność ogólnoustrojową równoważnych dawek ze względu na większy stosunek powierzchni skóry do masy ciała (patrz PRZECIWWSKAZANIA: Stosowanie u dzieci).
Jeśli wystąpi podrażnienie, należy przerwać stosowanie produktu leczniczego Ultravate Cream i rozpocząć odpowiednie leczenie. Alergiczne kontaktowe zapalenie skóry z kortykosteroidami rozpoznaje się zwykle na podstawie obserwacji braku gojenia, a nie klinicznego zaostrzenia, jak w przypadku większości produktów stosowanych miejscowo, niezawierających kortykosteroidów. Taka obserwacja powinna być potwierdzona odpowiednimi diagnostycznymi testami płatkowymi.
Jeśli występują lub rozwijają się towarzyszące zakażenia skóry, należy zastosować odpowiedni lek przeciwgrzybiczy lub przeciwbakteryjny. Jeśli korzystna odpowiedź nie wystąpi natychmiast, należy przerwać stosowanie produktu leczniczego Ultravate Cream do czasu odpowiedniego opanowania zakażenia.
Ultravate Cream nie powinien być stosowany w leczeniu trądziku różowatego lub okołoustnego zapalenia skóry i nie powinien być stosowany na twarzy, w pachwinach lub w pachach.
Informacje dla pacjentów
Pacjenci stosujący miejscowo kortykosteroidy powinni otrzymać następujące informacje i instrukcje:
- Lek należy stosować zgodnie z zaleceniami lekarza. Jest on przeznaczony wyłącznie do użytku zewnętrznego. Unikać kontaktu z oczami.
- Leku nie należy stosować w innych zaburzeniach niż te, dla których został przepisany.
- Leczonego obszaru skóry nie należy bandażować, w inny sposób przykrywać lub owijać, tak aby był okluzyjny, chyba że zaleci to lekarz.
- Pacjenci powinni zgłaszać lekarzowi wszelkie objawy miejscowych działań niepożądanych.
Badania laboratoryjne
W ocenie pacjentów pod kątem supresji osi HPA pomocne mogą być następujące badania: ACTH-stimulation test; A.M. plasma cortisol test; Urinary free-cortisol test.
Carcinogenesis, Mutagenesis, and Impairment of Fertility
Długoterminowe badania na zwierzętach nie zostały przeprowadzone w celu oceny potencjału rakotwórczego propionianu halobetazolu. Pozytywne efekty mutagenności zaobserwowano w dwóch testach genotoksyczności. Propionian halobetazolu był pozytywny w teście mikrojądrowym chomika chińskiego oraz w teście mutacji genu chłoniaka mysiego in vitro.
Badania na szczurach po podaniu doustnym w dawkach do 50 µg/kg/dobę nie wykazały upośledzenia płodności ani ogólnej wydajności reprodukcyjnej.
W innych badaniach genotoksyczności, nie stwierdzono genotoksyczności propionianu halobetazolu w teście Amesa/Salmonelli, w teście wymiany chromatyd siostrzanych w komórkach somatycznych chomika chińskiego, w badaniach aberracji chromosomowych komórek germinalnych i somatycznych gryzoni oraz w teście punktowym u ssaków w celu określenia mutacji punktowych.
Ciąża
Działanie teratogenne: Kategoria ciążowa C
Wykazano, że kortykosteroidy mają działanie teratogenne u zwierząt laboratoryjnych, gdy są podawane ogólnoustrojowo w stosunkowo małych dawkach. Wykazano, że niektóre kortykosteroidy są teratogenne po zastosowaniu skórnym u zwierząt laboratoryjnych.
Propionian halobetazolu wykazuje działanie teratogenne u szczurów SPF i królików typu szynszylowego, gdy jest podawany ogólnoustrojowo w okresie ciąży w dawkach od 0,04 do 0,1 mg/kg u szczurów i 0,01 mg/kg u królików. Dawki te są odpowiednio około 13, 33 i 3 razy większe od dawki stosowanej miejscowo u ludzi w produkcie leczniczym Ultravate Cream. Propionian halobetazolu był embriotoksyczny u królików, ale nie u szczurów.
Podniebienie lewe obserwowano zarówno u szczurów, jak i u królików. Omphalocele obserwowano u szczurów, ale nie u królików.
Nie ma odpowiednich i dobrze kontrolowanych badań dotyczących potencjału teratogennego propionianu halobetazolu u kobiet w ciąży. Ultravate Cream powinien być stosowany w okresie ciąży tylko wtedy, gdy potencjalne korzyści uzasadniają potencjalne ryzyko dla płodu.
Matki karmiące
Systemowo podawane kortykosteroidy występują w mleku ludzkim i mogą hamować wzrost, zaburzać endogenne wytwarzanie kortykosteroidów lub powodować inne niepożądane działania. Nie wiadomo, czy miejscowe podawanie kortykosteroidów może powodować wystarczające wchłanianie ogólnoustrojowe do wytworzenia wykrywalnych ilości w mleku ludzkim. Ponieważ wiele leków jest wydzielanych do mleka ludzkiego, należy zachować ostrożność w przypadku podawania produktu leczniczego Ultravate Cream kobietom karmiącym piersią.
Stosowanie u dzieci
Bezpieczeństwo i skuteczność produktu leczniczego Ultravate Cream u pacjentów pediatrycznych nie zostały ustalone i nie zaleca się stosowania u pacjentów pediatrycznych w wieku poniżej 12 lat. Ze względu na większy stosunek powierzchni skóry do masy ciała, u pacjentów pediatrycznych występuje większe niż u dorosłych ryzyko supresji osi HPA i zespołu Cushinga podczas leczenia miejscowo stosowanymi kortykosteroidami. Dlatego są oni również bardziej narażeni na ryzyko wystąpienia niewydolności kory nadnerczy w trakcie lub po odstawieniu leczenia. U dzieci otrzymujących miejscowo stosowane kortykosteroidy zgłaszano działania niepożądane, w tym rozstępy.
Zgłaszano supresję osi HPA, zespół Cushinga, opóźnienie liniowego wzrostu, opóźnienie przyrostu masy ciała i nadciśnienie wewnątrzczaszkowe. Objawy supresji nadnerczy u dzieci obejmują małe stężenie kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Objawy nadciśnienia wewnątrzczaszkowego obejmują wybrzuszenie ciemiączek, bóle głowy i obustronny obrzęk brodawek.
Stosowanie w wieku podeszłym
Z około 400 pacjentów leczonych produktem Ultravate Cream w badaniach klinicznych, 25% miało 61 lat i więcej, a 6% miało 71 lat i więcej. Nie zaobserwowano ogólnych różnic w zakresie bezpieczeństwa lub skuteczności pomiędzy tymi pacjentami a pacjentami młodszymi; a inne zgłoszone doświadczenia kliniczne nie wykazały różnic w reakcjach pomiędzy pacjentami w podeszłym wieku a pacjentami młodszymi, jednak nie można wykluczyć większej wrażliwości niektórych osób w podeszłym wieku.
Działania niepożądane
W kontrolowanych badaniach klinicznych najczęstsze działania niepożądane zgłaszane dla produktu Ultravate Cream obejmowały kłucie, pieczenie lub swędzenie u 4,4% pacjentów. Rzadziej zgłaszanymi działaniami niepożądanymi były suchość skóry, rumień, zanik skóry, leukodermia, pęcherzyki i wysypka.
Następujące dodatkowe miejscowe działania niepożądane zgłaszane są rzadko podczas stosowania miejscowych kortykosteroidów i mogą występować częściej podczas stosowania kortykosteroidów o dużej sile działania, takich jak Ultravate Cream. Reakcje te są wymienione w przybliżonej kolejności zmniejszania się częstości występowania: zapalenie mieszków włosowych, nadmierne owłosienie, wykwity trądzikowe, hipopigmentacja, okołoustne zapalenie skóry, alergiczne kontaktowe zapalenie skóry, wtórne zakażenie, rozstępy i miliaria.
Przedawkowanie
Stosowany miejscowo krem Ultravate może być wchłaniany w ilościach wystarczających do wywołania działania ogólnoustrojowego (patrzPrzeciwwskazania).
Ultravate Cream dawkowanie i sposób podawania
Nakładać cienką warstwę kremu Ultravate Cream na zmienioną chorobowo skórę raz lub dwa razy na dobę, zgodnie z zaleceniami lekarza, delikatnie i całkowicie wcierając.
Ultravate (halobetazolu propionianu krem) Cream jest miejscowym kortykosteroidem o bardzo dużej sile działania; dlatego leczenie należy ograniczyć do dwóch tygodni, a ilości większe niż 50 g/tydzień nie powinny być stosowane. Podobnie jak w przypadku innych kortykosteroidów, leczenie należy przerwać po uzyskaniu kontroli. Jeśli w ciągu 2 tygodni nie nastąpi poprawa, konieczna może być ponowna ocena diagnozy.
Kremu Ultravate nie należy stosować z opatrunkami okluzyjnymi.
Jak jest dostarczany lek Ultravate Cream
Ultravate® (halobetazolu propionianu krem) Krem, 0.05% jest dostarczany w następujących wielkościach tub:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
Przechowywanie
Przechowywać w temperaturze od 15°C do 30°C (59°F do 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (Flat), 09-0086 (Folded)
Revised May 2010
NAKLEJKA OPAKOWANIA.PRINCIPAL DISPLAY PANEL

Etykieta pojemnika 15 gram

Etykieta kartonu 15 gram

Etykieta pojemnika 50 gram

Etykieta kartonu 50 gram
| ULTRAVATE halobetazolu propionian w kremie |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler -. Ranbaxy Laboratories Inc. (169932519)
Rejestrujący – Ranbaxy Laboratories Inc. (169932519)
| Zakład | |||
| Nazwa | Adres | ID/FEI | Operacje |
| Contract Pharmaceuticals Limited | 248761249 | produkcja | |
Często zadawane pytania
- Halobetazol vs. klobetazol – jak się mają?
- Czy można go stosować na trujący bluszcz?
- Czy można go stosować na skórę głowy?
Więcej o Ultravate (halobetazol miejscowo)
- Skutki uboczne
- W czasie ciąży lub karmienia piersią
- Dawkowanie Informacje
- Interakcje lekowe
- Cena &Kupony
- En Español
- 6 Recenzje
- Dostępność generyczna
- Klasa leków: Steroidy miejscowe
Zasoby dla konsumentów
- Informacje dla pacjentów
- Ultravate (Advanced Reading)
Zasoby dla profesjonalistów
- Informacje dla pacjentów
Inne marki Lexette, Bryhali, Halonate
Przewodniki dotyczące leczenia
- Psoriasis
- Atopic Dermatitis
- Dermatitis
- Eczema
Zastrzeżenia medyczne
.