Generieke naam: halobetasolpropionaat
Doseringsvorm: crème
Medisch beoordeeld door Drugs.com. Laatst bijgewerkt op 21 april 2020.
- Overzicht
- Bijwerkingen
- Dosering
- Interacties
- Meer
- Ultravate Crème Beschrijving
- Ultravate Crème – Klinische farmacologie
- Pharmacokinetiek
- Contra-indicaties
- Voorzorgsmaatregelen
- Algemeen
- Informatie voor patiënten
- Laboratoriumtesten
- Carcinogenese, mutagenese, en aantasting van de vruchtbaarheid
- Zwangerschap
- Nursing Mothers
- Pediatrisch gebruik
- Geriatrisch gebruik
- Bijwerkingen
- Overdosering
- Ultravate Crème Dosering en Toediening
- Hoe wordt Ultravate Cream geleverd
- OPSLAG
- PAKKET LABEL.PRINCIPAAL DISPLAY PANEL
- Veel gestelde vragen
- Meer over Ultravate (halobetasol topical)
- Consumenteninformatie
- Professionele middelen
- Gerelateerde behandelingsgidsen
Ultravate Crème Beschrijving
Ultravate® (halobetasolpropionaatcrème) Crème, 0.05% bevat halobetasolpropionaat, een synthetisch corticosteroïde voor topisch dermatologisch gebruik. De corticosteroïden vormen een klasse van hoofdzakelijk synthetische steroïden die topisch worden gebruikt als ontstekingsremmend en anti-puritisch middel.
Chemisch gezien is halobetasolpropionaat 21-chloor-6-α, 9-difluor-11β, 17-dihydroxy-16β-methylpregna-1, 4-diene-3-20-dione, 17-propionaat, C25H31ClF2O5. Het heeft de volgende structuurformule:
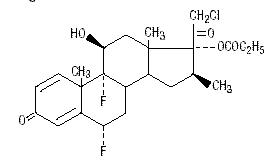
Halobetasolpropionaat heeft een molecuulgewicht van 485. Het is een wit kristallijn poeder dat onoplosbaar is in water.
Elke gram Ultravate Cream bevat 0,5 mg/g halobetasolpropionaat in een crèmebasis van cetylalcohol, glycerine, isopropylisostearaat, isopropylpalmitaat, steareth-21, diazolidinyl urea, methylchloorthiazolinon, (en) methylisothiazolinon en water.
Ultravate Crème – Klinische farmacologie
Zoals andere topische corticosteroïden heeft halobetasolpropionaat een ontstekingsremmende, antipuritische en vasoconstrictieve werking. Het mechanisme van de ontstekingsremmende werking van de topische corticosteroïden is in het algemeen onduidelijk. Men denkt echter dat corticosteroïden werken door de inductie van fosfolipase A2-remmende proteïnen, die lipocortines worden genoemd. Er wordt aangenomen dat deze eiwitten de biosynthese van krachtige ontstekingsmediatoren zoals prostaglandinen en leukotriënen controleren door het vrijkomen van hun gemeenschappelijke precursor arachidonzuur te remmen. Arachidonzuur wordt uit membraanfosfolipiden vrijgemaakt door fosfolipase A2.
Pharmacokinetiek
De mate van percutane absorptie van topische corticosteroïden wordt bepaald door vele factoren, waaronder het medium en de integriteit van de epidermale barrière. Occlusieve verbanden met hydrocortison tot 24 uur hebben geen verhoging van de penetratie aangetoond; occlusie van hydrocortison gedurende 96 uur verhoogt de penetratie echter aanzienlijk. Topische corticosteroïden kunnen door de normale intacte huid worden geabsorbeerd. Ontsteking en/of andere ziekteprocessen in de huid kunnen de percutane absorptie verhogen.
Menselijke en dierlijke studies geven aan dat minder dan 6% van de aangebrachte dosis halobetasolpropionaat binnen 96 uur na topische toediening van de crème in de circulatie terechtkomt.
Ultravate Cream 0,05% is een zeer krachtig corticosteroïd voor de verlichting van de inflammatoire en pruritische manifestaties van corticosteroïd-responsieve dermatosen. Behandeling langer dan twee opeenvolgende weken wordt niet aanbevolen, en de totale dosering mag niet hoger zijn dan 50 g/week vanwege de mogelijkheid dat het geneesmiddel de hypothalamus-hypofysebijnieras (HPA-as) onderdrukt. Gebruik bij kinderen jonger dan 12 jaar wordt afgeraden.
Zoals bij andere zeer actieve corticosteroïden dient de therapie te worden gestaakt wanneer controle is bereikt. Indien binnen 2 weken geen verbetering wordt gezien, kan herbeoordeling van de diagnose noodzakelijk zijn.
Contra-indicaties
Ultravate Cream is gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheid voor één van de bestanddelen van het preparaat.
Voorzorgsmaatregelen
Algemeen
Systemische absorptie van topische corticosteroïden kan reversibele onderdrukking van de hypothalamus-hypofysebijnieras (HPA-as) veroorzaken met de mogelijkheid van glucocorticosteroïdinsufficiëntie na het staken van de behandeling. Manifestaties van het syndroom van Cushing, hyperglykemie en glucosurie kunnen bij sommige patiënten ook worden veroorzaakt door systemische absorptie van topische corticosteroïden tijdens de behandeling.
Patiënten die een topisch steroïd aanbrengen op een groot oppervlak of op gebieden onder occlusie, moeten periodiek worden geëvalueerd op aanwijzingen voor onderdrukking van de HPA-as. Dit kan worden gedaan met behulp van de ACTH-stimulatie, A.M. plasma cortisol, en urinaire vrije-cortisoltests. Patiënten die superkrachtige corticosteroïden krijgen, mogen niet langer dan 2 weken achtereen worden behandeld en er mogen slechts kleine gebieden tegelijk worden behandeld vanwege het verhoogde risico op HPA-suppressie.
Ultravate Cream veroorzaakte HPA-as onderdrukking bij gebruik in verdeelde doses van 7 gram per dag gedurende een week bij patiënten met psoriasis. Deze effecten waren omkeerbaar na het staken van de behandeling.
Als HPA-as onderdrukking wordt waargenomen, moet worden geprobeerd het geneesmiddel te staken, de toepassingsfrequentie te verlagen, of een minder krachtig corticosteroïd te vervangen. De HPA-asfunctie herstelt zich over het algemeen snel na het staken van topische corticosteroïden. In zeldzame gevallen kunnen tekenen en symptomen van glucocorticosteroïdinsufficiëntie optreden die aanvullende systemische corticosteroïden vereisen. Voor informatie over systemische suppletie, zie de voorschrijfinformatie voor die producten.
Pediatrische patiënten kunnen gevoeliger zijn voor systemische toxiciteit van equivalente doses vanwege hun grotere verhouding tussen huidoppervlak en lichaamsmassa (zie VOORZORGSMAATREGELEN: Pediatrisch gebruik).
Als zich irritatie ontwikkelt, moet Ultravate Cream worden gestaakt en moet een geschikte therapie worden ingesteld. Allergische contactdermatitis met corticosteroïden wordt gewoonlijk gediagnosticeerd door het niet genezen waar te nemen in plaats van een klinische verergering waar te nemen zoals bij de meeste topicale producten die geen corticosteroïden bevatten. Een dergelijke observatie moet worden bevestigd met een geschikte diagnostische patch-test.
Als gelijktijdige huidinfecties aanwezig zijn of zich ontwikkelen, moet een geschikt antischimmel- of antibacterieel middel worden gebruikt. Indien niet onmiddellijk een gunstige reactie optreedt, moet het gebruik van Ultravate Cream worden gestaakt totdat de infectie voldoende onder controle is.
Ultravate Cream mag niet worden gebruikt bij de behandeling van rosacea of periorale dermatitis, en mag niet worden gebruikt op het gezicht, in de liezen of in de oksels.
Informatie voor patiënten
Patiënten die topische corticosteroïden gebruiken, dienen de volgende informatie en instructies te krijgen:
- Het geneesmiddel dient te worden gebruikt zoals voorgeschreven door de arts. Het is uitsluitend bestemd voor uitwendig gebruik. Vermijd contact met de ogen.
- Het geneesmiddel mag niet worden gebruikt voor een andere aandoening dan die waarvoor het is voorgeschreven.
- Het behandelde huidgebied mag niet worden ingezwachteld, anderszins bedekt of omwikkeld, zodat het occlusief is, tenzij de arts dit voorschrijft.
- Patiënten dienen tekenen van lokale bijwerkingen aan hun arts te melden.
Laboratoriumtesten
De volgende testen kunnen nuttig zijn bij het evalueren van patiënten op HPA-as onderdrukking: ACTH-stimulatietest; A.M. plasma-cortisoltest; Urinaire vrije-cortisoltest.
Carcinogenese, mutagenese, en aantasting van de vruchtbaarheid
Langetermijndierexperimenteel onderzoek is niet uitgevoerd om het carcinogene potentieel van halobetasolpropionaat te evalueren. Positieve mutageniteitseffecten werden waargenomen in twee genotoxiciteitstests. Halobetasolpropionaat was positief in een Chinese hamster-micronucleustest en in een muislymfoomgenmutatietest in vitro.
Studies bij de rat na orale toediening in doses tot 50 µg/kg/dag wezen niet op aantasting van de vruchtbaarheid of de algemene voortplantingsprestaties.
In andere genotoxiciteitstests bleek halobetasolpropionaat niet genotoxisch te zijn in de Ames/Salmonella-test, in de sister chromatid exchange-test in somatische cellen van de Chinese hamster, in chromosoomafwijkingsstudies van kiem- en somatische cellen van knaagdieren, en in een spottest met zoogdieren om puntmutaties te bepalen.
Zwangerschap
Teratogene effecten: Zwangerschapscategorie C
Corticosteroïden zijn bij laboratoriumdieren teratogeen gebleken wanneer zij systemisch in relatief lage doseringen werden toegediend. Van sommige corticosteroïden is aangetoond dat ze teratogeen zijn na huidtoepassing bij laboratoriumdieren.
Halobetasolpropionaat is teratogeen gebleken bij SPF-ratten en chinchilla-achtige konijnen wanneer het systemisch toegediend werd tijdens de dracht in doses van 0,04 tot 0,1 mg/kg bij ratten en 0,01 mg/kg bij konijnen. Deze doses zijn respectievelijk ongeveer 13, 33 en 3 maal de menselijke topische dosis van Ultravate Cream. Halobetasol propionaat was embryotoxisch bij konijnen maar niet bij ratten.
Cleft palate werd waargenomen bij zowel ratten als konijnen. Omphalocele werd waargenomen bij ratten, maar niet bij konijnen.
Er zijn geen adequate en goed gecontroleerde studies over het teratogene potentieel van halobetasolpropionaat bij zwangere vrouwen. Ultravate Cream mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
Nursing Mothers
Systemisch toegediende corticosteroïden komen voor in de moedermelk en zouden de groei kunnen onderdrukken, interfereren met de endogene productie van corticosteroïden, of andere ongewenste effecten kunnen veroorzaken. Het is niet bekend of topische toediening van corticosteroïden kan leiden tot voldoende systemische absorptie om detecteerbare hoeveelheden in de moedermelk te produceren. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer Ultravate Cream wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik
De veiligheid en werkzaamheid van Ultravate Cream bij pediatrische patiënten zijn niet vastgesteld en gebruik bij pediatrische patiënten jonger dan 12 jaar wordt niet aanbevolen. Vanwege een hogere verhouding tussen huidoppervlak en lichaamsmassa lopen pediatrische patiënten een groter risico dan volwassenen op onderdrukking van de HPA-as en het syndroom van Cushing wanneer zij worden behandeld met topische corticosteroïden. Zij lopen daarom ook een groter risico op bijnierinsufficiëntie tijdens of na het staken van de behandeling. Bijwerkingen zoals striae zijn gemeld bij onjuist gebruik van topische corticosteroïden bij zuigelingen en kinderen.
HPA-as onderdrukking, syndroom van Cushing, lineaire groeiachterstand, vertraagde gewichtstoename en intracraniële hypertensie zijn gemeld bij kinderen die topische corticosteroïden kregen. Manifestaties van bijnsuppressie bij kinderen zijn lage plasma cortisolspiegels en geen respons op ACTH stimulatie. Manifestaties van intracraniële hypertensie omvatten uitpuilende fontanellen, hoofdpijn en bilateraal papilledema.
Geriatrisch gebruik
Van de ongeveer 400 patiënten die in klinische studies met Ultravate Crème werden behandeld, was 25% 61 jaar en ouder en 6% 71 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten; en andere gerapporteerde klinische ervaring heeft geen verschillen in respons vastgesteld tussen ouderen en jongere patiënten, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Bijwerkingen
In gecontroleerde klinische studies omvatten de meest frequente bijwerkingen die voor Ultravate Cream werden gerapporteerd, prikken, branden of jeuk bij 4,4% van de patiënten. Minder frequent gerapporteerde bijwerkingen waren droge huid, erytheem, huidatrofie, leukodermie, blaasjes en huiduitslag.
De volgende bijkomende lokale bijwerkingen worden zelden gerapporteerd met topische corticosteroïden, en ze kunnen frequenter voorkomen met hoogpotente corticosteroïden, zoals Ultravate Cream. Deze reacties worden vermeld in afnemende volgorde van voorkomen: folliculitis, hypertrichose, acneiforme erupties, hypopigmentatie, periorale dermatitis, allergische contactdermatitis, secundaire infectie, striae en miliaria.
Overdosering
Topisch aangebrachte Ultravate Crème kan in voldoende hoeveelheden worden geabsorbeerd om systemische effecten te veroorzaken (zie VOORZORGSMAATREGELEN).
Ultravate Crème Dosering en Toediening
Een of tweemaal daags een dun laagje Ultravate Crème op de aangedane huid aanbrengen, zoals voorgeschreven door uw arts, en zachtjes en volledig inwrijven.
Ultravate (halobetasolpropionaatcrème) Crème is een zeer krachtig topisch corticosteroïd; daarom dient de behandeling beperkt te blijven tot twee weken, en hoeveelheden groter dan 50 g/wk mogen niet worden gebruikt. Net als bij andere corticosteroïden moet de behandeling worden gestaakt wanneer controle is bereikt. Indien binnen 2 weken geen verbetering wordt gezien, kan herbeoordeling van de diagnose noodzakelijk zijn.
Ultravate Cream mag niet worden gebruikt met occlusieve verbanden.
Hoe wordt Ultravate Cream geleverd
Ultravate® (halobetasolpropionaatcrème) Cream, 0.05% wordt geleverd in de volgende tube-formaten:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
OPSLAG
Bewaren tussen 15°C en 30°C (59°F en 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (plat), 09-0086 (gevouwen)
herzien mei 2010
PAKKET LABEL.PRINCIPAAL DISPLAY PANEL

15 gram verpakkingsetiket

15 gram kartonnen etiket

50 gram verpakkingsetiket

50 gram kartonnen etiket
| ULTRAVATE halobetasolpropionaatcrème |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiketteerder – Ranbaxy Laboratories Inc. (169932519)
Registrant – Ranbaxy Laboratories Inc. (169932519)
| Instelling | |||
| Naam | Adres | ID/FEI | Operaties |
| Contract Pharmaceuticals Limited | 248761249 | fabricage | |
Veel gestelde vragen
- Halobetasol vs. clobetasol – hoe verhouden ze zich tot elkaar?
- Kan dit worden gebruikt tegen poison ivy?
- Kan het op de hoofdhuid worden gebruikt?
Meer over Ultravate (halobetasol topical)
- Bijwerkingen
- Tijdens zwangerschap of borstvoeding
- Dosering Informatie
- Geneesmiddeleninteracties
- Prijzen &Coupons
- En Español
- 6 Recensies
- Generieke beschikbaarheid
- Geneesmiddelenklasse: topische steroïden
Consumenteninformatie
- Patiënteninformatie
- Ultravate (Advanced Reading)
Professionele middelen
- Voorschrijfinformatie
Andere merken Lexette, Bryhali, Halonate
Gerelateerde behandelingsgidsen
- Psoriasis
- Atopic Dermatitis
- Dermatitis
- Eczema
Medische Disclaimer