Denumire generică: propionat de halobetasol
Forma de dozare: cremă
Revizuit medical de Drugs.com. Ultima actualizare la 21 aprilie 2020.
- Vizualizare
- Efecte secundare
- Dosare
- Profesional
- Interacțiuni
- Mai multe
- Ultravate Cream Descriere
- Ultravate Cream – Farmacologie clinică
- Farmacocinetică
- Indicații și mod de utilizare pentru Ultravate Cream
- Contraindicații
- Precauții
- Generalități
- Informații pentru pacienți
- Teste de laborator
- Carcinogeneză, mutageneză și afectarea fertilității
- Femeia
- Mamele care alăptează
- Utilizare pediatrică
- Utilizare în scopuri geriatrice
- Reacții adverse
- Supradozaj
- Ultravate Cremă Doze și mod de administrare
- Cum se eliberează Ultravate Cream
- STABILIZARE
- Eticheta ambalajului.PANOUL PRINCIPAL DE AFIȘARE
- Întrebări frecvente
- Mai multe despre Ultravate (halobetasol topic)
- Resurse pentru consumatori
- Resurse pentru profesioniști
- Ghiduri terapeutice conexe
Ultravate Cream Descriere
Ultravate® (halobetasol propionat cremă) Cremă, 0.05% conține propionat de halobetasol, un corticosteroid sintetic pentru uz dermatologic topic. Corticosteroizii constituie o clasă de steroizi în principal sintetici utilizați topic ca agent antiinflamator și antipruriginos.
Chimic, propionatul de halobetasol este 21-cloro-6α, 9-difluoro-11β, 17-dihidroxi-16β-metilpregna-1, 4-diene-3-20-dionă, 17-propionat, C25H31ClF2O5. Are următoarea formulă structurală:
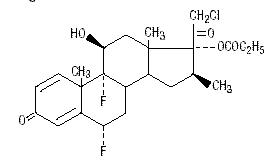
Propionatul de halobetasol are o greutate moleculară de 485. Este o pulbere albă cristalină insolubilă în apă.
Care gram de cremă Ultravate Cream conține 0,5 mg/g de propionat de halobetasol într-o bază de cremă formată din alcool cetilic, glicerină, izostearat de izopropil, palmitat de izopropil, steareth-21, diazolidinil uree, metilcloroizotiazolinonă, (și) metilizotiazolinonă și apă.
Ultravate Cream – Farmacologie clinică
Ca și alți corticosteroizi topici, propionatul de halobetasol are acțiuni antiinflamatoare, antipruriginoase și vasoconstrictoare. Mecanismul activității antiinflamatorii a corticosteroizilor topici, în general, este neclar. Cu toate acestea, se crede că corticosteroizii acționează prin inducerea proteinelor inhibitoare ale fosfolipazei A2, denumite colectiv lipocortine. Se postulează că aceste proteine controlează biosinteza unor mediatori puternici ai inflamației, cum ar fi prostaglandinele și leucotrienele, prin inhibarea eliberării precursorului lor comun, acidul arahidonic. Acidul arahidonic este eliberat din fosfolipidele membranare de către fosfolipaza A2.
Farmacocinetică
Dimensiunea absorbției percutane a corticosteroizilor topici este determinată de mulți factori, inclusiv de vehicul și de integritatea barierei epidermice. Nu s-a demonstrat că pansamentele ocluzive cu hidrocortizon pentru o perioadă de până la 24 de ore cresc penetrarea; cu toate acestea, ocluzia hidrocortizonului timp de 96 de ore crește în mod semnificativ penetrarea. Corticosteroizii topici pot fi absorbiți de pe pielea normală intactă. Inflamația și/sau alte procese patologice la nivelul pielii pot crește absorbția percutanată.
Studiile la om și la animale indică faptul că mai puțin de 6% din doza aplicată de propionat de halobetasol intră în circulație în decurs de 96 de ore după administrarea topică a cremei.
Studiile efectuate cu Ultravate Cream indică faptul că se situează în intervalul de potență super-înaltă în comparație cu alți corticosteroizi topici.
Indicații și mod de utilizare pentru Ultravate Cream
Ultravate Cream 0,05% este un corticosteroid cu potență super-înaltă indicat pentru ameliorarea manifestărilor inflamatorii și pruriginoase ale dermatozelor cu răspuns la corticosteroizi. Nu se recomandă tratamentul mai mult de două săptămâni consecutive, iar doza totală nu trebuie să depășească 50 g/ săptămână din cauza potențialului medicamentului de a suprima axa hipotalamo-hipofizo-suprarenală (HPA). Nu se recomandă utilizarea la copii cu vârsta sub 12 ani.
Ca și în cazul altor corticosteroizi foarte activi, tratamentul trebuie întrerupt atunci când s-a obținut controlul. Dacă nu se observă nicio ameliorare în decurs de 2 săptămâni, poate fi necesară reevaluarea diagnosticului.
Contraindicații
Ultravate Cream este contraindicat la acei pacienți cu antecedente de hipersensibilitate la oricare dintre componentele preparatului.
Precauții
Generalități
Absorbția sistemică a corticosteroizilor topici poate produce suprimarea reversibilă a axei hipotalamo-hipofizo-suprarenale (HPA) cu potențial de insuficiență glucocorticosteroidiană după întreruperea tratamentului. Manifestări ale sindromului Cushing, hiperglicemie și glucozurie pot fi, de asemenea, produse la unii pacienți prin absorbția sistemică a corticosteroizilor topici în timpul tratamentului.
Pacienții care aplică un steroid topic pe o suprafață mare sau pe zone aflate sub ocluzie trebuie evaluați periodic pentru evidențierea supresiei axei HPA. Acest lucru poate fi realizat prin utilizarea testelor de stimulare a ACTH, a cortizolului plasmatic A.M. și a cortizolului liber urinar. Pacienții care primesc corticosteroizi foarte puternici nu trebuie tratați mai mult de 2 săptămâni la rând și numai zone mici trebuie tratate la un moment dat, din cauza riscului crescut de supresie HPA.
Ultravate Cream a produs supresie a axei HPA atunci când a fost utilizat în doze divizate de 7 grame pe zi timp de o săptămână la pacienții cu psoriazis. Aceste efecte au fost reversibile la întreruperea tratamentului.
Dacă se observă supresia axei HPA, trebuie să se încerce retragerea medicamentului, reducerea frecvenței de aplicare sau înlocuirea cu un corticosteroid mai puțin puternic. Recuperarea funcției axei HPA este, în general, promptă la întreruperea tratamentului cu corticosteroizi topici. Rareori, pot apărea semne și simptome de insuficiență glucocorticosteroidiană care necesită corticosteroizi sistemici suplimentari. Pentru informații privind administrarea de suplimente sistemice, vezi informațiile de prescriere pentru aceste produse.
Pacienții pediatrici pot fi mai susceptibili la toxicitate sistemică în cazul unor doze echivalente, datorită raportului mai mare dintre suprafața cutanată și masa corporală (vezi pct. PRECAUȚII: Utilizare pediatrică).
În cazul apariției iritației, Ultravate Cream trebuie întrerupt și trebuie instituit un tratament adecvat. Dermatita alergică de contact cu corticosteroizi este de obicei diagnosticată prin observarea lipsei de vindecare, mai degrabă decât prin observarea unei exacerbări clinice, ca în cazul majorității produselor topice care nu conțin corticosteroizi. O astfel de observație trebuie să fie coroborată cu teste patch de diagnosticare adecvate.
Dacă sunt prezente sau apar infecții cutanate concomitente, trebuie utilizat un agent antifungic sau antibacterian adecvat. Dacă nu apare prompt un răspuns favorabil, utilizarea Ultravate Cream trebuie întreruptă până când infecția a fost controlată în mod adecvat.
Ultravate Cream nu trebuie utilizat în tratamentul rozaceei sau al dermatitei periorale și nu trebuie utilizat pe față, în zona inghinală sau în axile.
Informații pentru pacienți
Pacienții care utilizează corticosteroizi topici trebuie să primească următoarele informații și instrucțiuni:
- Medicamentul trebuie utilizat conform indicațiilor medicului. Este numai pentru uz extern. Evitați contactul cu ochii.
- Medicamentul nu trebuie utilizat pentru alte afecțiuni decât cele pentru care a fost prescris.
- Zona de piele tratată nu trebuie bandajată, acoperită sau înfășurată în alt mod, astfel încât să fie ocluzivă, cu excepția cazului în care este indicat de medic.
- Pacienții trebuie să raporteze medicului orice semne de reacții adverse locale.
Teste de laborator
Următoarele teste pot fi utile în evaluarea pacienților pentru suprimarea axei HPA: Testul de stimulare ACTH; Testul de cortizol plasmatic A.M.; Testul de cortizol liber urinar.
Carcinogeneză, mutageneză și afectarea fertilității
Nu au fost efectuate studii pe termen lung pe animale pentru a evalua potențialul carcinogen al propionatului de halobetasol. Au fost observate efecte pozitive de mutagenitate în două teste de genotoxicitate. Propionatul de halobetasol a fost pozitiv într-un test de micronucleu pe hamster chinezesc și într-un test de mutație a genei limfomului de șoarece in vitro.
Studiile efectuate la șobolan în urma administrării orale la doze de până la 50 µg/kg/zi nu au indicat nici o afectare a fertilității sau a performanțelor generale de reproducere.
În alte teste de genotoxicitate, propionatul de halobetasol nu s-a dovedit a fi genotoxic în testul Ames/Salmonella, în testul de schimb de cromatide surori în celulele somatice ale hamsterului chinezesc, în studiile de aberații cromozomiale ale celulelor germinale și somatice ale rozătoarelor și într-un test spot la mamifere pentru determinarea mutațiilor punctiforme.
Femeia
Efecte teratogene: Categoria de sarcină C
Corticosteroizii s-au dovedit a fi teratogeni la animalele de laborator atunci când sunt administrați pe cale sistemică la doze relativ mici. Unii corticosteroizi s-au dovedit a fi teratogeni după aplicarea cutanată la animalele de laborator.
Propionatul de halobetasol s-a dovedit a fi teratogen la șobolani SPF și la iepuri de tip chinchilla atunci când a fost administrat pe cale sistemică în timpul gestației la doze de 0,04 până la 0,1 mg/kg la șobolani și 0,01 mg/kg la iepuri. Aceste doze sunt de aproximativ 13, 33 și, respectiv, 3 ori mai mari decât doza topică umană de Ultravate Cream. Propionatul de halobetasol a fost embriotoxic la iepuri, dar nu și la șobolani.
Au fost observate cazuri de palat stâng la șobolani și la iepuri. Omfalocelul a fost observat la șobolani, dar nu și la iepuri.
Nu există studii adecvate și bine controlate privind potențialul teratogen al propionatului de halobetasol la femeile gravide. Ultravate Cream trebuie utilizat în timpul sarcinii numai dacă beneficiul potențial justifică riscul potențial pentru făt.
Mamele care alăptează
Corticosteroizii administrați sistemic apar în laptele uman și ar putea suprima creșterea, interfera cu producția endogenă de corticosteroizi sau provoca alte efecte neplăcute. Nu se știe dacă administrarea topică de corticosteroizi ar putea duce la o absorbție sistemică suficientă pentru a produce cantități detectabile în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, trebuie să se manifeste prudență atunci când Ultravate Cream este administrat la o femeie care alăptează.
Utilizare pediatrică
Siguranța și eficacitatea Ultravate Cream la pacienții pediatrici nu au fost stabilite și nu se recomandă utilizarea la pacienții pediatrici sub 12 ani. Din cauza unui raport mai mare între suprafața cutanată și masa corporală, pacienții pediatrici prezintă un risc mai mare decât adulții de supresie a axei HPA și de sindrom Cushing atunci când sunt tratați cu corticosteroizi topici. Prin urmare, aceștia prezintă, de asemenea, un risc mai mare de insuficiență suprarenală în timpul sau după întreruperea tratamentului. Efecte adverse, inclusiv striații, au fost raportate în cazul utilizării necorespunzătoare a corticosteroizilor topici la sugari și copii.
Supresia axei HPA, sindromul Cushing, retardul de creștere liniară, creșterea în greutate întârziată și hipertensiunea intracraniană au fost raportate la copiii care primesc corticosteroizi topici. Manifestările de supresie suprarenală la copii includ niveluri plasmatice scăzute de cortizol și absența răspunsului la stimularea ACTH. Manifestările hipertensiunii intracraniene includ fontanele bombate, dureri de cap și papilism bilateral.
Utilizare în scopuri geriatrice
Din aproximativ 400 de pacienți tratați cu Ultravate Cream în studiile clinice, 25% aveau vârsta de 61 ani și peste și 6% aveau vârsta de 71 ani și peste. Nu au fost observate diferențe generale în ceea ce privește siguranța sau eficacitatea între acești pacienți și pacienții mai tineri; și alte experiențe clinice raportate nu au identificat diferențe în ceea ce privește răspunsurile între pacienții vârstnici și cei mai tineri, dar nu poate fi exclusă o sensibilitate mai mare a unor persoane în vârstă.
Reacții adverse
În studiile clinice controlate, cele mai frecvente reacții adverse raportate pentru Ultravate Cream au inclus înțepături, arsuri sau mâncărimi la 4,4% dintre pacienți. Reacțiile adverse raportate mai puțin frecvent au fost: piele uscată, eritem, atrofie cutanată, leucodermie, vezicule și erupții cutanate.
Următoarele reacții adverse locale suplimentare sunt raportate rar cu corticosteroizi topici și pot apărea mai frecvent cu corticosteroizi cu potență mare, cum ar fi Ultravate Cream. Aceste reacții sunt enumerate într-o ordine aproximativ descrescătoare de apariție: foliculită, hipertricoză, erupții acneiforme, hipopigmentare, dermatită periorală, dermatită alergică de contact, infecție secundară, striații și miliaria.
Supradozaj
Ultravate Cream aplicat topic poate fi absorbit în cantități suficiente pentru a produce efecte sistemice (vezi pctPrecauții).
Ultravate Cremă Doze și mod de administrare
Aplicați un strat subțire de Ultravate Cremă pe pielea afectată o dată sau de două ori pe zi, conform indicațiilor medicului dumneavoastră, și frecați ușor și complet.
Ultravate (propionat de halobetasol cremă) Cremă este un corticosteroid topic cu potență foarte mare; prin urmare, tratamentul trebuie limitat la două săptămâni și nu trebuie utilizate cantități mai mari de 50 g/săptămână. Ca și în cazul altor corticosteroizi, terapia trebuie întreruptă atunci când se obține controlul. Dacă nu se observă nicio ameliorare în decurs de 2 săptămâni, poate fi necesară reevaluarea diagnosticului.
Ultravate Cream nu trebuie utilizat cu pansamente ocluzive.
Cum se eliberează Ultravate Cream
Ultravate® (cremă de propionat de halobetasol) Cremă, 0.05% este furnizată în următoarele mărimi de tub:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
STABILIZARE
Să se păstreze între 15°C și 30°C (59°F și 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (plat), 09-0086 (pliat)
Revizuit în mai 2010
Eticheta ambalajului.PANOUL PRINCIPAL DE AFIȘARE

Etichetă pentru containere de 15 grame

Etichetă pentru cutii de carton de 15 grame

Etichetă pentru containere de 50 de grame

Etichetă pentru cutii de carton de 50 de grame
| ULTRAVATE halobetasol propionat cremă |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
| ambalaj |
# |
Codul articolului |
Descrierea ambalajului |
1 |
NDC:10631-103-15 |
|
15 g în 1 tub |
2 |
NDC:10631-103-50 |
|
50 g în 1 TUBE |
|
||||||||||||
| Informații de comercializare | ||||
| Categoria de comercializare | Numărul cererii sau monografia Citare | Data de începere a comercializării | Data de încheiere a comercializării | |
| NDA | NDA019967 | 03/16/2009 | ||
Etichetant – Ranbaxy Laboratories Inc. (169932519)
Titularul înregistrării – Ranbaxy Laboratories Inc. (169932519)
| Stabilire | |||
| Nume | Adresă | ID/FEI | Operațiuni |
| Contract Pharmaceuticals Limited | 248761249 | producție | |
Întrebări frecvente
- Halobetasol vs. clobetasol – cum se compară?
- Se poate utiliza pentru iederă otrăvitoare?
- Se poate utiliza pe scalp?
Mai multe despre Ultravate (halobetasol topic)
- Efecte secundare
- În timpul sarcinii sau alăptării
- Dosare Informații
- Interacțiuni medicamentoase
- Preț & Cupoane
- En Español
- 6 Recenzii
- Disponibilitate generică
- Clasa de medicament: steroizi topici
Resurse pentru consumatori
- Informații pentru pacienți
- Ultravate (lectură avansată)
Resurse pentru profesioniști
- Informații de prescriere
Alte mărci Lexette, Bryhali, Halonat
Ghiduri terapeutice conexe
- Psoriazis
- Dermatită atopică
- Dermatită
- Eczema
Denunțare medicală
.