Nombre genérico: propionato de halobetasol
Forma de dosificación: crema
Revisado médicamente por Drugs.com. Última actualización: 21 de abril de 2020.
- Presentación
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
- Descripción de la crema Ultravate
- Crema de Ultravate – Farmacología clínica
- Farmacocinética
- Indicaciones y uso de Ultravate Crema
- Contraindicaciones
- Precauciones
- Generales
- Información para los pacientes
- Pruebas de laboratorio
- Carcinogénesis, mutagénesis y deterioro de la fertilidad
- Embarazo
- Madres lactantes
- Uso pediátrico
- Uso geriátrico
- Reacciones adversas
- Sobredosificación
- Dosis y administración de Ultravate Crema
- ¿Cómo se suministra Ultravate Crema
- Almacenamiento
- Etiqueta de embalaje.PANEL DE PRESENTACIÓN PRINCIPAL
- Preguntas frecuentes
- Más información sobre Ultravate (halobetasol tópico)
- Recursos para el consumidor
- Recursos para el profesional
- Guías de tratamiento relacionadas
Descripción de la crema Ultravate
Ultravate® (propionato de halobetasol en crema), 0.05% contiene propionato de halobetasol, un corticosteroide sintético de uso dermatológico tópico. Los corticosteroides constituyen una clase de esteroides principalmente sintéticos que se utilizan por vía tópica como agente antiinflamatorio y antipruriginoso.
Químicamente el propionato de halobetasol es 21-cloro-6α, 9-difluoro-11β, 17-dihidroxi-16β-metilpregna-1, 4-dieno-3-20-diona, 17-propionato, C25H31ClF2O5. Tiene la siguiente fórmula estructural:
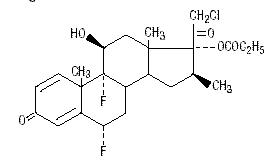
El propionato de halobetasol tiene un peso molecular de 485. Es un polvo cristalino blanco insoluble en agua.
Cada gramo de crema Ultravate contiene 0,5 mg/g de propionato de halobetasol en una base de crema de alcohol cetílico, glicerina, isoestearato de isopropilo, palmitato de isopropilo, esteareth-21, diazolidinil urea, metilcloroisotiazolinona, (y) metilisotiazolinona y agua.
Crema de Ultravate – Farmacología clínica
Al igual que otros corticosteroides tópicos, el propionato de halobetasol tiene acciones antiinflamatorias, antipruriginosas y vasoconstrictoras. El mecanismo de la actividad antiinflamatoria de los corticosteroides tópicos, en general, no está claro. Sin embargo, se cree que los corticosteroides actúan mediante la inducción de proteínas inhibidoras de la fosfolipasa A2, denominadas colectivamente lipocortinas. Se postula que estas proteínas controlan la biosíntesis de potentes mediadores de la inflamación, como las prostaglandinas y los leucotrienos, inhibiendo la liberación de su precursor común, el ácido araquidónico. El ácido araquidónico es liberado de los fosfolípidos de la membrana por la fosfolipasa A2.
Farmacocinética
El grado de absorción percutánea de los corticosteroides tópicos está determinado por muchos factores, entre ellos el vehículo y la integridad de la barrera epidérmica. No se ha demostrado que los apósitos oclusivos con hidrocortisona durante un máximo de 24 horas aumenten la penetración; sin embargo, la oclusión de hidrocortisona durante 96 horas aumenta notablemente la penetración. Los corticosteroides tópicos pueden ser absorbidos por la piel normal intacta. La inflamación y/u otros procesos de enfermedad en la piel pueden aumentar la absorción percutánea.
Los estudios en humanos y animales indican que menos del 6% de la dosis aplicada de propionato de halobetasol entra en la circulación en las 96 horas siguientes a la administración tópica de la crema.
Los estudios realizados con Ultravate Crema indican que se encuentra en el rango de potencia superalta en comparación con otros corticosteroides tópicos.
Indicaciones y uso de Ultravate Crema
Ultravate Crema 0,05% es un corticosteroide de potencia superalta indicado para el alivio de las manifestaciones inflamatorias y pruriginosas de las dermatosis que responden a los corticosteroides. No se recomienda el tratamiento más allá de dos semanas consecutivas, y la dosis total no debe superar los 50 g/semana debido a la posibilidad de que el fármaco suprima el eje hipotálamo-hipófisis-suprarrenal (HPA). No se recomienda el uso en niños menores de 12 años.
Al igual que con otros corticosteroides de gran actividad, el tratamiento debe interrumpirse cuando se haya conseguido el control. Si no se observa mejoría en el plazo de 2 semanas, puede ser necesario reevaluar el diagnóstico.
Contraindicaciones
Ultravate Crema está contraindicado en aquellos pacientes con antecedentes de hipersensibilidad a cualquiera de los componentes del preparado.
Precauciones
Generales
La absorción sistémica de los corticosteroides tópicos puede producir una supresión reversible del eje hipotálamo-hipofisario-suprarrenal (HPA) con la posibilidad de que se produzca una insuficiencia de glucocorticosteroides tras la retirada del tratamiento. Las manifestaciones del síndrome de Cushing, la hiperglucemia y la glucosuria también pueden producirse en algunos pacientes por la absorción sistémica de los corticosteroides tópicos mientras están en tratamiento.
Los pacientes que se aplican un esteroide tópico en una gran superficie o en áreas bajo oclusión deben ser evaluados periódicamente para detectar evidencias de supresión del eje HPA. Esto puede hacerse mediante el uso de las pruebas de estimulación de ACTH, cortisol plasmático A.M. y cortisol libre en orina. Los pacientes que reciben corticoesteroides superpotentes no deben ser tratados durante más de 2 semanas seguidas y sólo deben tratarse pequeñas áreas a la vez debido al mayor riesgo de supresión del HPA.
Ultravate Cream produjo supresión del eje HPA cuando se utilizó en dosis divididas de 7 gramos al día durante una semana en pacientes con psoriasis. Estos efectos fueron reversibles al suspender el tratamiento.
Si se observa una supresión del eje HPA, debe intentarse retirar el fármaco, reducir la frecuencia de aplicación o sustituirlo por un corticosteroide menos potente. La recuperación de la función del eje HPA suele ser rápida tras la interrupción de los corticosteroides tópicos. Con poca frecuencia, pueden aparecer signos y síntomas de insuficiencia de glucocorticosteroides que requieran corticosteroides sistémicos suplementarios. Para información sobre la suplementación sistémica, véase la información de prescripción de esos productos.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica de dosis equivalentes debido a su mayor superficie de piel en relación con la masa corporal (véase PRECAUCIONES: Uso pediátrico).
Si se desarrolla irritación, se debe interrumpir Ultravate Crema e instituir una terapia apropiada. La dermatitis alérgica de contacto con corticosteroides se diagnostica normalmente al observar la falta de curación en lugar de observar una exacerbación clínica como ocurre con la mayoría de los productos tópicos que no contienen corticosteroides. Dicha observación debe corroborarse con una prueba de parche diagnóstica apropiada.
Si hay o se desarrollan infecciones cutáneas concomitantes, debe utilizarse un agente antifúngico o antibacteriano apropiado. Si no se produce una respuesta favorable con prontitud, debe interrumpirse el uso de Ultravate Crema hasta que la infección se haya controlado adecuadamente.
Ultravate Crema no debe utilizarse en el tratamiento de la rosácea o la dermatitis perioral, y no debe utilizarse en la cara, la ingle o las axilas.
Información para los pacientes
Los pacientes que utilicen corticosteroides tópicos deben recibir la siguiente información e instrucciones:
- El medicamento debe utilizarse según las indicaciones del médico. Es para uso externo solamente. Evite el contacto con los ojos.
- El medicamento no debe utilizarse para ningún otro trastorno que no sea aquel para el que se prescribió.
- La zona de la piel tratada no debe vendarse, cubrirse o envolverse de otro modo, de manera que sea oclusiva, a menos que lo indique el médico.
- Los pacientes deben informar a su médico de cualquier signo de reacciones adversas locales.
Pruebas de laboratorio
Las siguientes pruebas pueden ser útiles para evaluar a los pacientes para la supresión del eje HPA: Prueba de estimulación de ACTH; Prueba de cortisol plasmático A.M.; Prueba de cortisol libre en orina.
Carcinogénesis, mutagénesis y deterioro de la fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico del propionato de halobetasol. Se observaron efectos positivos de mutagenicidad en dos ensayos de genotoxicidad. El propionato de halobetasol fue positivo en una prueba de micronúcleos en hámsteres chinos, y en un ensayo de mutación del gen del linfoma de ratón in vitro.
Los estudios realizados en la rata tras la administración oral a niveles de dosis de hasta 50 µg/kg/día no indicaron ningún deterioro de la fertilidad o del rendimiento reproductivo general.
En otras pruebas de genotoxicidad, el propionato de halobetasol no resultó ser genotóxico en el ensayo de Ames/Salmonella, en la prueba de intercambio de cromátidas hermanas en células somáticas del hámster chino, en los estudios de aberración cromosómica de células germinales y somáticas de roedores, y en una prueba de manchas de mamíferos para determinar mutaciones puntuales.
Embarazo
Efectos teratogénicos: Embarazo Categoría C
Los corticosteroides han demostrado ser teratogénicos en animales de laboratorio cuando se administran sistémicamente a niveles de dosis relativamente bajos. Algunos corticosteroides han demostrado ser teratogénicos tras su aplicación dérmica en animales de laboratorio.
El propionato de halobetasol ha demostrado ser teratogénico en ratas SPF y conejos tipo chinchilla cuando se administra por vía sistémica durante la gestación a dosis de 0,04 a 0,1 mg/kg en ratas y 0,01 mg/kg en conejos. Estas dosis son aproximadamente 13, 33 y 3 veces, respectivamente, la dosis tópica humana de Ultravate Crema. El propionato de halobetasol fue embriotóxico en conejos pero no en ratas.
Se observó paladar hendido tanto en ratas como en conejos. Se observó onfalocele en ratas, pero no en conejos.
No existen estudios adecuados y bien controlados sobre el potencial teratogénico del propionato de halobetasol en mujeres embarazadas. Ultravate Crema debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Los corticosteroides administrados sistémicamente aparecen en la leche humana y podrían suprimir el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos. No se sabe si la administración tópica de corticosteroides podría dar lugar a una absorción sistémica suficiente para producir cantidades detectables en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, se debe tener precaución cuando se administre Ultravate Crema a una mujer en periodo de lactancia.
Uso pediátrico
No se ha establecido la seguridad y eficacia de Ultravate Crema en pacientes pediátricos y no se recomienda su uso en pacientes pediátricos menores de 12 años. Debido a una mayor relación entre la superficie de la piel y la masa corporal, los pacientes pediátricos tienen un mayor riesgo que los adultos de sufrir supresión del eje HPA y síndrome de Cushing cuando son tratados con corticosteroides tópicos. Por lo tanto, también tienen un mayor riesgo de insuficiencia suprarrenal durante o después de la retirada del tratamiento. Se han notificado efectos adversos, incluyendo estrías, con el uso inadecuado de corticosteroides tópicos en lactantes y niños.
Se ha notificado supresión del eje HPA, síndrome de Cushing, retraso en el crecimiento lineal, retraso en el aumento de peso e hipertensión intracraneal en niños que reciben corticosteroides tópicos. Las manifestaciones de la supresión suprarrenal en los niños incluyen niveles bajos de cortisol en plasma y una ausencia de respuesta a la estimulación con ACTH. Las manifestaciones de la hipertensión intracraneal incluyen fontanelas abultadas, cefaleas y papiledema bilateral.
Uso geriátrico
De aproximadamente 400 pacientes tratados con Ultravate Crema en estudios clínicos, el 25% tenía 61 años o más y el 6% tenía 71 años o más. No se observaron diferencias generales en la seguridad o eficacia entre estos pacientes y los más jóvenes; y otra experiencia clínica comunicada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos de edad avanzada.
Reacciones adversas
En los ensayos clínicos controlados, los acontecimientos adversos más frecuentes comunicados para Ultravate Crema incluyeron escozor, ardor o picor en el 4,4% de los pacientes. Las reacciones adversas notificadas con menor frecuencia fueron piel seca, eritema, atrofia cutánea, leucodermia, vesículas y erupción cutánea.
Las siguientes reacciones adversas locales adicionales se notifican con poca frecuencia con corticosteroides tópicos, y pueden ocurrir con mayor frecuencia con corticosteroides de alta potencia, como Ultravate Crema. Estas reacciones se enumeran en un orden decreciente aproximado de aparición: foliculitis, hipertricosis, erupciones acneiformes, hipopigmentación, dermatitis perioral, dermatitis alérgica de contacto, infección secundaria, estrías y miliaria.
Sobredosificación
La crema Ultravate aplicada por vía tópica puede ser absorbida en cantidades suficientes para producir efectos sistémicos (ver PRECAUCIONES).
Dosis y administración de Ultravate Crema
Aplique una fina capa de Ultravate Crema sobre la piel afectada una o dos veces al día, según las indicaciones de su médico, y frote suave y completamente.
Ultravate (halobetasol propionato crema) Crema es un corticosteroide tópico de muy alta potencia; por lo tanto, el tratamiento debe limitarse a dos semanas, y no deben utilizarse cantidades superiores a 50 g/semana. Al igual que con otros corticosteroides, el tratamiento debe interrumpirse cuando se logre el control. Si no se observa ninguna mejoría en el plazo de 2 semanas, puede ser necesario reevaluar el diagnóstico.
Ultravate Crema no debe utilizarse con apósitos oclusivos.
¿Cómo se suministra Ultravate Crema
Ultravate® (propionato de halobetasol crema) Crema, 0.05% se presenta en los siguientes tamaños de tubo:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
Almacenamiento
Almacenar entre 15°C y 30°C (59°F y 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (plano), 09-0086 (plegado)
Revisado en mayo de 2010
Etiqueta de embalaje.PANEL DE PRESENTACIÓN PRINCIPAL

Etiqueta de envase de 15 gramos

Etiqueta de cartón de 15 gramos

Etiqueta de envase de 50 gramos

Etiqueta de cartón de 50 gramos
| ULTRAVATE propionato de halobetasol en crema |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiquetador – Ranbaxy Laboratories Inc. (169932519)
Registrador – Ranbaxy Laboratories Inc. (169932519)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Contract Pharmaceuticals Limited | 248761249 | fabricación | |
Preguntas frecuentes
- Halobetasol frente a clobetasol – ¿cómo se comparan?
- ¿Se puede utilizar para la hiedra venenosa?
- ¿Se puede utilizar en el cuero cabelludo?
Más información sobre Ultravate (halobetasol tópico)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Dosis Información
- Interacciones medicamentosas
- Precios&Cupones
- En Español
- 6 Reseñas
- Disponibilidad genérica
- Clase de medicamentos: esteroides tópicos
Recursos para el consumidor
- Información para el paciente
- Ultravate (lectura avanzada)
Recursos para el profesional
- Información para la prescripción
Otras marcas Lexette, Bryhali, Halonate
Guías de tratamiento relacionadas
- Poriasis
- Dermatitis atópica
- Dermatitis
- Eczema
Aviso médico