Geneerinen nimi: halobetasolpropionaatti
Dosointimuoto: kerma
Lääketieteellisesti tarkistanut Drugs.com. Päivitetty viimeksi 21. huhtikuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Professori
- Vuorovaikutukset
- Lisätiedot
- Ultravate-voide Kuvaus
- Ultravate Cream – Kliininen farmakologia
- Farmakokinetiikka
- Ultravate-voiteen käyttöaiheet ja käyttö
- Vasta-aiheet
- Varotoimet
- Yleistä
- Tietoa potilaille
- Laboratoriokokeet
- Karsinogeneesi, mutageneesi ja hedelmällisyyden heikentyminen
- Raskaudelle altistuminen
- Imettävät äidit
- Pediatrinen käyttö
- Geriatrinen käyttö
- Haittavaikutukset
- Yliannostus
- Ultravate-voiteen annostus ja antotapa
- Miten Ultravate-voidetta toimitetaan
- VARASTOINTI
- PAKKAUSSELOSTE.PAKKAUSETIKETTI
- Tiheästi kysytyt kysymykset
- Lisätietoa Ultravate-valmisteesta (halobetasoli paikallisesti)
- Kuluttajan resurssit
- Professionaaliset resurssit
- Hoitoon liittyvät oppaat
Ultravate-voide Kuvaus
Ultravate® -voide (halobetasolipropionaatti voide) voide, 0,0 g/l.05 % sisältää halobetasolipropionaattia, synteettistä kortikosteroidia paikalliseen dermatologiseen käyttöön. Kortikosteroidit muodostavat ensisijaisesti synteettisten steroidien luokan, jota käytetään paikallisesti tulehdusta ja kutinaa ehkäisevänä aineena.
Kemiallisesti halobetasolipropionaatti on 21-kloori-6α, 9-difluori-11β, 17-dihydroksi-16β-metyylipregna-1, 4-dieeni-3-20-dioni, 17-propionaatti, C25H31ClF2O5. Sillä on seuraava rakennekaava:
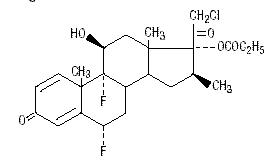
Halobetasolipropionaatin molekyylipaino on 485. Se on valkoinen kiteinen jauhe, joka ei liukene veteen.
Jokainen gramma Ultravate-voidetta sisältää 0,5 mg/g halobetasolipropionaattia voidepohjassa, joka koostuu setyylialkoholista, glyseriinistä, isopropyyli-isostearaatista, isopropyylipalmitaatista, stearaatti-21:stä, diatsolidinyylihappokarbamidista, metyylikloori-isotiatsolinonista (ja) metyylikloori-isotiatsolinonista ja vedestä.
Ultravate Cream – Kliininen farmakologia
Kuten muillakin paikallisesti käytettävillä kortikosteroideilla, halobetasolipropionaatilla on tulehdusta, kutinaa ja verisuonia supistavia vaikutuksia. Paikallisten kortikosteroidien anti-inflammatorisen vaikutuksen mekanismi on yleisesti ottaen epäselvä. Kortikosteroidien uskotaan kuitenkin vaikuttavan indusoimalla fosfolipaasi A2:ta estäviä proteiineja, joita kutsutaan yhteisnimellä lipokortiineiksi. On oletettu, että nämä proteiinit kontrolloivat voimakkaiden tulehduksen välittäjäaineiden, kuten prostaglandiinien ja leukotrieenien, biosynteesiä estämällä niiden yhteisen esiasteen arakidonihapon vapautumista. Arakidonihappo vapautuu kalvon fosfolipideistä fosfolipaasi A2:n avulla.
Farmakokinetiikka
Paikallisesti käytettävien kortikosteroidien perkutaanisen imeytymisen laajuus määräytyy monien tekijöiden mukaan lukien kantaja-aine ja epidermaalisen esteen eheys. Hydrokortisonia sisältävien okklusiivisten sidosten ei ole osoitettu lisäävän penetraatiota 24 tuntiin asti, mutta hydrokortisonin okkluusio 96 tunnin ajan lisää penetraatiota selvästi. Paikalliset kortikosteroidit voivat imeytyä normaalista ehjästä ihosta. Ihon tulehdus ja/tai muut sairausprosessit voivat lisätä perkutaanista imeytymistä.
Ihmisillä ja eläimillä tehdyt tutkimukset osoittavat, että alle 6 % käytetystä halobetasolipropionaattiannoksesta pääsee verenkiertoon 96 tunnin kuluessa voiteen paikallisesta antamisesta.
Ultravate-voiteella tehdyt tutkimukset osoittavat, että se on teholtaan superkorkealla tehoalueella verrattuna muihin paikallisesti käytettäviin kortikosteroideihin.
Ultravate-voiteen käyttöaiheet ja käyttö
Ultravate-voide 0,05 % on superkorkean tehon kortikosteroidi, joka on tarkoitettu tulehduksellisten ja kutisevien ilmenemismuotojen lievittämiseen kortikosteroidiin reagoivissa ihottumissa. Kahta peräkkäistä viikkoa pidempää hoitoa ei suositella, eikä kokonaisannos saisi ylittää 50 g/viikko, koska lääke saattaa tukahduttaa hypotalamus-aivolisäke-lisämunuais-akselia (HPA). Käyttöä alle 12-vuotiaille lapsille ei suositella.
Kuten muidenkin erittäin aktiivisten kortikosteroidien kohdalla, hoito on lopetettava, kun kontrolli on saavutettu. Jos paranemista ei havaita 2 viikon kuluessa, diagnoosin uudelleenarviointi voi olla tarpeen.
Vasta-aiheet
Ultravate Cream on vasta-aiheinen niille potilaille, joilla on todettu yliherkkyyttä valmisteen jollekin aineosalle.
Varotoimet
Yleistä
Topikaalisten kortikosteroidien systeeminen imeytyminen voi aiheuttaa palautuvaa hypotalamus-aivolisäke-lisämunuaiskuori-lisämunuaiskuori-akselin (HPA-akselin) suppressiota, johon voi liittyä glukokortikosteroidien vajaatoiminta hoidon lopettamisen jälkeen. Cushingin oireyhtymän ilmenemismuotoja, hyperglykemiaa ja glukosuriaa voi joillakin potilailla aiheuttaa myös paikalliskortikosteroidien systeeminen imeytyminen hoidon aikana.
Potilaita, jotka käyttävät paikalliskortikosteroidia suurelle pinta-alalle tai okkluusiossa oleville alueille, on arvioitava säännöllisesti HPA-akselin suppression merkkien varalta. Tämä voidaan tehdä käyttämällä ACTH-stimulaatio-, A.M.-plasman kortisoli- ja virtsan vapaan kortisolin testejä. Potilaita, jotka saavat erittäin voimakkaita kortikosteroideja, ei tulisi hoitaa yli kahta viikkoa kerrallaan, ja kerrallaan tulisi hoitaa vain pieniä alueita HPA-suppression lisääntyneen riskin vuoksi.
Ultravate Cream tuotti HPA-akselin suppressiota, kun sitä käytettiin jaettuina annoksina 7 grammaa päivässä yhden viikon ajan psoriaasipotilailla. Nämä vaikutukset olivat palautuvia, kun hoito lopetettiin.
Jos HPA-akselin suppressiota havaitaan, on yritettävä vetää lääke pois, vähentää käyttötiheyttä tai korvata se vähemmän voimakkaalla kortikosteroidilla. HPA-akselin toiminta palautuu yleensä nopeasti, kun paikalliset kortikosteroidit lopetetaan. Harvoin voi esiintyä glukokortikosteroidien vajaatoiminnan merkkejä ja oireita, jotka edellyttävät systeemisten kortikosteroidien lisäystä. Tietoa systeemisestä lisäannostelusta, ks. kyseisten valmisteiden lääkemääräystiedot.
Pediatriset potilaat voivat olla alttiimpia vastaavien annosten aiheuttamalle systeemiselle toksisuudelle johtuen heidän suuremmasta ihon pinta-alan ja ruumiinpainon suhteesta (ks. VAROTOIMENPITEET: Pediatrinen käyttö).
Jos ärsytystä kehittyy, Ultravate-voide on lopetettava ja aloitettava asianmukainen hoito. Allerginen kosketusihottuma, jossa on kortikosteroideja, diagnosoidaan yleensä tarkkailemalla paranemisen epäonnistumista eikä havaitsemalla kliinistä pahenemisvaihetta, kuten useimmilla paikallisilla valmisteilla, jotka eivät sisällä kortikosteroideja. Tällainen havainto on vahvistettava asianmukaisella diagnostisella laastaritestillä.
Jos samanaikaisia ihoinfektioita esiintyy tai kehittyy, on käytettävä asianmukaista sienilääkettä tai antibakteerista ainetta. Jos suotuisaa vastetta ei ilmene nopeasti, Ultravate-voiteen käyttö on lopetettava, kunnes infektio on saatu riittävästi hallintaan.
Ultravate-voidetta ei saa käyttää ruusufinnin tai perioraalisen dermatiitin hoitoon, eikä sitä saa käyttää kasvoilla, nivusissa tai kainaloissa.
Tietoa potilaille
Potilaille, jotka käyttävät paikallisia kortikosteroideja, on annettava seuraavat tiedot ja ohjeet:
- Lääkettä on käytettävä lääkärin ohjeiden mukaisesti. Se on tarkoitettu vain ulkoiseen käyttöön. Vältä kosketusta silmien kanssa.
- Lääkettä ei saa käyttää muuhun sairauteen kuin siihen, johon se on määrätty.
- Hoitoa saavaa ihoaluetta ei saa sitoa, peittää tai kääriä muulla tavoin okklusiiviseksi, ellei lääkäri ole määrännyt.
- Potilaiden tulee ilmoittaa lääkärille kaikista paikallisista haittavaikutusten merkeistä.
Laboratoriokokeet
Seuraavista kokeista voi olla apua arvioitaessa potilaita HPA-akselin suppression varalta: ACTH-stimulaatiotesti; A.M. plasman kortisolitesti; Virtsan vapaan kortisolin testi.
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikentyminen
Pitkäkestoisia eläinkokeita ei ole tehty halobetasolipropionaatin karsinogeenisen potentiaalin arvioimiseksi. Positiivisia mutageenisia vaikutuksia havaittiin kahdessa genotoksisuuskokeessa. Halobetasolipropionaatti oli positiivinen kiinalaisen hamsterin mikronukleuskokeessa ja hiiren lymfoomageenin mutaatiomäärityksessä in vitro.
Tutkimukset rotalla oraalisen annostelun jälkeen annostasolla enintään 50 µg/kg/vrk eivät osoittaneet hedelmällisyyden tai yleisen lisääntymiskyvyn heikkenemistä.
Muissa genotoksisuustesteissä halobetasolipropionaatin ei todettu olevan genotoksinen Ames/Salmonella-testissä, sisarkromatidien vaihtotestissä kiinalaisen hamsterin somaattisissa soluissa, kromosomipoikkeavuustutkimuksissa jyrsijöiden sukusoluilla ja somaattisilla soluilla sekä nisäkkäiden pistemutaatioiden määrittämiseen tarkoitetussa pistemäisessä pistekokeessa.
Raskaudelle altistuminen
Teratogeeniset vaikutukset: Raskausluokka C
Kortikosteroidien on osoitettu olevan teratogeenisia koe-eläimillä, kun niitä on annettu systeemisesti suhteellisen pieninä annoksina. Joidenkin kortikosteroidien on osoitettu olevan teratogeenisia iholle annostelun jälkeen koe-eläimillä.
Halobetasolipropionaatin on osoitettu olevan teratogeeninen SPF-rotilla ja chinchilla-tyyppisillä kaneilla, kun sitä on annettu systeemisesti tiineyden aikana annoksina 0,04-0,1 mg/kg rotilla ja 0,01 mg/kg kaneilla. Nämä annokset ovat noin 13-, 33- ja 3-kertaiset Ultravate Cream -voiteen paikallisesti käytettävään ihmisannokseen verrattuna. Halobetasolipropionaatti oli alkiontoksinen kaneilla, mutta ei rotilla.
Sekä rotilla että kaneilla havaittiin suulakihalkioita. Omphalocelea havaittiin rotilla, mutta ei kaneilla.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia halobetasolipropionaatin teratogeenisesta potentiaalista raskaana olevilla naisilla. Ultravate Cream -voidetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imettävät äidit
Systeemisesti annetut kortikosteroidit esiintyvät ihmismaidossa, ja ne voivat tukahduttaa kasvua, häiritä endogeenista kortikosteroidituotantoa tai aiheuttaa muita ei-toivottuja vaikutuksia. Ei tiedetä, voisiko kortikosteroidien paikallinen anto johtaa riittävään systeemiseen imeytymiseen, jotta ihmismaidossa olisi havaittavia määriä. Koska monet lääkkeet erittyvät ihmismaitoon, on noudatettava varovaisuutta, kun Ultravate-voidetta annetaan imettävälle naiselle.
Pediatrinen käyttö
Ultravate-voiteen turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu, eikä käyttöä alle 12-vuotiaille lapsipotilaille suositella. Koska ihon pinta-alan suhde kehon massaan on suurempi, lapsipotilailla on aikuisia suurempi riski HPA-akselin suppressioon ja Cushingin oireyhtymään, kun heitä hoidetaan paikallisesti käytettävillä kortikosteroideilla. Siksi heillä on myös suurempi lisämunuaisen vajaatoiminnan riski hoidon aikana tai sen lopettamisen jälkeen. Paikallisesti käytettävien kortikosteroidien epätarkoituksenmukaisen käytön yhteydessä imeväisillä ja lapsilla on raportoitu haittavaikutuksia, kuten striaatioita.
Paikallisesti käytettäviä kortikosteroideja saavilla lapsilla on raportoitu HPA-akselin suppressiota, Cushingin oireyhtymää, lineaarista kasvun hidastumista, viivästynyttä painonnousua ja kallonsisäistä hypertensiota. Lisämunuaisen suppression ilmenemismuotoja lapsilla ovat alhaiset plasman kortisolipitoisuudet ja ACTH-stimulaatiovasteen puuttuminen. Kallonsisäisen hypertension ilmenemismuotoja ovat pullistuneet fontanellit, päänsärky ja molemminpuolinen papilledema.
Geriatrinen käyttö
Kliinisissä tutkimuksissa Ultravate-voiteella hoidetuista noin 400 potilaasta 25 % oli 61-vuotiaita tai vanhempia ja 6 % oli 71-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehossa, eikä muissa raportoiduissa kliinisissä kokemuksissa ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä, mutta joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Haittavaikutukset
Kontrolloiduissa kliinisissä tutkimuksissa Ultravate-voiteen yleisimpiin raportoituihin haittatapahtumiin kuului kirvelyä, kirvelyä tai kutinaa, joita esiintyi 4,4 %:lla potilaista. Harvemmin raportoituja haittavaikutuksia olivat ihon kuivuminen, eryteema, ihon surkastuminen, leukodermia, rakkulat ja ihottuma.
Seuraavia muita paikallisia haittavaikutuksia raportoidaan harvoin paikallisesti käytettävien kortikosteroidien yhteydessä, ja niitä saattaa esiintyä useammin suuritehoisten kortikosteroidien, kuten Ultravate-voiteen yhteydessä. Nämä reaktiot on lueteltu likimääräisesti vähenevässä esiintymisjärjestyksessä: follikuliitti, hypertrichoosi, akneiformiset eruptiot, hypopigmentaatio, perioraalinen dermatiitti, allerginen kosketusihottuma, sekundaarinen infektio, striae ja miliaaria.
Yliannostus
Pinnalle levitetty Ultravate-voide voi imeytyä riittäviä määriä aiheuttaakseen systeemisiä vaikutuksia (ks. kohtaEHDOTUKSET).
Ultravate-voiteen annostus ja antotapa
Levitä ohut kerros Ultravate-voidetta sairastuneelle iholle kerran tai kaksi kertaa päivässä lääkärin ohjeiden mukaan ja hiero se varovasti ja kokonaan.
Ultravate (halobetasolipropionaatti-voide) -voide on erittäin suuritehoinen paikallisesti käytettävä kortikosteroidi; sen vuoksi hoitoa tulee rajoittaa kahteen viikkoon, eikä yli 50 g/vk:ta suurempia määriä tule käyttää. Kuten muidenkin kortikosteroidien kohdalla, hoito on lopetettava, kun kontrolli on saavutettu. Jos paranemista ei havaita 2 viikon kuluessa, diagnoosin uudelleenarviointi voi olla tarpeen.
Ultravate-voidetta ei saa käyttää okklusiivisten sidosten kanssa.
Miten Ultravate-voidetta toimitetaan
Ultravate® (halobetasolipropionaatti voide) Cream, 0.05 % toimitetaan seuraavissa tuubikokoisissa pakkauksissa:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
VARASTOINTI
Varastoi 15 °C:n ja 30 °C:n (59°F ja 86°F) välillä.
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (tasainen), 09-0086 (taitettu)
Tarkistettu toukokuussa 2010
PAKKAUSSELOSTE.PAKKAUSETIKETTI

15 gramman pakkauksen etiketti

15 gramman kartongin etiketti

50 gramman pakkauksen etiketti

50 gramman kartongin etiketti
| ULTRAVATE halobetasolipropionaatti voide |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiketin – Ranbaxy Laboratories Inc. (169932519)
Rekisteröijä – Ranbaxy Laboratories Inc. (169932519)
| Toimipaikka | |||
| Nimi | Asoite | ID/FEI | Toiminta |
| Contract Pharmaceuticals Limited | 248761249 | valmistus | |
Tiheästi kysytyt kysymykset
- Halobetatsoli vs. klobetatsoli – miten niitä verrataan toisiinsa?
- Voidaanko tätä käyttää myrkkysumakkeeseen?
- Voidaanko tätä käyttää päänahkaan?
Lisätietoa Ultravate-valmisteesta (halobetasoli paikallisesti)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Dositus Tietoa
- Lääkkeiden yhteisvaikutukset
- Hinnoittelu & Kupongit
- En Español
- 6 Arvostelut
- Generic Availability
- Lääkeluokka:
Kuluttajan resurssit
- Potilastiedot
- Ultravate (Tarkennettu lukeminen)
Professionaaliset resurssit
- Valmisteyhteenvedot
- Tietoa lääkkeen määräämisestä
Muut tuotemerkit Lexette, Bryhali, Halonaatti
Hoitoon liittyvät oppaat
- Psoriaasi
- Atopinen ihottuma
- Dermatiitti
- Ekseema
Lääketieteellinen vastuuvapauslauseke