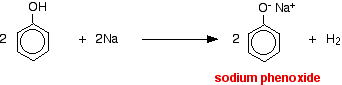Säuregehalt von Phenol
Verbindungen wie Alkohole und Phenol, die eine -OH-Gruppe an einen Kohlenwasserstoff gebunden enthalten, sind sehr schwache Säuren. Alkohole sind so schwach sauer, dass ihr Säuregehalt für normale Laborzwecke praktisch vernachlässigt werden kann. Phenol ist jedoch so sauer, dass es erkennbare saure Eigenschaften hat – auch wenn es eine sehr schwache Säure ist. Ein Wasserstoffion kann sich von der -OH-Gruppe abspalten und auf eine Base übergehen. Zum Beispiel in Lösung in Wasser:

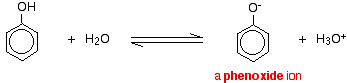
Phenol ist eine sehr schwache Säure und die Gleichgewichtslage liegt weit links. Phenol kann ein Wasserstoffion verlieren, weil das gebildete Phenoxid-Ion bis zu einem gewissen Grad stabilisiert ist. Die negative Ladung des Sauerstoffatoms ist um den Ring herum verlagert. Je stabiler das Ion ist, desto wahrscheinlicher ist es, dass es sich bildet. Eines der einsamen Paare am Sauerstoffatom überschneidet sich mit den delokalisierten Elektronen am Benzolring.
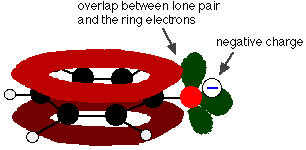
Diese Überschneidung führt zu einer Delokalisierung, die sich vom Ring aus über das Sauerstoffatom erstreckt. Infolgedessen ist die negative Ladung nicht mehr vollständig am Sauerstoffatom lokalisiert, sondern über das gesamte Ion verteilt.
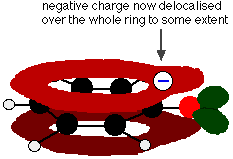
Durch die Verteilung der Ladung ist das Ion stabiler, als wenn die gesamte Ladung am Sauerstoffatom verbleiben würde. Allerdings ist der Sauerstoff das elektronegativste Element im Ion, und die delokalisierten Elektronen werden zu ihm hingezogen. Das bedeutet, dass immer noch eine Menge Ladung um den Sauerstoff herum vorhanden ist, die das Wasserstoffion wieder anzieht. Aus diesem Grund ist Phenol nur eine sehr schwache Säure.
Warum ist Phenol eine viel stärkere Säure als Cyclohexanol? Um diese Frage zu beantworten, müssen wir die Art und Weise untersuchen, in der ein Sauerstoffsubstituent mit dem Benzolring interagiert. Wie bereits in unserer früheren Behandlung der elektrophilen aromatischen Substitutionsreaktionen erwähnt, erhöht ein Sauerstoffsubstituent die Reaktivität des Rings und begünstigt den elektrophilen Angriff an ortho- und para-Stellen. Es wurde vorgeschlagen, dass die Resonanz-Delokalisierung eines nicht gebundenen Sauerstoff-Elektronenpaares in das pi-Elektronensystem des aromatischen Rings für diesen Substituenteneffekt verantwortlich ist. Ein ähnlicher Satz von Resonanzstrukturen für die konjugierte Base des Phenolatanions erscheint unter den Phenolstrukturen.
Die Resonanzstabilisierung in diesen beiden Fällen ist sehr unterschiedlich. Ein wichtiges Prinzip der Resonanz ist, dass die Ladungstrennung die Bedeutung der kanonischen Beiträge zum Resonanzhybrid verringert und die Gesamtstabilisierung reduziert. Die Strukturen, die zum Phenolhybrid beitragen, leiden alle unter Ladungstrennung, was zu einer sehr bescheidenen Stabilisierung dieser Verbindung führt. Andererseits ist das Phenolat-Anion bereits geladen, und die kanonischen Komponenten tragen dazu bei, die Ladung zu verteilen, was zu einer erheblichen Stabilisierung dieser Spezies führt. Die konjugierten Basen der einfachen Alkohole werden nicht durch Ladungsverschiebung stabilisiert, so dass der Säuregrad dieser Verbindungen dem von Wasser ähnelt. Ein Energiediagramm, das die Auswirkung der Resonanz auf die Säuregrade von Cyclohexanol und Phenol zeigt, ist auf der rechten Seite abgebildet. Da die Resonanzstabilisierung der konjugierten Phenolatbase viel größer ist als die Stabilisierung des Phenols selbst, ist der Säuregrad von Phenol im Vergleich zu Cyclohexanol erhöht. Dass die negative Ladung des Phenolats an den ortho- und para-Kohlenstoffen des Benzolrings delokalisiert ist, wird durch den Einfluss elektronenziehender Substituenten an diesen Stellen bestätigt.

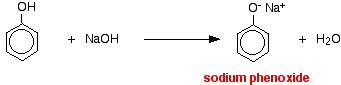
In dieser Reaktion wurde das Wasserstoffion durch das stark basische Hydroxidion in der Natronlauge entfernt.
Säuren reagieren mit den reaktiveren Metallen unter Bildung von Wasserstoffgas. Phenol ist da keine Ausnahme – der einzige Unterschied ist die langsame Reaktion, weil Phenol eine so schwache Säure ist. Phenol wird in einem trockenen Rohr erwärmt, bis es geschmolzen ist, und ein kleines Stück Natrium hinzugefügt. Es zischt etwas, da Wasserstoffgas freigesetzt wird. Das Gemisch, das in der Röhre zurückbleibt, enthält Natriumphenoxid.