L’hydroxychloroquine, vendue sous le nom de marque Plaquenil (Sanofi-Aventis), est un médicament antipaludéen dont l’utilisation s’est généralisée dans le traitement de diverses maladies auto-immunes, notamment le lupus érythémateux systémique et la polyarthrite rhumatoïde1. Selon certaines estimations, plus de 150 000 patients suivent un traitement à long terme avec ce médicament rien qu’en Amérique.2 La toxicité rétinienne associée à l’utilisation de l’HCQ est relativement rare, estimée à 1 % après cinq ans et augmentant avec la poursuite du traitement.3 Cependant, la rétinopathie, décrite comme un œil de bœuf, ne peut être traitée et tend à progresser même après l’arrêt du médicament. C’est pourquoi, ces dernières années, l’accent a été mis sur des mesures de dépistage plus efficaces utilisant des techniques d’imagerie multimodale afin d’obtenir des signes précoces de toxicité avant que les changements avancés caractéristiques ne se manifestent cliniquement. Cette revue résume la présentation clinique de la rétinopathie HCQ, les directives de dépistage actuelles recommandées par l’American Academy of Ophthalmology et la contribution des études d’imagerie auxiliaires pour établir un diagnostic opportun.
Présentation clinique &Examen
Dans les premiers stades de la toxicité de l’HCQ, les patients sont souvent asymptomatiques avec une préservation de l’acuité visuelle. Cependant, les personnes perspicaces peuvent signaler des difficultés de vision nocturne, des éblouissements ou des scotomes paracentraux qui interfèrent avec la lecture.4-6 Le scotome devient généralement apparent pour le patient bien avant que des changements soient observés à l’examen. Bien que la reconnaissance d’une dépigmentation subtile de la fovéa ait été décrite dans certains cas de toxicité précoce, ce n’était qu’après avoir été corroborée par des études d’imagerie auxiliaires.7
D’autre part, la rétinopathie en œil de bœuf visible, caractérisée par un anneau de dégénérescence de l’épithélium pigmentaire rétinien épargnant souvent le centre de la fovéa, est une découverte tardive indiquant une atteinte avancée (voir figure 1). Ainsi, l’ophtalmoscopie seule n’est pas suffisante pour dépister la toxicité de l’HCQ.7,8 Ceci étant dit, un examen détaillé des segments antérieur et postérieur pour évaluer la verticillade cornéenne ainsi qu’une maladie maculaire concomitante (c’est-à-dire une dégénérescence maculaire liée à l’âge), reste important pour le suivi de ces patients à long terme.
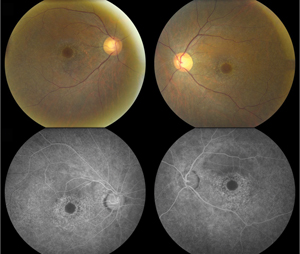
Figure 1. Les photos du fond d’œil (en haut) montrent une dépigmentation paracentrale étendue de l’épithélium pigmentaire rétinien épargnant la fovéa centrale de manière bilatérale, ce qui correspond à une maculopathie de l’œil de bœuf. L’angiographie à la fluorescéine (en bas) montre une hyperfluorescence granulaire parafovéale en corrélation avec une perturbation de l’EPR parcellaire avec un défaut de fenêtre subséquent.
Lignes directrices pour le dépistage
En 2002, l’AAO a publié ses premiers modèles de pratique préférée pour le dépistage de la rétinopathie par HCQ en réponse aux divers régimes préconisés à l’époque.9 Ces recommandations ont été révisées en 2011 pour refléter la sensibilité accrue des nouvelles techniques d’imagerie diagnostique.4
Si un patient était jugé à faible risque de rétinopathie, des examens de suivi étaient recommandés à partir de cinq ans de traitement après la ligne de base initiale. Si un patient présentait un risque élevé, un suivi annuel était recommandé. Le risque élevé était défini comme une personne ayant une durée d’utilisation de l’HCQ supérieure à cinq ans, une consommation cumulée supérieure à 1 000 grammes, une posologie quotidienne supérieure à 6,5 mg/kg/j, un âge élevé (aucun seuil n’a été précisé), une maladie hépatique/rénale concomitante ou une maculopathie préexistante d’une autre étiologie4.
En plus d’un examen ophtalmologique et d’un test automatisé du champ visuel Humphrey à seuil avec un motif blanc 10-2 (qui doit être interprété avec un seuil d’anomalie bas et en répétant le test si des irrégularités sont notées), au moins une des études d’imagerie objectives supplémentaires suivantes est recommandée : 1) tomographie par cohérence optique dans le domaine spectral ; 2) autofluorescence du fond d’œil ; ou 3) électrorétinographie multifocale, au départ et annuellement à chaque visite après cinq ans d’utilisation d’HCQ.4 L’angiographie à la fluorescéine, notablement absente, n’est pas recommandée dans ces directives. Bien que l’angiographie à la fluorescéine puisse révéler le motif en œil de bœuf de l’hyperfluorescence granulaire et puisse être en mesure d’élucider les défauts subtils de l’EPR, il n’a pas été prouvé qu’elle était aussi sensible que les tests susmentionnés et s’accompagne d’une morbidité supplémentaire en raison de son caractère invasif.4
L’OCT à domaine spectral
En générant des images transversales à haute résolution de la rétine in vivo, l’OCT à domaine spectral peut détecter des altérations structurelles significatives avant le développement d’une rétinopathie visible due à l’HCQ. Les résultats de l’OCT précédemment décrits dans la toxicité de l’HCQ comprennent la perte de la membrane limitante externe, la perturbation de la zone ellipsoïde externe, l’amincissement parafovéal de la couche nucléaire externe et les dommages à l’EPR.6,7,10 Malgré ces divers changements, de nombreuses études ont soutenu la notion que la « résistance fovéale » relative est commune dans la toxicité de l’HCQ, comme le démontre la préservation des couches rétiniennes externes sous-fovéales, ce qui explique l’acuité visuelle centrale intacte qui peut être observée même dans des états pathologiques avancés.6 Cette épargne fovéale sert de base au signe de » soucoupe volante » de la rétinopathie HCQ décrit par Eric Chen, MD, et ses collègues, où une apparence ovoïde est créée par les structures rétiniennes externes fovéales centrales intactes contrastant avec la perte périfovéale adjacente de la bande ellipsoïde des photorécepteurs et l’atrophie de l’ONL (voir Figure 2).11
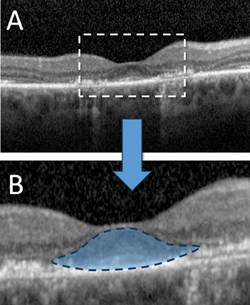
Figure 2. Tomographie par cohérence optique à domaine spectral démontrant une rétinopathie avancée à l’hydroxychloroquine avec perte parafovéale de la membrane limitante externe, perturbation de la zone ellipsoïde externe, amincissement de la couche nucléaire externe et perturbation de la couche épithéliale pigmentaire rétinienne sous-jacente (A). L’épargne relative des structures sous-fovéales donne lieu au signe caractéristique de la « soucoupe volante » d’une toxicité avancée (B).11
Bien qu’une grande partie de la littérature se soit concentrée sur les changements de la rétine externe dans la rétinopathie de HCQ, les premiers résultats de toxicité par SD-OCT peuvent en fait se localiser dans la rétine interne. Sirichai Pasadhika, MD, et ses collègues ont observé un amincissement sélectif de la rétine interne périfovéale sur la SD-OCT, en particulier des couches plexiforme et ganglionnaire internes, chez des patients traités au HCQ à long terme (plus de cinq ans) en l’absence de changements structurels de la rétine externe/RPE ou d’une autre toxicité cliniquement évidente.12 Il est intéressant de noter que l’amincissement de la couche des fibres nerveuses de la rétine n’a pas été trouvé chez ces patients, ce qui, selon les auteurs, ne se produit qu’après une dégénérescence significative des cellules ganglionnaires de la rétine. Dans une étude distincte conçue pour comparer les patients traités de façon chronique avec et sans preuve ophtalmoscopique de toxicité, un amincissement significatif de la rétine interne, externe et de toute l’épaisseur de la rétine a été observé chez les patients présentant une toxicité rétinienne cliniquement apparente, alors que seul un amincissement sélectif de la rétine interne a été détecté dans le groupe sans changement du fond d’œil.13 Une fois encore, l’amincissement de la RNFL était absent chez les patients exposés de façon chronique à l’HCQ et sans changement du fond d’œil ; cependant, le groupe présentant des changements du fond d’œil liés à la toxicité du médicament a montré un amincissement de la RNFL péripapillaire. Récemment, Ulviye Yigit et ses coauteurs ont corroboré ces résultats en mesurant un amincissement significatif de la rétine interne pendant le traitement à l’HCQ, en particulier dans les zones para- et périfovéales, en l’absence de modifications cliniques du fond d’œil.14 Leur étude se distingue par l’inclusion des patients recevant un traitement à l’HCQ depuis moins de cinq ans (durée moyenne : 2,5 ans).
L’imagerie avec FAF peut aider à élucider les altérations toxiques de l’EPR sous-jacent dues à un traitement à long terme par HCQ. Un signal FAF accru indique typiquement une accumulation de lipofuscine, en particulier le fluorophore A2E, au sein de l’EPR, soit à cause d’un métabolisme anormal avec une phagocytose accrue des segments externes des photorécepteurs, soit à cause d’un défaut héréditaire/acquis des processus de phagocytose.15,16 Un signal FAF éteint, en revanche, indique la mort des cellules de l’EPR17.
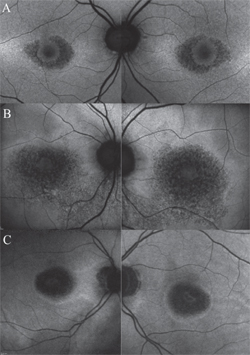
Figure 3. Modèles d’autofluorescence du fond d’œil à différents stades de la rétinopathie à l’hydroxychloroquine. Aspect classique de la maculopathie en œil de bœuf (A). Au fur et à mesure que l’EPR s’atrophie, l’intensité du FAF dans la macula péricentrale change pour prendre un aspect tacheté ou moucheté (B), et finit par se fondre en zones sombres d’absence de signal FAF une fois que les cellules sont mortes (C). Ces régions sombres peuvent être bordées par une bordure d’autofluorescence accrue (A-C), présageant les cellules de l’EPR qui subiront la dégénérescence suivante.
L’électrorétinographie traditionnelle plein champ représente un test de la fonction rétinienne globale en réponse à une stimulation photique. Comme elle n’est pas sensible aux changements fonctionnels localisés à la macula, les cas de toxicité de l’HCQ ne montreraient des anomalies qu’après que des dommages rétiniens diffus se soient déjà produits, ce qui limite son utilité dans les programmes de dépistage.4,9
A l’inverse, l’ERG multifocal, avec sa capacité à enregistrer les défauts rétiniens centraux localisés, a été accepté comme un excellent candidat pour détecter des changements subtils dans les premiers stades de la toxicité.20 Raj Maturi, MD, et ses collègues ont été les premiers à signaler une réduction marquée de l’amplitude du mfERG central 16˚ chez un patient atteint d’une rétinopathie manifeste due à l’HCQ dans le cadre d’un ERG plein champ normal.21 Des résultats similaires ont été obtenus par des études ultérieures caractérisant les utilisateurs d’HCQ. Timothy Y.Y. Lai, MMedSc, MRCS, et ses collègues ont observé un déclin longitudinal de la fonction rétinienne chez des patients recevant de l’HCQ à long terme, et ont proposé que le mfERG en série puisse aider à détecter les changements rétiniens précoces associés à la toxicité22. Dans une étude de suivi, ils ont montré que les réponses du mfERG étaient en corrélation avec les valeurs de déviation moyenne de l’HVF 10-2, et qu’elles pouvaient donc compléter les tests du champ visuel en fournissant une mesure objective de la fonction rétinienne chez les patients utilisant de l’HCQ.23
La forme d’onde la plus spécifique observée chez les patients présentant une toxicité à l’HCQ est la perte d’amplitude paracentrale, indiquant une diminution de la fonction rétinienne dans la périfovéa sensible. Dans une autre étude, le Dr Maturi et ses collègues ont proposé que le temps implicite prolongé, lorsqu’il est observé en conjonction avec la perte d’amplitude paracentrale, puisse être une caractéristique plus spécifique de la toxicité de l’HCQ.24 De plus, ils ont démontré trois configurations supplémentaires, en plus de la perte paracentrale, de changements d’amplitude anormaux du mfERG : 1) perte fovéale centrale ; 2) perte périphérique ; et 3) perte généralisée.24 Leur système de classification des configurations de changements mfERG a depuis été corroboré par d’autres groupes.20,22
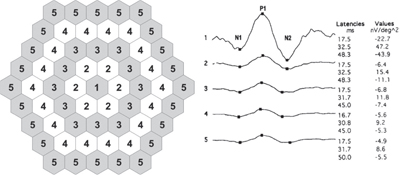
Figure 4. La méthode du rapport des anneaux pour l’interprétation de l’électrorétinogramme multifocal. Le diagramme du système de motif de stimulus à 61 hexagones à gauche montre les hexagones appartenant à chaque anneau. Les formes d’onde moyennes des anneaux d’un patient normal sont à droite. (Voir les notes en fin de texte pour le crédit d’image.)
Les rapports d’anneau du mfERG sont définis comme les rapports de l’amplitude de l’anneau central (R1) à chacune des amplitudes de l’anneau périphérique, ce qui donne cinq mesures pour chaque œil : R1, R1/R2, R1/R3, R1/R4 et R1/R5. Étant donné que R1 a l’amplitude d’anneau la plus élevée dans l’œil normal, les rapports d’anneau normaux sont supérieurs à 1,0 ; cependant, étant donné que les zones de dépression de l’amplitude du mfERG dans la toxicité de l’HCQ sont typiquement en forme d’anneau péricentral, et que la zone maculaire centrale est généralement épargnée jusqu’à un stade avancé du processus de la maladie, ces patients montrent typiquement un rapport d’anneau plus grand que ce à quoi on pourrait s’attendre (au-dessus des limites de 99 pour cent des normales acceptées créées à partir d’un sous-ensemble de sujets sains).20
Bien que le test mfERG se soit révélé très prometteur en tant que mesure objective pour détecter la toxicité précoce de l’HCQ ainsi que pour suivre la progression des changements maculaires dans une maladie connue, il est limité par sa dépendance à la coopération du patient, la formation spécialisée du personnel pour l’administration et l’interprétation, et le coût global. Peut-être plus important encore, il n’est pas aussi facilement disponible ou facile à réaliser de manière fiable que le SD-OCT ou le FAF, ce qui limite son utilisation généralisée à ce jour.
Pas de » meilleur test » unique
Malgré l’intégration accrue de ces systèmes d’imagerie dans les forums de recherche et de pratique clinique, il n’y a toujours pas de consensus sur le test qui est l’étalon-or pour détecter la toxicité précoce de l’HCQ. Cette discorde est évidente dans toute la littérature, car divers partisans ont plaidé en faveur des champs visuels, du FAF, du mfERG ou du SD-OCT comme étant la méthode la plus sensible/spécifique. Dans une récente étude rétrospective, basée sur la pratique privée, portant sur 219 patients, David J. Browning, MD, PhD, a conclu que les directives révisées mettant l’accent sur le FAF, le SD-OCT ou le mfERG auxiliaires, ont en fait augmenté le coût du dépistage sans améliorer la détection des cas de toxicité.27
L’avènement de l’imagerie par optique adaptative a permis la visualisation de la mosaïque des photorécepteurs à cônes in vivo à des résolutions ≤ 2 µm en compensant les aberrations de l’optique oculaire.29-31 Grâce à cette technologie, des anomalies des photorécepteurs ont été découvertes dans diverses maladies rétiniennes qui n’étaient pas autrement discernables avec l’imagerie SD-OCT.32,33
L’utilisation de l’optique adaptative dans la rétinopathie HCQ est relativement nouvelle. Kimberly E. Stepien, MD, et ses collègues ont démontré une perturbation de la mosaïque des photorécepteurs à cônes dans les zones correspondant aux défauts HVF 10-2 et aux anomalies de la zone ellipsoïde SD-OCT chez deux patients sous traitement HCQ à long terme.33 De même, des chercheurs coréens ont observé une perturbation de la mosaïque des cônes avec des cônes individuels de forme et de taille irrégulières chez un patient atteint de maculopathie à œil de bœuf.34 De plus, les densités de cônes mesurées globalement étaient diminuées dans tous les points de test prédéterminés à diverses distances du centre fovéal. Dans l’ensemble, les deux groupes ont proposé que l’OA offre une modalité non invasive, quantitative et à haute résolution pour l’imagerie des patients atteints de rétinopathie HCQ, et peut permettre la détection d’anomalies subcliniques qui précèdent la perte objective du champ visuel. Des études à plus grande échelle sont nécessaires pour valider ces résultats.
Récemment, deux groupes ont décrit l’utilisation de systèmes de microperimétrie pour évaluer la toxicité précoce de l’HCQ.35,36 En testant la périmétrie sous visualisation simultanée du fond d’œil, un corrélat anatomique précis à une aberration fonctionnelle peut être obtenu.35 Lucia Martinez-Costa et ses collègues ont observé des différences significatives dans les mesures de sensibilité rétinienne par microperimétrie entre 209 patients prenant de l’HCQ ou de la chloroquine et 204 sujets témoins.36 Renu Jivrajka, MD, et ses collègues ont détaillé leurs résultats dans une cohorte de 16 patients sous traitement HCQ pendant plus de cinq ans sans aucun signe de toxicité par les tests conventionnels 10-2 HVF, SD-OCT, FAF ou mfERG ; cependant, avec la microperimétrie, ils ont noté une réduction globale significative de la sensibilité rétinienne moyenne entre les patients et les témoins de même âge.35 Un autre avantage du système de micropérimétrie utilisé était sa capacité à obtenir des images SD-OCT simultanées et à superposer les valeurs de sensibilité et d’épaisseur de la rétine, ce qui renforce encore la notion de corrélation entre la réponse fonctionnelle et une structure anatomique. De futures études longitudinales prospectives sont nécessaires, avec des tests de microperimétrie en série, afin de mieux déterminer si les sensibilités rétiniennes réduites représentent réellement une toxicité subclinique précoce de l’HCQ.
L’hydroxychloroquine est un médicament précieux avec un profil d’effets secondaires globalement faible. Bien que les effets toxiques oculaires soient peu fréquents, ils peuvent être associés à une morbidité importante et irréversible pour le patient. La détection précoce de la toxicité à des stades subcliniques et l’arrêt du médicament peuvent contribuer à prévenir une détérioration structurelle et fonctionnelle supplémentaire. Ainsi, les cliniciens doivent maintenir un seuil bas pour suspecter une toxicité de l’HCQ. Les anomalies subtiles détectées à l’aide d’une modalité justifient des tests de suivi supplémentaires pour confirmer ou infirmer ces résultats, avec pour objectif ultime un diagnostic précoce avant une perte visuelle irréversible. REVUE
Figure 4 reproduite avec la permission de : Lyons JS, Severns ML. Détection de la toxicité rétinienne précoce de l’hydroxychloroquine améliorée par l’analyse du ring ratio de l’électrorétinographie multifocale. Am J Ophthalmol 2007. May;143(5):801-809.
Le Dr Rahimy est un boursier de deuxième année au Wills Eye Hospital et un instructeur clinique en ophtalmologie à la Thomas Jefferson University School of Medicine. Le Dr Vander est chirurgien titulaire du service de la rétine au Wills Eye Hospital et professeur d’ophtalmologie à la Thomas Jefferson University School of Medicine. Le Dr Rahimy peut être contacté à l’adresse [email protected]. Le Dr Vander peut être contacté à l’adresse suivante : jvander@midatlantic retina.com.
1. Tehrani R, Ostrowski RA, Hariman R, Jay WM. Toxicité oculaire de l’hydroxychloroquine. Semin Ophthalmol 2008;23(3):201-209.
2. Semmer AE, Lee MS, Harrison AR, Olsen TW. Dépistage de la rétinopathie due à l’hydroxychloroquine. Br J Ophthalmol 2008;92(12) : 1653-1655.
3. Wolfe F, Marmor MF. Taux et prédicteurs de la toxicité rétinienne de l’hydroxychloroquine chez les patients atteints de polyarthrite rhumatoïde et de lupus érythémateux systémique. Arthritis Care Res (Hoboken) 2010;62(6):775-784.
4. Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF. Recommandations révisées sur le dépistage de la rétinopathie due à la chloroquine et à l’hydroxychloroquine. Ophthalmology 2011;118:415-422.
5. Michaelides M, Stover NB, Francis PJ, Weleber RG. Toxicité rétinienne associée à l’hydroxychloroquine et à la chloroquine : Facteurs de risque, dépistage et progression malgré l’arrêt du traitement. Arch Ophthalmol 2011;129:30-39.
6. Mititelu M, Wong BJ, Brenner M, Bryar PJ, Jampol LM, Fawzi AA. Progression des effets toxiques de l’hydroxychloroquine après l’arrêt du traitement médicamenteux : De nouvelles preuves issues de l’imagerie multimodale. JAMA Ophthalmol 2013;131:1187-1197.
7. Marmor MF. Comparaison des procédures de dépistage de la toxicité de l’hydroxychloroquine. Arch Ophthalmol 2012;130:461-469.
8. Elder M, Rahman AM, McLay J. Perte précoce du champ visuel paracentral chez les patients prenant de l’hydroxychloroquine. Arch Ophthalmol 2006;124:1729-1733.
9. Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF. Recommandations sur le dépistage de la rétinopathie due à la chloroquine et à l’hydroxychloroquine : A report by the American Academy of Ophthalmology. Ophthalmology 2002;109:1377-1382.
10. Kellner S, Weinitz S, Kellner U. La tomographie par cohérence optique dans le domaine spectral détecte les premiers stades de la rétinopathie due à la chloroquine de manière similaire à l’électrorétinographie multifocale, à l’autofluorescence du fond d’œil et à l’autofluorescence dans le proche infrarouge. Br J Ophthalmol 2009;93(11):1444-1447.
11. Chen E, Brown DM, Benz MS, et al. La tomographie par cohérence optique dans le domaine spectral comme test de dépistage efficace de la rétinopathie due à l’hydroxychloroquine (le signe de la « soucoupe volante »). Clin Ophthalmol 2010;4:1151-1158.
12. Pasadhika S, Fishman GA, Choi D, Shahidi M. Amincissement sélectif de la rétine interne périfovéale comme signe précoce de la toxicité rétinienne de l’hydroxychloroquine. Eye (Lond) 2010;24(5):756-762 ; quiz 763.
13. Pasadhika S, Fishman GA. Effets de l’exposition chronique à l’hydroxychloroquine ou à la chloroquine sur les structures de la rétine interne. Eye (Lond) 2010;24(2):340-346.
14. Ulviye Y, Betul T, Nur TH, Selda C. Tomographie par cohérence optique dans le domaine spectral pour la détection précoce des altérations rétiniennes chez les patients utilisant l’hydroxychloroquine. Indian J Ophthalmol 2013;61(4):168-171.
15. Kennedy CJ, Rakoczy PE, Constable IJ. Lipofuscine de l’épithélium pigmentaire rétinien : A review. Eye (Lond) 1995;9 ( Pt 6)):763-771.
16. Okubo A, Rosa RH, Jr, Bunce CV, et al. Les relations des changements d’âge dans l’épithélium pigmentaire rétinien et la membrane de Bruch. Invest Ophthalmol Vis Sci 1999;40(2):443-449.
17. Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Autofluorescence du fond d’œil et développement de l’atrophie géographique dans la dégénérescence maculaire liée à l’âge. Invest Ophthalmol Vis Sci 2001;42(5):1051-1056.
18. Kellner U, Renner AB, Tillack H. Fundus autofluorescence and mfERG for early detection of retinal alterations in patients using chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci 2006;47(8):3531-3538.
19. Marmor MF. L’autofluorescence du fond d’œil n’est pas le meilleur dépistage précoce de la toxicité de l’hydroxychloroquine. JAMA Ophthalmol 2013;131:1487-1488.
20. Lyons JS, Severns ML. Détection de la toxicité rétinienne précoce de l’hydroxychloroquine améliorée par l’analyse du ring ratio de l’électrorétinographie multifocale. Am J Ophthalmol 2007;143:801-809.
21. Maturi RK, Folk JC, Nichols B, Oetting TT, Kardon RH. Hydroxychloroquine retinopathy. Arch Ophthalmol 1999;117:1262-1263.
22. Lai TY, Chan WM, Li H, Lai RY, Lam DS. Multifocal electroretinographic changes in patients receiving hydroxychloroquine therapy. Am J Ophthalmol 2005;140:794-807.
23. Lai TY, Ngai JW, Chan WM, Lam DS. Champ visuel et électrorétinographie multifocale et leurs corrélations chez les patients sous traitement à l’hydroxychloroquine. Doc Ophthalmol 2006;112(3):177-187.
24. Maturi RK, Yu M, Weleber RG. Évaluation électrorétinographique multifocale des utilisateurs d’hydroxychloroquine à long terme. Arch Ophthalmol 2004;122:973-981.
25. Lyons JS, Severns ML. Using multifocal ERG ring ratios to detect and follow Plaquenil retinal toxicity : a review : Examen des rapports d’anneaux mfERG dans la toxicité de Plaquenil. Doc Ophthalmol 2009;118(1):29-36.
26. Tzekov RT, Gerth C, Werner JS. Senescence des composants de l’électrorétinogramme multifocal humain : A localized approach. Graefes Arch Clin Exp Ophthalmol 2004;242(7):549-560.
27. Browning DJ. Impact des directives révisées de l’american academy of ophthalmology concernant le dépistage de l’hydroxychloroquine sur la pratique réelle. Am J Ophthalmol 2013;155:418-428.e411.
28. Marmor MF, Melles RB. Disparité entre les champs visuels et la tomographie par cohérence optique dans la rétinopathie à l’hydroxychloroquine. Ophthalmology 2014;121:1257-62.
29. Roorda A, Romero-Borja F, Donnelly Iii W, Queener H, Hebert T, Campbell M. Ophtalmoscopie laser à balayage à optique adaptative. Opt Express 2002;10(9):405-412.
30. Park SP, Chung JK, Greenstein V, Tsang SH, Chang S. A study of factors affecting the human cone photoreceptor density measured by adaptive optics scanning laser ophthalmoscope. Exp Eye Res 2013;108:1-9.
31. Kim JE, Chung M. L’optique adaptative pour l’imagerie rétinienne : Current status. Retina 2013;33:1483-1486.
32. Carroll J, Neitz M, Hofer H, Neitz J, Williams DR. Perte fonctionnelle de photorécepteurs révélée par l’optique adaptative : An alternate cause of color blindness. Proc Natl Acad Sci U S A 2004;101(22):8461-8466.
33. Stepien KE, Martinez WM, Dubis AM, Cooper RF, Dubra A, Carroll J. Perturbation subclinique des photorécepteurs en réponse à un traumatisme crânien grave. Arch Ophthalmol 2012;130:400-402.
34. Bae EJ, Kim KR, Tsang SH, Park SP, Chang S. Dommages rétiniens dans la maculopathie de la chloroquine, révélés par l’imagerie à haute résolution : Un rapport de cas utilisant l’ophtalmoscopie laser à balayage à optique adaptative. Korean J Ophthalmol 2014;28(1):100-107.
35. Jivrajka RV, Genead MA, McAnany JJ, Chow CC, Mieler WF. Sensibilité microperimétrique chez les patients sous traitement à l’hydroxychloroquine (Plaquenil). Eye (Lond) 2013;27(9):1044-1052.
36. Martinez-Costa L, Victoria Ibanez M, Murcia-Bello C, et al. Utilisation de la microperimétrie pour évaluer la toxicité rétinienne de l’hydroxychloroquine et de la chloroquine. Can J Ophthalmol 2013;48(5):400-405.