Les six réactions clés de substitution aromatique électrophile
Une réaction clé des composés aromatiques est la substitution aromatique électrophile, où une liaison C-H est rompue et une nouvelle liaison C-E (E étant un atome électrophile tel que Cl, Br, N…) est formée.
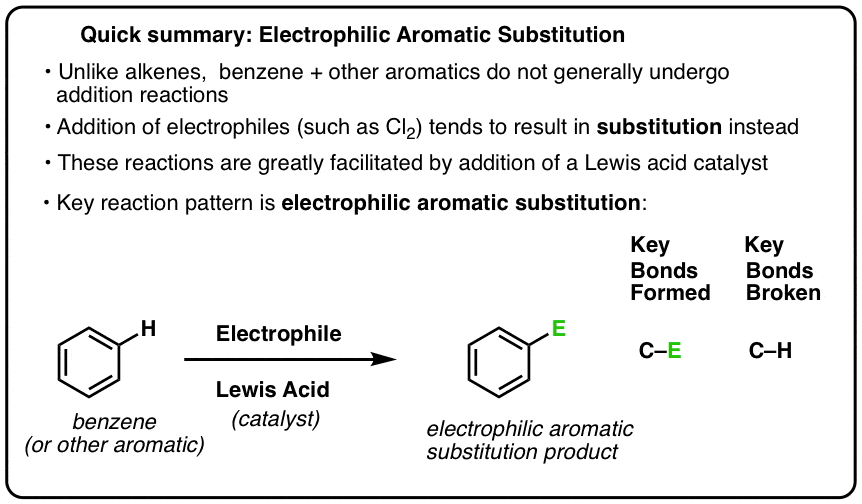
Table des matières
- Les alcènes donnent des produits « d’addition » lors de la réaction avec les électrophiles. Alors, comment le benzène se compare-t-il ?
- Substitution aromatique électrophile
- Les acides de Lewis accélèrent la vitesse des réactions de substitution aromatique électrophile
- Le motif clé pour six importantes réactions de substitution aromatique électrophile
- Chloration et bromation aromatiques
- Nitration et sulfonation aromatiques
- Friedel-…Crafts Alkylation et Acylation
- Résumé : Les six réactions clés de substitution aromatique électrophile
- Quêtez-vous !
- Les alcènes donnent des produits « d’addition » lors de la réaction avec les électrophiles. Alors comment le benzène se compare-t-il ?
- Substitution aromatique électrophile
- Les acides de Lewis accélèrent la vitesse des réactions de substitution aromatique électrophile
- Le schéma clé pour six importantes réactions de substitution aromatique électrophile
- Chlorination et bromination des molécules aromatiques
- Nitration et sulfonation des molécules aromatiques
- Alkylation et acylation de Friedel-Crafts
- Résumé : Les six réactions clés de substitution aromatique électrophile
- Questionnez vous !
Les alcènes donnent des produits « d’addition » lors de la réaction avec les électrophiles. Alors comment le benzène se compare-t-il ?
Lorsque nous avons couvert les réactions des alcènes il y a quelque temps – beaucoup de réactions ! – nous avons vu que la grande majorité tombait dans la classe de réactions que nous appelons réactions d’addition. C’est là que nous brisons une liaison (relativement faible) C-C (pi) et formons deux nouvelles liaisons simples avec le carbone. La chloration des alcènes avec Cl2 est un exemple classique :
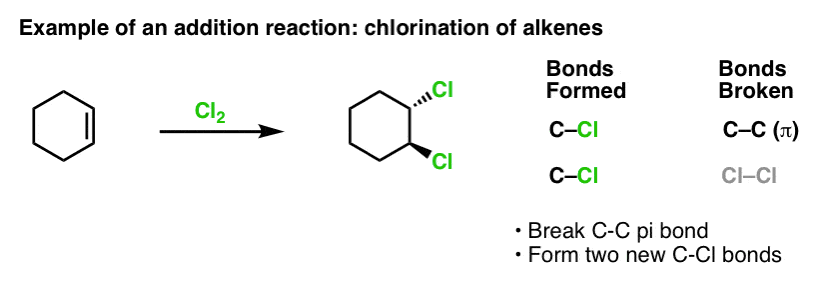
Puisque nous sommes sur le sujet du benzène, il est naturel de se demander dans quelle mesure les liaisons pi des systèmes aromatiques (comme le benzène) se comparent en réactivité aux liaisons pi des alcènes, et par extension, comment les réactions des composés aromatiques se comparent aux réactions des alcènes.
Nous avons vu que le benzène a une stabilité inhabituelle (36 kcal/mol d’énergie de résonance) par rapport à ce que nous attendrions pour le « cyclohexatriène » théorique, ce qui nous amènerait certainement à prédire que les liaisons pi dans les molécules aromatiques seront moins réactives, par rapport aux alcènes.
Vous pourriez également vous rappeler que le benzène lui-même est exceptionnellement difficile à hydrogéner. On peut faire en sorte que l’hydrogène (H2) s’ajoute à travers la plupart des alcènes en présence d’une quantité catalytique de palladium sur carbone (Pd/C) finement divisé, mais il faut vraiment sortir la boîte de Whup-Ass® de marque Aldrich (c’est-à-dire. des températures élevées, des pressions élevées de H2, des temps de réaction prolongés ) afin de réussir à ajouter H2 au benzène, par rapport aux alcènes « typiques ».
Sachant cela, comment pouvons-nous nous attendre à ce que des électrophiles comme Cl2 ou Br2 réagissent avec des composés aromatiques comme le benzène ?
Substitution aromatique électrophile
Notre première supposition pourrait être que le benzène réagit avec Cl2 pour donner un produit « d’addition » comme celui présenté ci-dessous (bien que plus lentement qu’avec un alcène « normal ») :
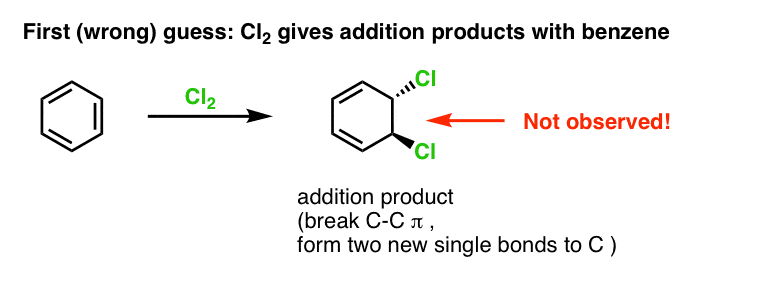
Ce n’est en fait pas le produit que nous observons !
Au contraire, si vous traitez le benzène avec Cl2, vous finirez par obtenir (et très lentement) le produit suivant : le chlorobenzène.
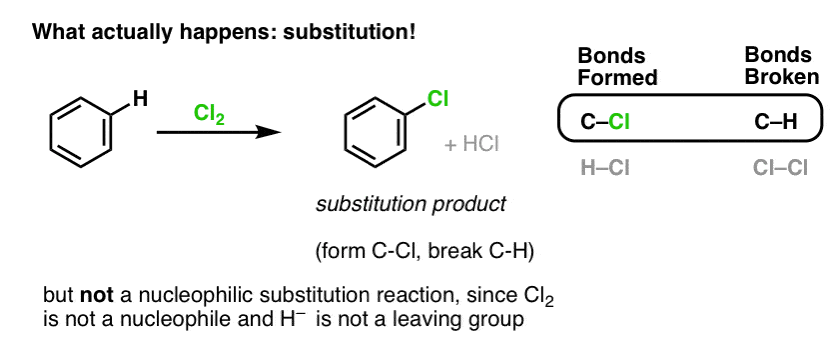
Quelles sont les liaisons formées et les liaisons rompues dans cette réaction ?
Nous avons formé C-Cl et rompu C-H . Comme les liaisons pi sont toutes intactes, il ne s’agit pas d’une réaction d’addition. Au lieu de cela, il s’agit donc d’un type de réaction de substitution, où nous formons et rompons une liaison sur un seul carbone.
Nous avons déjà vu un exemple de réactions de substitution, mais il s’agissait de substitutions nucléophiles, où un nucléophile (par ex. RS- ) est ajouté à un électrophile halogénure d’alkyle (par exemple R-Br), déplaçant un groupe partant (Br- ici) formant une liaison C-Nuc (C-S dans ce cas) et brisant une liaison C-LG (C-Br ici).
Alors, la réaction de Cl2 avec le benzène est-elle également une réaction de substitution nucléophile ? Non !
Cl2 est un nucléophile extrêmement pauvre, réagissant comme donneur d’électrons uniquement avec des acides de Lewis forts (par exemple AlCl3, ci-dessous). Lorsqu’il est associé à un nucléophile même relativement doux, comme la liaison pi d’un alcène, il se comporte comme un électrophile (accepteur d’électrons), comme nous l’avons vu dans sa réaction avec les alcènes.
La réaction de Cl2 avec le benzène est donc appelée substitution aromatique électrophile (SAE pour faire court) :
- électrophile, car on ajoute une espèce pauvre en électrons (électrophile),
- à un composé aromatique (le benzène);
- substitution, car on casse le C-H et on forme le C-E, où E est notre électrophile (Cl dans ce cas).
Les acides de Lewis accélèrent la vitesse des réactions de substitution aromatique électrophile
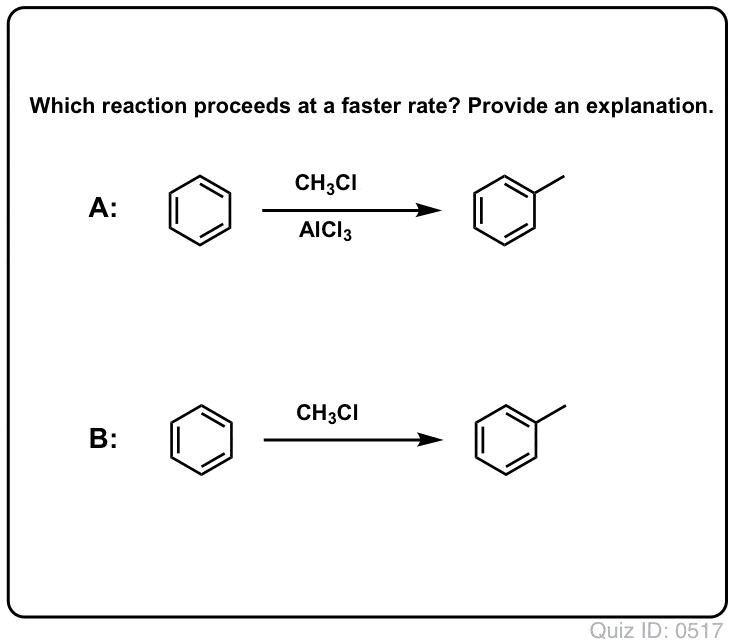
La réaction de Cl2 avec le benzène est plus rapide que la croissance des ongles d’orteil, mais pas de beaucoup. (Elle est, cependant, beaucoup plus rapide avec des aromatiques plus riches en électrons comme le toluène et le phénol). Donc, au lieu de rester assis dans le laboratoire pendant des semaines à attendre qu’une réaction se termine, nous pouvons ajouter un réactif qui « soude » la réactivité de Cl2 pour le transformer en un électrophile encore meilleur : un catalyseur, en d’autres termes.
L’ajout d’un bon acide de Lewis comme AlCl3 ou FeCl3 fait l’affaire. . mise à jour : voir post sur le mécanisme
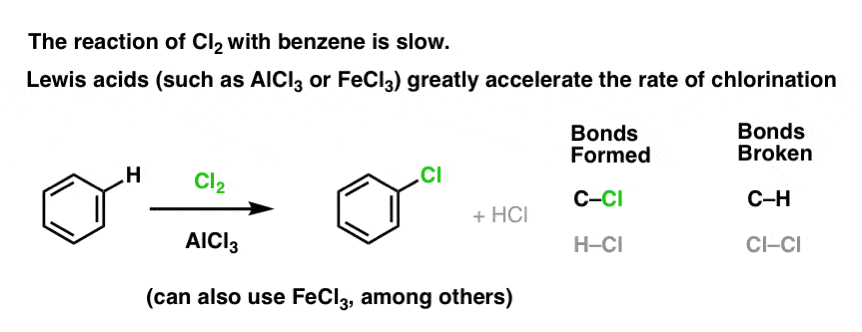
Comment cela fonctionne-t-il ?
Dans notre série sur les alcools, vous vous souvenez peut-être que les alcools (R-OH) peuvent être amenés à participer à des réactions de substitution et d’élimination si un acide fort est ajouté ( formant R-OH2+ ). C’est parce que l’acide conjugué est toujours un meilleur groupe partant ; H2O est une base plus faible, et donc un bien meilleur groupe partant, que HO- . L’éthanol lui-même ne réagira jamais avec NaCl pour donner du chlorure d’éthyle, car le groupe partant HO- est une base trop forte par rapport à Cl- pour que la réaction puisse avoir lieu. Mais si nous convertissons l’alcool en son acide conjugué R-OH2 + avec un acide fort tel que HCl, la réaction peut alors se produire, puisque Cl- déplace la base beaucoup plus faible H2O.
Il peut être utile de penser que H+ affaiblit la liaison C-O, et rend ainsi le carbone qui y est attaché un meilleur électrophile.
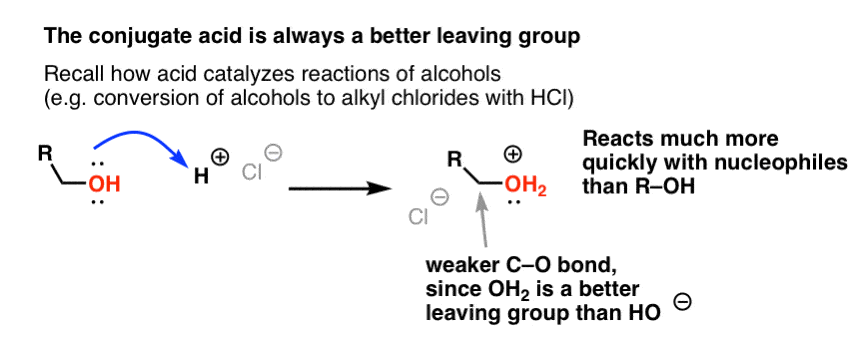
De même que l’acide « amorce » le carbone attaché au groupe OH pour une réaction ultérieure en convertissant le groupe hydroxyle en son acide conjugué, les acides de Lewis opèrent de la même façon la même magie sur Cl2 (et d’ailleurs, toutes les réactions de substitution aromatique électrophile que nous couvrirons impliqueront une sorte de catalyse acide).
Dans le cas de la chloration, l’acide de Lewis (AlCl3, ci-dessous) accepte une paire d’électrons de Cl2. Cela affaiblit la liaison Cl-Cl, ce qui en fait un nucléophile encore meilleur. L’attaque par un nucléophile au niveau du Cl distal libérera non pas Cl- , mais la base encore plus faible (et donc, un meilleur groupe partant) AlCl4(-).
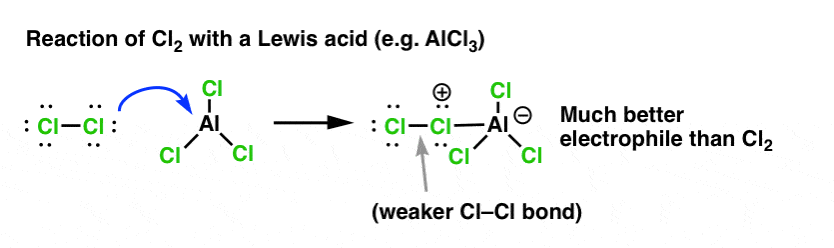
L’ajout d’un acide de Lewis (qui, rappelons-le, inclut les acides de Brønsted comme H2SO4 ) est un fil conducteur dans les six substitutions aromatiques électrophiles clés qui sont généralement couvertes dans l’introduction à la chimie organique.
Le schéma clé pour six importantes réactions de substitution aromatique électrophile
Dans cette section, nous allons présenter ces six réactions clés de substitution aromatique électrophile, qui se regroupent joliment en trois paires :
- chloration et bromation
- nitration et sulfonylation
- alkylation de Friedel-Crafts et acylation de Friedel-Crafts
Nous n’allons pas encore entrer dans les mécanismes. Il s’agit simplement de suivre quelles liaisons se forment et se brisent, afin de voir le schéma clé.
Le voici :
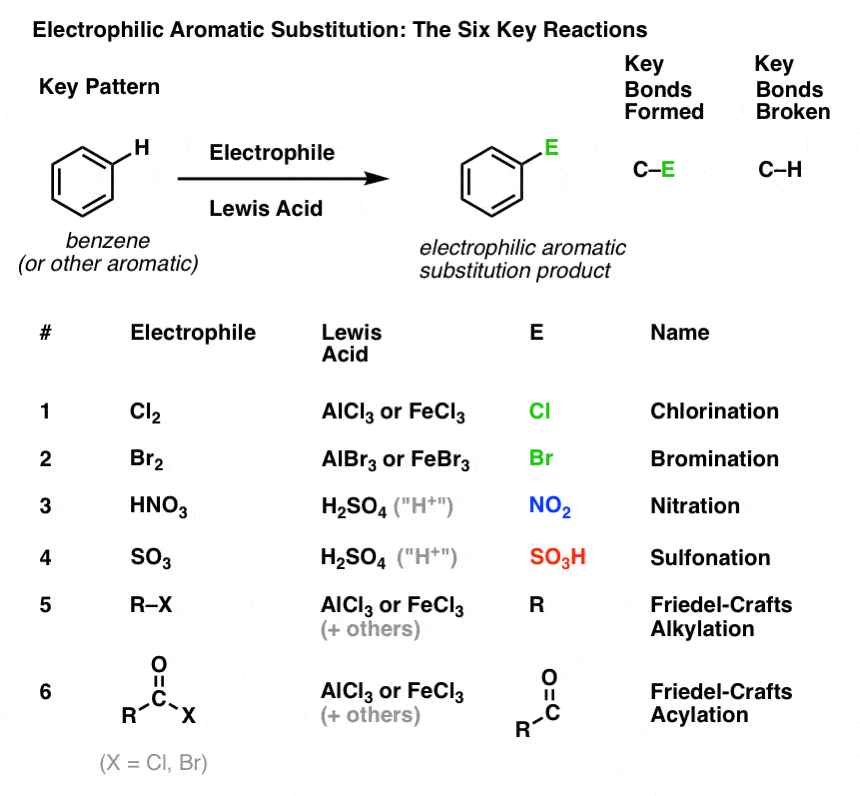
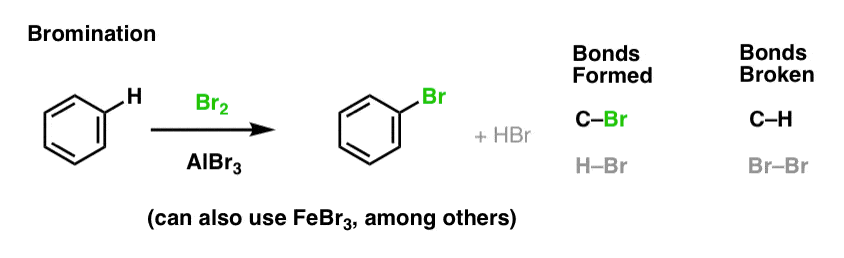
Chlorination et bromination des molécules aromatiques
Nous avons vu la chloration (ci-dessus) ; la bromination est très similaire. Comme Br2 par lui-même n’est pas un électrophile assez fort pour réagir avec le benzène à une vitesse raisonnable, nous utilisons un acide de Lewis comme AlBr3 ou FeBr3 pour accélérer la réaction. .
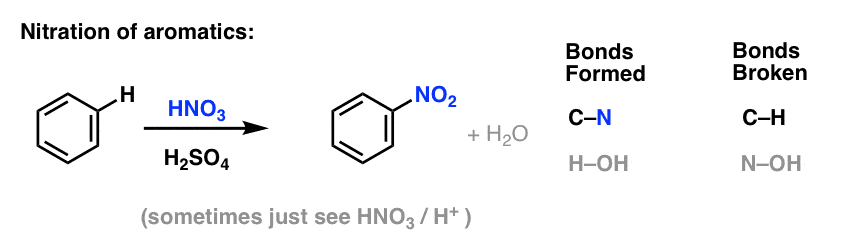
Nitration et sulfonation des molécules aromatiques
La nitration (remplacement de H par un groupe NO2) n’est pas une réaction que nous avons vue dans notre section sur les alcènes, mais c’est une réaction populaire avec les molécules aromatiques comme le benzène. C’est la réaction par laquelle le méthylbenzène (toluène) est converti en 2,4,6-trinitrotoluène. Cette molécule vous est probablement plus familière sous la forme de l’explosif TNT.
La nitration est la substitution de H par NO2, en utilisant l’acide nitrique (HNO3) comme source de NO2 et l’acide sulfurique (H2SO4) comme acide de Lewis:
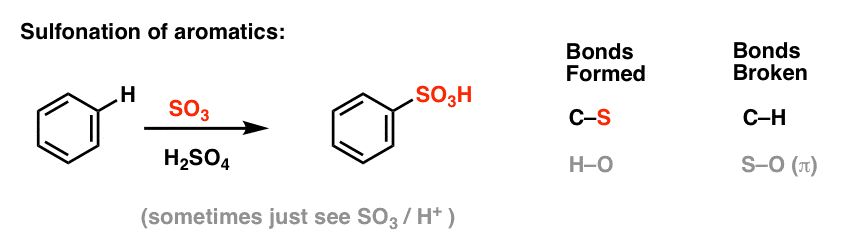
La sulfonation (remplacement de H par un groupe SO3H) s’avère également être une réaction utile. Elle peut être réalisée en ajoutant du trioxyde de soufre (SO3) en présence d’acide sulfurique (H2SO4) comme acide de Lewis :
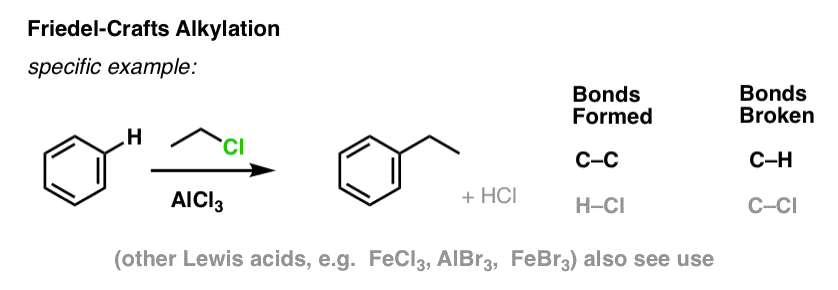
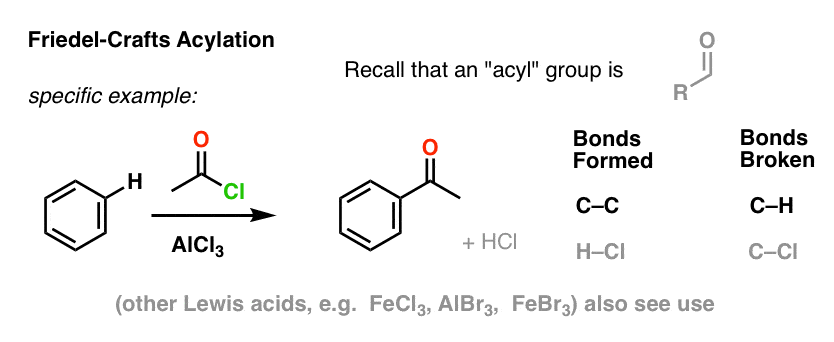
Alkylation et acylation de Friedel-Crafts
Dans les quatre réactions ci-dessus, nous avons observé la formation de C-Cl, C-Br, C-N et C-S.
Il est également possible de former des liaisons carbone-carbone sur des molécules aromatiques en ajoutant des halogénures d’alkyle ou d’acyle en présence d’acides de Lewis. Ces réactions sont connues sous le nom de réactions de Friedel-Crafts, du nom de leurs inventeurs (la réaction remonte à 1877).
Dans l’alkylation de Friedel-Crafts, on commence par un halogénure d’alkyle « R-X » tel que CH3CH2Cl, puis on ajoute un acide de Lewis tel que AlCl3 ou FeCl3 . Comme avec Cl2, l’acide de Lewis accélère la réaction en se coordonnant à l’halogène, en affaiblissant la liaison C-Cl et en en faisant un meilleur groupe partant, permettant ainsi au carbone attaché d’être plus facilement attaqué par les nucléophiles. Aucune réaction ne se produit sans l’acide de Lewis.
Notez qu’ici nous formons du C-C et brisons du C-H.
L’acylation de Friedel-Crafts est similaire, mais nous commençons avec un halogénure d’acyle. L’addition de notre acide de Lewis entraîne la formation de C-C et la rupture de C-H.
Résumé : Les six réactions clés de substitution aromatique électrophile
Nous avons montré six réactions clés de substitution aromatique électrophile (la chloration, la bromation, la nitration, la sulfonylation, et l’alkylation et l’acylation de Friedel-Crafts) et qu’elles impliquent toutes la rupture de C-H et la formation de C-E (où » E » est l’électrophile en question).
Mais connaître les liaisons qui se forment et se brisent n’est qu’un début.
Voici quelques questions auxquelles nous aimerions connaître la réponse :
- Comment les substituants du benzène affectent-ils cette réaction ? Par exemple, comment ces réactions pourraient-elles être affectées si nous les réalisions sur du méthylbenzène ? ou du phénol ? ou du chlorobenzène ?
- Comment les substituants donneurs ou receveurs d’électrons affectent-ils la vitesse de la réaction ?
- Avec le benzène, un seul produit mono-substitué peut éventuellement être formé. Mais que se passe-t-il si on part d’un produit mono-substitué et qu’on lui fait une substitution aromatique électrophile ? Où se retrouvent les substituants ?
- Comment fonctionne la réaction ? Comment expliquer la formation de C-E et la rupture de C-H ?
- Qu’en est-il des autres groupes aromatiques (au-delà du benzène). Comment se comparent les réactions de substitution aromatique électrophile sur le pyrrole, la pyridine, le naphtalène ou d’autres groupes ?
Dans le prochain post, nous aborderons la première question : l’effet des substituants donneurs et receveurs d’électrons. Nous parlerons des groupes activateurs et désactivateurs.
Postage suivant : Groupes activateurs et désactivateurs
Merci de nous avoir lu !
Merci à Matthew Knowe pour son aide dans la rédaction de ce billet.
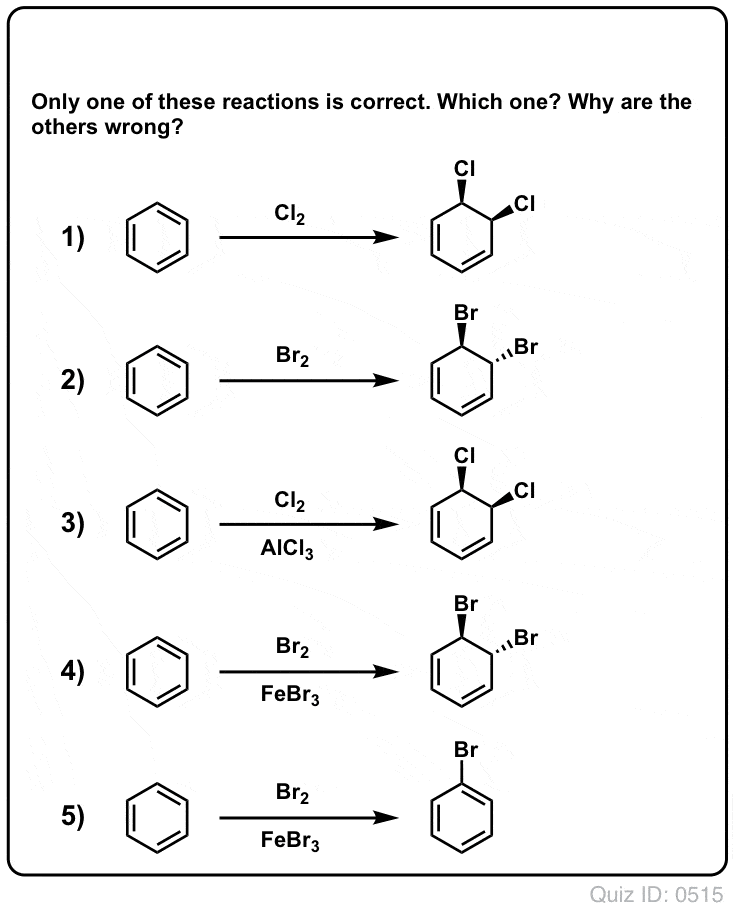
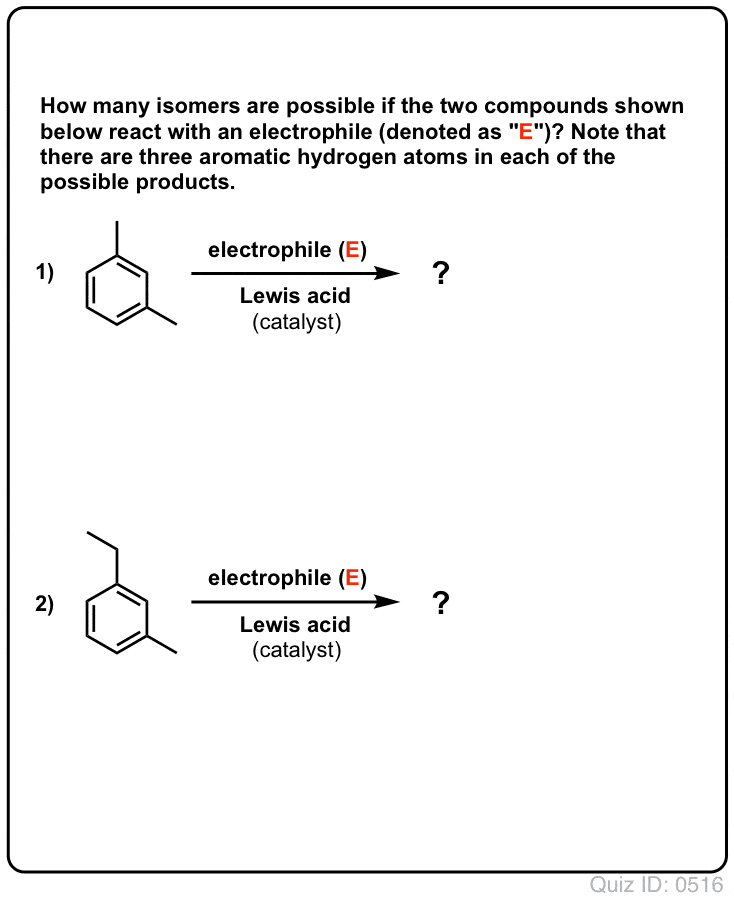
Questionnez vous !
 Cliquez pour retourner
Cliquez pour retourner 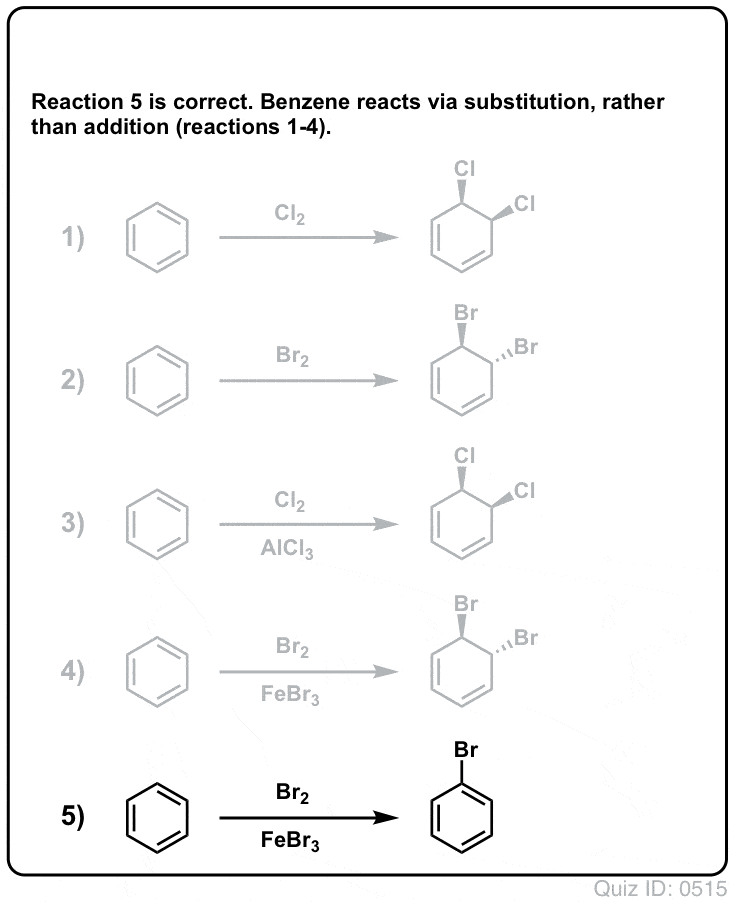 .
.  Cliquez pour retourner
Cliquez pour retourner 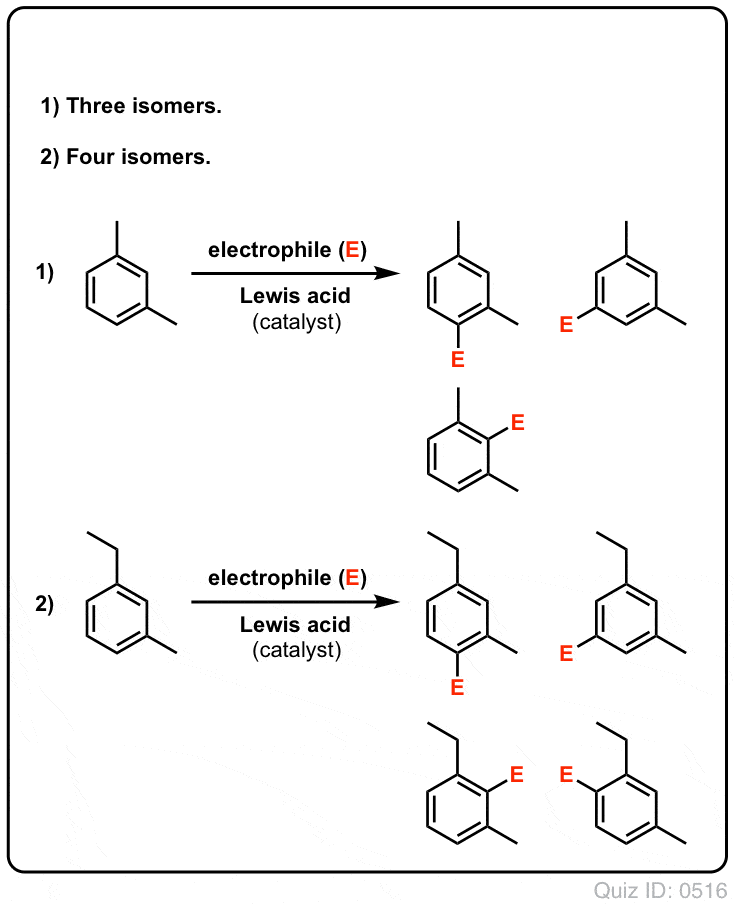
 Cliquez pour retourner
Cliquez pour retourner 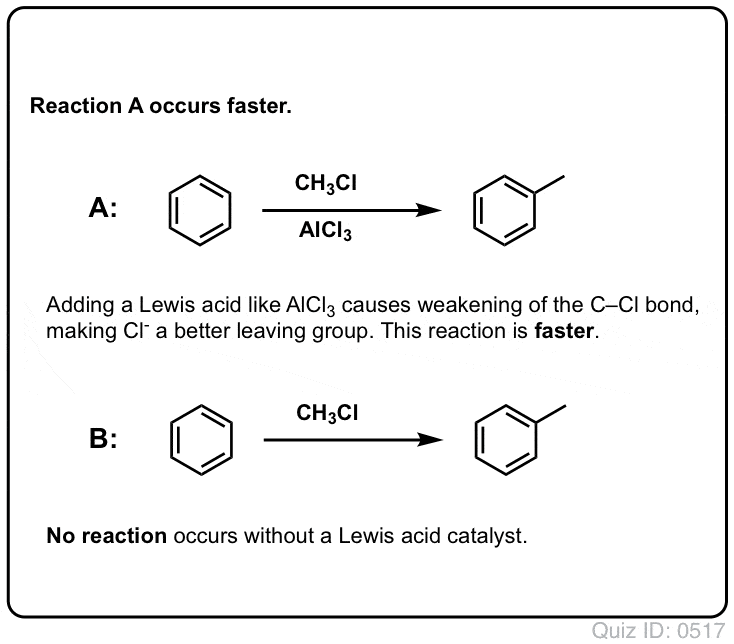
.