L’idrossiclorochina, venduta con il marchio Plaquenil (Sanofi-Aventis), è un farmaco antimalarico che si è diffuso nel trattamento di varie malattie autoimmuni, compreso il lupus eritematoso sistemico e l’artrite reumatoide.1 Secondo alcune stime, più di 150.000 pazienti sono in terapia a lungo termine con questo farmaco solo in America.2 La tossicità retinica associata all’uso di HCQ è relativamente rara, stimata all’1% dopo cinque anni e in aumento con la terapia continuata.3 Tuttavia, la retinopatia, descritta come un occhio di bue, non è curabile e tende a progredire anche dopo la cessazione del farmaco. Di conseguenza, negli ultimi anni c’è stata una maggiore enfasi su misure di screening più efficaci che utilizzano tecniche di imaging multimodale per ottenere segni precoci di tossicità prima che i caratteristici cambiamenti avanzati si manifestino clinicamente. Questa rassegna riassume la presentazione clinica della retinopatia da HCQ, le attuali linee guida di screening raccomandate dall’American Academy of Ophthalmology e il contributo degli studi di imaging ausiliari nello stabilire una diagnosi tempestiva.
Presentazione clinica &Esame
Nelle prime fasi della tossicità da HCQ, i pazienti sono spesso asintomatici con conservazione dell’acuità visiva. Tuttavia, i soggetti percettivi possono riferire difficoltà con la visione notturna, abbagliamento o scotomi paracentrali che interferiscono con la lettura.4-6 Lo scotoma diventa tipicamente evidente al paziente ben prima che i cambiamenti siano visti all’esame. Mentre il riconoscimento di una sottile depigmentazione foveale è stato descritto in alcuni casi di tossicità precoce, questo è avvenuto solo dopo la conferma con studi di imaging ausiliari.7
D’altra parte, la visibile retinopatia a occhio di bue, caratterizzata da un anello di degenerazione dell’epitelio pigmentato retinico che spesso risparmia il centro foveale, è un risultato tardivo indicativo di un danno avanzato (vedi Figura 1). Pertanto, l’oftalmoscopia da sola non è sufficiente per lo screening della tossicità dell’HCQ.7,8 Detto questo, un esame dettagliato del segmento anteriore e posteriore per valutare la verticillata corneale e la malattia maculare concomitante (cioè la degenerazione maculare legata all’età), rimane importante nel monitoraggio a lungo termine di questi pazienti.
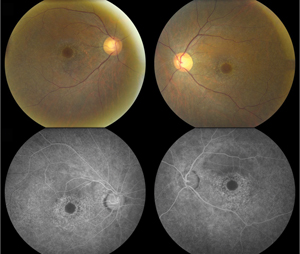
Figura 1. Le foto del fundus (in alto) dimostrano un’estesa depigmentazione paracentrale dell’epitelio pigmentato retinico che risparmia la fovea centrale bilateralmente, coerente con la maculopatia dell’occhio di bue. L’angiografia con fluoresceina (in basso) mostra un’iperfluorescenza granulare parafoveale che si correla ad una rottura a chiazze dell’RPE con conseguente difetto della finestra.
Linee guida per lo screening
Nel 2002, l’AAO ha pubblicato i suoi iniziali Preferred Practice Patterns per lo screening della retinopatia da HCQ in risposta ai diversi regimi sostenuti all’epoca.9 Queste raccomandazioni sono state riviste nel 2011 per riflettere la maggiore sensibilità delle nuove tecniche di imaging diagnostico.4
Se un paziente era considerato a basso rischio di retinopatia, gli esami di follow-up erano raccomandati a partire da cinque anni di terapia dopo la linea base iniziale. Se un paziente era ad alto rischio, si raccomandava un follow-up annuale. Il rischio elevato è stato definito come qualcuno con una durata d’uso dell’HCQ superiore a cinque anni, più di 1.000 grammi di consumo cumulativo, più di 6,5 mg/kg/d di dosaggio giornaliero, età aumentata (nessun cut-point specificato), malattia epatica/renale concomitante o maculopatia preesistente di altra eziologia.4
Oltre all’esame oftalmologico e al test del campo visivo Humphrey a soglia automatica con schema bianco 10-2 (che deve essere interpretato con una bassa soglia di anormalità e con ripetizione del test se si notano irregolarità), si raccomanda almeno uno dei seguenti studi di imaging oggettivi supplementari 1) tomografia a coerenza ottica nel dominio spettrale; 2) autofluorescenza del fundus; o 3) elettroretinografia multifocale, al basale e annualmente ad ogni visita dopo cinque anni di uso di HCQ.4 Notevolmente assente, l’angiografia con fluoresceina non è stata raccomandata in queste linee guida. Mentre la FA può rivelare il modello “occhio di bue” dell’iperfluorescenza granulare e può essere in grado di chiarire sottili difetti del RPE, non è stato dimostrato che sia così sensibile come i test sopra menzionati e comporta una maggiore morbilità a causa della sua invasività.4
Spectral-Domain OCT
Generando immagini trasversali ad alta risoluzione della retina in vivo, la SD-OCT può rilevare alterazioni strutturali significative prima dello sviluppo di retinopatia visibile da HCQ. I risultati OCT precedentemente descritti nella tossicità da HCQ includono la perdita della membrana limitante esterna, la distruzione della zona ellissoide esterna, l’assottigliamento parafoveale dello strato nucleare esterno e il danno del RPE.6,7,10 Nonostante questi vari cambiamenti, numerosi studi hanno sostenuto l’idea che una relativa “resistenza foveale” è comune nella tossicità da HCQ, come dimostrato dalla conservazione degli strati retinici esterni subfoveali, che spiega l’acuità visiva centrale intatta che può essere vista anche in stati avanzati della malattia.6 Questo risparmio foveale serve come base per il segno del “disco volante” della retinopatia da HCQ descritto da Eric Chen, MD, e colleghi, dove un aspetto ovoidale è creato dalle strutture retiniche esterne foveali intatte che contrastano con l’adiacente perdita perifoveale della banda ellissoidale dei fotorecettori e l’atrofia ONL (vedi Figura 2).11
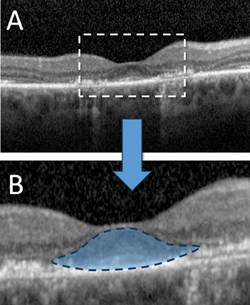
Figura 2. Tomografia a coerenza ottica a dominio spettrale che dimostra una retinopatia avanzata da idrossiclorochina con perdita parafoveale della membrana limitante esterna, distruzione della zona ellissoide esterna, assottigliamento dello strato nucleare esterno e distruzione dello strato epiteliale del pigmento retinico sottostante (A). Il relativo risparmio delle strutture subfoveali si traduce nel caratteristico segno del “disco volante” della tossicità avanzata (B).11
Mentre gran parte della letteratura si è concentrata sui cambiamenti della retina esterna nella retinopatia da HCQ, i primi risultati SD-OCT della tossicità possono effettivamente localizzarsi nella retina interna. Sirichai Pasadhika, MD, e colleghi hanno osservato un assottigliamento selettivo della retina interna perifoveale su SD-OCT, in particolare gli strati interni plessiformi e delle cellule gangliari, in pazienti trattati con HCQ a lungo termine (più di cinque anni) in assenza di cambiamenti strutturali della retina esterna/RPE o di altra tossicità clinicamente evidente.12 È interessante notare che l’assottigliamento dello strato di fibre nervose retiniche non è stato trovato in questi pazienti, cosa che gli autori hanno proposto avvenga solo quando si è verificata una significativa degenerazione delle cellule gangliari della retina. In uno studio separato progettato per confrontare i pazienti trattati cronicamente con e senza evidenza oftalmoscopica di tossicità, è stato osservato un significativo assottigliamento della retina interna, esterna e a tutto spessore nei pazienti con tossicità retinica clinicamente evidente, mentre solo un assottigliamento selettivo della retina interna è stato rilevato nel gruppo senza cambiamenti del fundus.13 Ancora una volta, l’assottigliamento dell’RNFL era assente nei pazienti con esposizione cronica all’HCQ e senza cambiamenti del fundus; tuttavia, il gruppo con cambiamenti del fundus legati alla tossicità del farmaco ha dimostrato un assottigliamento dell’RNFL peripapillare. Recentemente, Ulviye Yigit e coautori hanno confermato questi risultati misurando un assottigliamento significativo della retina interna durante la terapia con HCQ, soprattutto nelle aree para e perifoveali, in assenza di cambiamenti clinici del fondo.14 L’unicità del loro studio è stata l’inclusione dei pazienti in trattamento con HCQ da meno di cinque anni (durata media: 2,5 anni).
Per determinare meglio quali indici basati sulla SD-OCT possano essere valutati in modo affidabile nella tossicità precoce dell’HCQ, è necessario eseguire ulteriori indagini che coinvolgano un numero maggiore di pazienti. Tuttavia, dato il suo rapido tempo di acquisizione dell’immagine, la natura non invasiva e l’ampia disponibilità in molte cliniche, la maggior parte dei medici continua a favorire la SD-OCT come complemento primario al test del campo visivo nello screening dell’HCQ.
Fundus Autofluorescence
L’imaging con FAF può aiutare a chiarire le alterazioni tossiche del RPE sottostante dovute alla terapia a lungo termine con HCQ. Un segnale FAF aumentato indica tipicamente l’accumulo di lipofuscina, in particolare il fluoroforo A2E, all’interno del RPE o da un metabolismo anormale con aumento della fagocitosi dei segmenti esterni dei fotorecettori o da un difetto ereditario/acquisito dei processi fagocitici.15,16 Un segnale FAF spento, invece, indica la morte delle cellule RPE.17
Il riscontro precoce di un anello pericentrale di maggiore intensità FAF, che appare come un bagliore iperfluorescente, può essere visto nella tossicità da HCQ prima che si sviluppi la degenerazione del RPE, e si pensa che rappresenti aree di danno precoce dei fotorecettori da accumulo di detriti del segmento esterno.4,18,19 Tuttavia, questo può essere abbastanza sottile e può essere facilmente mancato dall’esaminatore inesperto. Quando osservate, sono state rilevate contemporaneamente anche anomalie mfERG o SD-OCT, suggerendo una base fisiopatologica per il risultato FAF.7,18 Nonostante ciò, le prove a sostegno dell’utilità della FAF nel rilevare la tossicità subclinica precoce sono ancora complessivamente carenti, rendendola così meno affidabile come strumento di screening primario.
Più importante dello screening, il vero valore della FAF risiede nella sua capacità di monitorare la progressione nei casi noti di retinopatia da HCQ, come quando un paziente ha sospeso il farmaco, ma richiede ancora esami di follow-up periodici. In questo contesto, la FAF fornisce un indicatore sensibile della degenerazione del RPE con il progredire della tossicità, in particolare nelle fasi avanzate. Man mano che il RPE si atrofizza, l’intensità FAF nella macula pericentrale si trasforma in un aspetto a chiazze, o a macchie, e alla fine si fonde in aree scure di assenza di segnale FAF una volta che le cellule sono morte (vedi Figura 3).
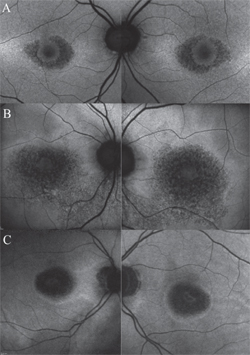
Figura 3. Modelli di autofluorescenza del fundus in vari stadi della retinopatia da idrossiclorochina. Aspetto classico della maculopatia a occhio di bue (A). Man mano che il RPE si atrofizza, l’intensità FAF nella macula pericentrale cambia in un aspetto a chiazze o a macchie (B), e alla fine si fonde in aree scure di assenza di segnale FAF una volta che le cellule sono morte (C). Queste regioni scure possono essere delimitate da un bordo di autofluorescenza aumentata (A-C), indicando quali cellule RPE andranno incontro a degenerazione.
Queste regioni scure possono essere delimitate da un bordo di autofluorescenza aumentata, che fa presagire quali cellule RPE subiranno la prossima degenerazione.17 Va notato che non tutti i casi associati all’atrofia retinica avanzata confermata da altre tecniche (per esempio, SD-OCT) hanno un aspetto marcato sulla FAF. Questo risultato evidenzia l’importanza delle linee guida dell’AAO di utilizzare più di una modalità di imaging quando si identificano gli effetti tossici dell’HCQ.
Elettroretinografia multifocale
L’elettroretinografia tradizionale a pieno campo rappresenta un test della funzione retinica globale in risposta alla stimolazione fotometrica. Poiché non è sensibile ai cambiamenti funzionali localizzati alla macula, i casi di tossicità da HCQ dimostrerebbero anomalie solo dopo che si è già verificato un danno retinico diffuso, limitando la sua utilità nei programmi di screening.4,9
Al contrario, l’ERG multifocale, con la sua capacità di registrare i difetti retinici centrali localizzati, è stato accettato come un candidato eccellente per rilevare cambiamenti sottili nelle prime fasi della tossicità.20 Raj Maturi, MD, e colleghi hanno riportato per la prima volta una marcata riduzione dell’ampiezza centrale del mfERG a 16˚ in un paziente con retinopatia manifesta da HCQ in presenza di un normale ERG a tutto campo.21 Risultati simili sono stati ottenuti da studi successivi che hanno caratterizzato i consumatori di HCQ. Timothy Y.Y. Lai, MMedSc, MRCS, e colleghi hanno osservato un declino longitudinale della funzione retinica dei pazienti che ricevevano HCQ a lungo termine, e hanno proposto che il mfERG seriale possa aiutare a rilevare i cambiamenti retinici precoci associati alla tossicità.22 In uno studio di follow-up, hanno dimostrato che le risposte del mfERG erano correlate con i valori di deviazione media dell’HVF 10-2, e quindi potevano integrare i test del campo visivo fornendo una misurazione oggettiva della funzione retinica nei pazienti che usavano l’HCQ.23
Il modello di forma d’onda più specifico visto nei pazienti con tossicità da HCQ è la perdita di ampiezza paracentrale, indicativa di una diminuzione della funzione retinica nella perifovea suscettibile. In un altro studio, il dottor Maturi e colleghi hanno proposto che il tempo implicito prolungato, se visto insieme alla perdita paracentrale dell’ampiezza, può essere una caratteristica più specifica della tossicità da HCQ.24 Inoltre, hanno dimostrato tre configurazioni aggiuntive, oltre alla perdita paracentrale, di cambiamenti anomali dell’ampiezza mfERG: 1) perdita foveale centrale; 2) perdita periferica; e 3) perdita generalizzata.24 Il loro sistema di classificazione dei modelli di cambiamenti mfERG è stato poi confermato da altri gruppi.20,22
Nel tentativo di aumentare la sensibilità rispetto all’interpretazione standard del mfERG nel rilevare la tossicità precoce dell’HCQ, Jonathan S. Lyons, MD, e Matthew L. Severns, PhD, hanno sviluppato un nuovo algoritmo per la tabulazione dei dati mfERG, definito “metodo del rapporto ad anello” (vedi Figura 4).20,25 Dato che l’ampiezza di ogni singolo mfERG somministrato può variare fino al 30% da un test successivo,26 il rapporto ad anello è stato progettato per ridurre questo rumore di fondo e creare valori più normativi per aiutare nel processo decisionale clinico. Per questo, i dati di un mfERG a 61 esagoni sono strutturati in cinque zone di anelli concentrici (R1-R5).
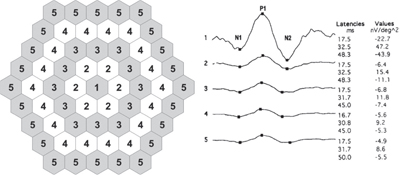
Figura 4. Il metodo del rapporto degli anelli dell’interpretazione dell’elettroretinogramma multifocale. Il diagramma del sistema del modello di stimolo a 61 esagoni sulla sinistra mostra gli esagoni appartenenti a ciascun anello. Le forme d’onda mediate dagli anelli di un paziente normale sono sulla destra. (
I rapporti degli anelli del mfERG sono definiti come i rapporti tra l’ampiezza dell’anello centrale (R1) e ciascuna delle ampiezze degli anelli periferici, con il risultato di cinque misure per ogni occhio: R1, R1/R2, R1/R3, R1/R4 e R1/R5. Poiché R1 ha l’ampiezza anulare più alta nell’occhio normale, i rapporti anulari normali sono più di 1,0; tuttavia, poiché le aree di ampiezza mfERG depressa nella tossicità da HCQ sono tipicamente a forma di anello pericentrale, e l’area maculare centrale è solitamente risparmiata fino alla fase avanzata del processo della malattia, questi pazienti dimostrano tipicamente un rapporto anulare più grande di quanto ci si aspetterebbe (sopra i limiti del 99% dei normali accettati creati da un sottoinsieme di soggetti sani).20
Mentre il test mfERG si è dimostrato molto promettente come misura oggettiva per rilevare la tossicità precoce dell’HCQ e per seguire la progressione dei cambiamenti maculari nella malattia nota, esso è limitato dalla sua dipendenza dalla cooperazione del paziente, dalla formazione di personale specializzato per la somministrazione e l’interpretazione e dal costo complessivo. Forse la cosa più importante è che non è così facilmente disponibile o facile da eseguire in modo affidabile come la SD-OCT o la FAF, limitando così il suo uso diffuso fino ad oggi.
Nessun singolo “miglior test”
Nonostante la crescente integrazione di questi sistemi di imaging sia nella ricerca che nei forum di pratica clinica, non c’è ancora un consenso su quale test sia il gold standard per rilevare la tossicità precoce dell’HCQ. La discordia è evidente in tutta la letteratura, in quanto vari sostenitori hanno sostenuto a favore di campi visivi, FAF, mfERG o SD-OCT come metodo più sensibile/specifico. In un recente studio retrospettivo su 219 pazienti, David J. Browning, MD, PhD, ha concluso che le nuove linee guida che enfatizzano la FAF, la SD-OCT o la mfERG, hanno effettivamente aumentato il costo dello screening senza migliorare il rilevamento dei casi di tossicità.27
Intanto, altri hanno suggerito che alcuni pazienti possono differire nella loro apparente sensibilità a diversi test, e quindi un attento screening con modalità multiple è probabile che aumenti la resa diagnostica nel rilevare la tossicità prima dell’inizio della perdita strutturale/funzionale irreversibile.7 Michael Marmor, MD, e Ronald Melles, MD, hanno recentemente illustrato la necessità di questo approccio multiforme in un sottogruppo di 11 pazienti che rappresentano il 10% dei loro pazienti con nota tossicità da HCQ. Questa coorte ha dimostrato la patognomonica perdita di campo 10-2 con prominenti scotomi anulari parafoveali che erano fortemente indicativi di retinopatia; tuttavia, non hanno mostrato alcuna prova di danno strutturale sull’imaging SD-OCT.28 Gli autori hanno sottolineato la necessità di adottare un approccio ampio quando si tratta di screening HCQ, di non fare affidamento solo su una singola procedura e di seguire qualsiasi risultato equivoco con ulteriori test di conferma.
Direzioni future
L’avvento dell’imaging con ottica adattiva ha permesso la visualizzazione del mosaico dei fotorecettori del cono in vivo a risoluzioni di ≤ 2 µm compensando le aberrazioni dell’ottica oculare.29-31 Usando questa tecnologia, sono state scoperte anomalie dei fotorecettori in varie malattie retiniche che non erano altrimenti distinguibili con l’imaging SD-OCT.32,33
L’uso dell’ottica adattiva nella retinopatia da HCQ è relativamente nuovo. Kimberly E. Stepien, MD, e colleghi hanno dimostrato l’alterazione del mosaico di coni fotorecettori in aree corrispondenti a difetti HVF 10-2 e anomalie della zona ellissoidale SD-OCT in due pazienti in terapia a lungo termine con HCQ.33 Analogamente, i ricercatori coreani hanno osservato un mosaico di coni alterato con singoli coni di forma e dimensioni irregolari in un paziente con maculopatia a occhio di bue.34 Inoltre, le densità complessive dei coni misurate erano diminuite in tutti i punti di test predeterminati a varie distanze dal centro foveale. Nel complesso, entrambi i gruppi hanno proposto che l’AO fornisca una modalità non invasiva, quantitativa e ad alta risoluzione per l’imaging dei pazienti affetti da retinopatia da HCQ e possa consentire il rilevamento di anomalie subcliniche che precedono la perdita oggettiva del campo visivo. Sono necessari studi su larga scala per convalidare questi risultati.
Recentemente, due gruppi hanno descritto l’uso di sistemi di microperimetria per valutare la tossicità precoce dell’HCQ.35,36 Testando la perimetria con la visualizzazione simultanea del fundus, è possibile ottenere un preciso correlato anatomico a un’aberrazione funzionale.35 Lucia Martinez-Costa e colleghi hanno osservato differenze significative nelle misure di sensibilità retinica microperimetrica tra 209 pazienti che assumevano HCQ o clorochina rispetto a 204 soggetti di controllo.36 Renu Jivrajka, MD, e colleghi hanno dettagliato i loro risultati in una coorte di 16 pazienti in terapia con HCQ per più di cinque anni senza segni di tossicità con test convenzionali 10-2 HVF, SD-OCT, FAF o mfERG; tuttavia, con la microperimetria hanno notato una significativa riduzione complessiva della sensibilità retinica media tra i pazienti e i controlli simili per età.35 Un ulteriore vantaggio del particolare sistema di microperimetria utilizzato era la sua capacità di ottenere immagini SD-OCT simultanee e di sovrapporre i valori di sensibilità e spessore retinici, rafforzando ulteriormente la nozione di correlazione tra la risposta funzionale e una struttura anatomica. Sono necessari futuri studi longitudinali prospettici, con test microperimetrici seriali, per determinare meglio se le sensibilità retiniche ridotte rappresentano effettivamente una tossicità subclinica precoce dell’HCQ.
L’idrossiclorochina è un farmaco prezioso con un basso profilo di effetti collaterali. Mentre gli effetti tossici oculari sono poco frequenti, possono essere associati a una morbilità significativa e irreversibile per il paziente. L’individuazione precoce della tossicità durante le fasi subcliniche con la sospensione del farmaco può aiutare a prevenire un ulteriore deterioramento strutturale e funzionale. Come tale, i medici dovrebbero mantenere una soglia bassa per sospettare la tossicità dell’HCQ. Anomalie sottili rilevate utilizzando una modalità giustificano ulteriori test di follow-up per confermare o confutare questi risultati, con l’obiettivo finale di una diagnosi precoce prima della perdita visiva irreversibile. RASSEGNA
La figura 4 riprodotta con il permesso di: Lyons JS, Severns ML. Rilevazione della tossicità retinica precoce dell’idrossiclorochina migliorata dall’analisi del rapporto anulare dell’elettroretinografia multifocale. Am J Ophthalmol 2007. Maggio;143(5):801-809.
Il dottor Rahimy è un collega del secondo anno al Wills Eye Hospital e un istruttore clinico di oftalmologia alla Thomas Jefferson University School of Medicine. Il Dr. Vander è un chirurgo frequentatore del servizio di retina al Wills Eye Hospital e professore di oftalmologia alla Thomas Jefferson University School of Medicine. Il Dr. Rahimy può essere contattato all’indirizzo [email protected]. Il Dr. Vander può essere contattato all’indirizzo jvander@midatlantic retina.com.
1. Tehrani R, Ostrowski RA, Hariman R, Jay WM. Tossicità oculare di idrossiclorochina. Semin Ophthalmol 2008;23(3):201-209.
2. Semmer AE, Lee MS, Harrison AR, Olsen TW. Idrossiclorochina retinopatia screening. Br J Ophthalmol 2008;92(12): 1653-1655.
3. Wolfe F, Marmor MF. Tassi e predittori di idrossiclorochina tossicità retinica in pazienti con artrite reumatoide e lupus eritematoso sistemico. Arthritis Care Res (Hoboken) 2010;62(6):775-784.
4. Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF. Raccomandazioni rivedute sullo screening per la retinopatia da clorochina e idrossiclorochina. Ophthalmology 2011;118:415-422.
5. Michaelides M, Stover NB, Francis PJ, Weleber RG. Tossicità retinica associata a idrossiclorochina e clorochina: Fattori di rischio, screening e progressione nonostante la cessazione della terapia. Arch Ophthalmol 2011;129:30-39.
6. Mititelu M, Wong BJ, Brenner M, Bryar PJ, Jampol LM, Fawzi AA. Progressione degli effetti tossici dell’idrossiclorochina dopo la cessazione della terapia: Nuove prove di imaging multimodale. JAMA Ophthalmol 2013;131:1187-1197.
7. Marmor MF. Confronto delle procedure di screening nella tossicità dell’idrossiclorochina. Arch Ophthalmol 2012;130:461-469.
8. Elder M, Rahman AM, McLay J. Precoce perdita del campo visivo paracentrale in pazienti che assumono idrossiclorochina. Arch Ophthalmol 2006;124:1729-1733.
9. Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF. Raccomandazioni sullo screening per la retinopatia da clorochina e idrossiclorochina: Un rapporto dell’Accademia Americana di Oftalmologia. Ophthalmology 2002;109:1377-1382.
10. Kellner S, Weinitz S, Kellner U. La tomografia a coerenza ottica di dominio spettrale rileva le fasi iniziali della retinopatia da clorochina simile all’elettroretinografia multifocale, all’autofluorescenza del fundus e all’autofluorescenza nel vicino infrarosso. Br J Ophthalmol 2009;93(11):1444-1447.
11. Chen E, Brown DM, Benz MS, et al. Tomografia a coerenza ottica nel dominio spettrale come test di screening efficace per la retinopatia da idrossiclorochina (il segno del “disco volante”). Clin Ophthalmol 2010;4:1151-1158.
12. Pasadhika S, Fishman GA, Choi D, Shahidi M. Assottigliamento selettivo della retina interna perifoveale come un segno precoce di idrossiclorochina tossicità retinica. Occhio (Lond) 2010;24(5):756-762; quiz 763.
13. Pasadhika S, Fishman GA. Effetti dell’esposizione cronica a idrossiclorochina o clorochina sulle strutture retiniche interne. Occhio (Lond) 2010;24(2):340-346.
14. Ulviye Y, Betul T, Nur TH, Selda C. Tomografia a coerenza ottica di dominio spettrale per il rilevamento precoce di alterazioni retiniche in pazienti che utilizzano idrossiclorochina. Indian J Ophthalmol 2013;61(4):168-171.
15. Kennedy CJ, Rakoczy PE, Constable IJ. Lipofuscina dell’epitelio pigmentato retinico: Una revisione. Eye (Lond) 1995;9 ( Pt 6)):763-771.
16. Okubo A, Rosa RH, Jr., Bunce CV, et al. Le relazioni dei cambiamenti di età nell’epitelio pigmentato retinico e nella membrana di Bruch. Invest Ophthalmol Vis Sci 1999;40(2):443-449.
17. Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Autofluorescenza del fondo e sviluppo dell’atrofia geografica nella degenerazione maculare legata all’età. Invest Ophthalmol Vis Sci 2001;42(5):1051-1056.
18. Kellner U, Renner AB, Tillack H. Autofluorescenza del fondo e mfERG per il rilevamento precoce di alterazioni retiniche in pazienti che utilizzano clorochina/idrossiclorochina. Invest Ophthalmol Vis Sci 2006;47(8):3531-3538.
19. Marmor MF. Autofluorescenza del fondo non è il miglior schermo precoce per la tossicità dell’idrossiclorochina. JAMA Ophthalmol 2013;131:1487-1488.
20. Lyons JS, Severns ML. Rilevamento della tossicità retinica precoce idrossiclorochina migliorata dall’analisi del rapporto di anello di elettroretinografia multifocale. Am J Ophthalmol 2007;143:801-809.
21. Maturi RK, Folk JC, Nichols B, Oetting TT, Kardon RH. Retinopatia da idrossiclorochina. Arch Ophthalmol 1999;117:1262-1263.
22. Lai TY, Chan WM, Li H, Lai RY, Lam DS. Cambiamenti elettroretinografici multifocali in pazienti in terapia con idrossiclorochina. Am J Ophthalmol 2005;140:794-807.
23. Lai TY, Ngai JW, Chan WM, Lam DS. Campo visivo ed elettroretinografia multifocale e loro correlazioni in pazienti in terapia con idrossiclorochina. Doc Ophthalmol 2006;112(3):177-187.
24. Maturi RK, Yu M, Weleber RG. Valutazione elettroretinografica multifocale di utenti di idrossiclorochina a lungo termine. Arch Ophthalmol 2004;122:973-981.
25. Lyons JS, Severns ML. Utilizzo di rapporti di anello ERG multifocale per rilevare e seguire la tossicità retinica Plaquenil: una revisione: Review of mfERG ring ratios in Plaquenil toxicity. Doc Ophthalmol 2009;118(1):29-36.
26. Tzekov RT, Gerth C, Werner JS. Senescenza dei componenti dell’elettroretinogramma multifocale umano: Un approccio localizzato. Graefes Arch Clin Exp Ophthalmol 2004;242(7):549-560.
27. Browning DJ. Impatto della rivista American Academy of Ophthalmology linee guida per quanto riguarda lo screening di idrossiclorochina sulla pratica attuale. Am J Ophthalmol 2013;155:418-428.e411.
28. Marmor MF, Melles RB. Disparità tra campi visivi e tomografia a coerenza ottica nella retinopatia da idrossiclorochina. Ophthalmology 2014;121:1257-62.
29. Roorda A, Romero-Borja F, Donnelly Iii W, Queener H, Hebert T, Campbell M. Ottica adattiva scansione laser oftalmoscopia. Opt Express 2002;10(9):405-412.
30. Park SP, Chung JK, Greenstein V, Tsang SH, Chang S. Uno studio dei fattori che influenzano la densità di cono fotorecettore umano misurato da ottica adattiva scansione laser oftalmoscopio. Exp Eye Res 2013;108:1-9.
31. Kim JE, Chung M. Ottica adattiva per l’imaging retinico: Stato attuale. Retina 2013;33:1483-1486.
32. Carroll J, Neitz M, Hofer H, Neitz J, Williams DR. Perdita funzionale dei fotorecettori rivelato con ottica adattiva: Una causa alternativa di daltonismo. Proc Natl Acad Sci U S A 2004;101(22):8461-8466.
33. Stepien KE, Martinez WM, Dubis AM, Cooper RF, Dubra A, Carroll J. Distruzione subclinica dei fotorecettori in risposta a un grave trauma cranico. Arch Ophthalmol 2012;130:400-402.
34. Bae EJ, Kim KR, Tsang SH, Park SP, Chang S. Danno retinico in maculopatia clorochina, rivelato da imaging ad alta risoluzione: Un case report che utilizza l’oftalmoscopia laser a scansione con ottica adattiva. Korean J Ophthalmol 2014;28(1):100-107.
35. Jivrajka RV, Genead MA, McAnany JJ, Chow CC, Mieler WF. Sensibilità microperimetrica in pazienti in terapia con idrossiclorochina (Plaquenil). Eye (Lond) 2013;27(9):1044-1052.
36. Martinez-Costa L, Victoria Ibanez M, Murcia-Bello C, et al. Uso di microperimetria per valutare idrossiclorochina e clorochina tossicità retinica. Can J Ophthalmol 2013;48(5):400-405.