The Six Key Electrophilic Aromatic Substitution Reactions
芳香族化合物の主要な反応は求電子的芳香族置換であり、C-H結合が壊れて新しいC-E結合(EはCl, Br, N…などの求電子的原子)が形成される。 ベンゼンはどうなのか?
アルケンは求電子剤との反応により「付加」生成物を与える。 ベンゼンはどうでしょう?
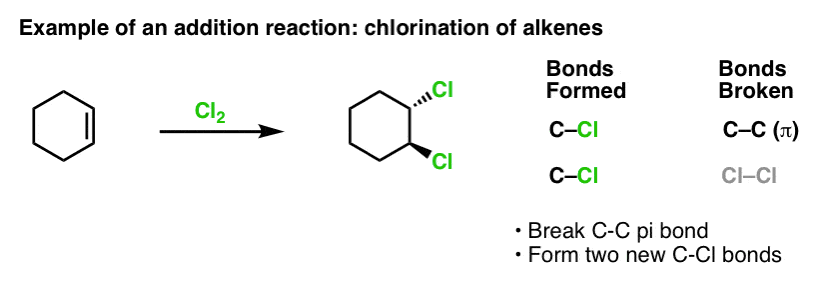
以前、アルケンの反応を取り上げたとき、たくさんの反応がありましたね。 – その結果、ほとんどの反応が「付加反応」と呼ばれる種類の反応であることがわかりました。 これは、(比較的弱い)C-C(π)結合を切断して、炭素に新しい単結合を2つ形成する反応です。 Cl2 によるアルケンの塩素化はその典型例です。
ベンゼンの話題になったので、芳香族系(ベンゼンなど)のπ結合がアルケンのπ結合とどの程度の反応性を持っているか、ひいては芳香族化合物の反応がアルケンの反応とどの程度違うかを知りたいと思うのは自然なことでしょう。
私たちは、ベンゼンが、理論的な「シクロヘキサトリエン」に期待されるものに比べて異常な安定性(共鳴エネルギーが36 kcal/mol)を持っていることを見てきましたが、これは確かに、アルケンに比べて芳香族分子のπ結合は反応性が低くなると予測させるでしょう。 水素 (H2) は、触媒量の細かく分割された炭素上のパラジウム (Pd/C) の存在下で、ほとんどのアルケン全体に加えることができますが、Aldrich Brand Whup-Ass® の缶を取り出さなければなりません (つまり
では、Cl2 や Br2 といった求電子剤が、ベンゼンのような芳香族化合物とどのように反応すると予想されるでしょうか。
Electrophilic Aromatic Substitution
最初の推測は、ベンゼンが Cl2 と反応して、以下に示すような「付加」生成物を与えることかもしれません (「通常の」アルケンに比べてより遅いとはいえ):
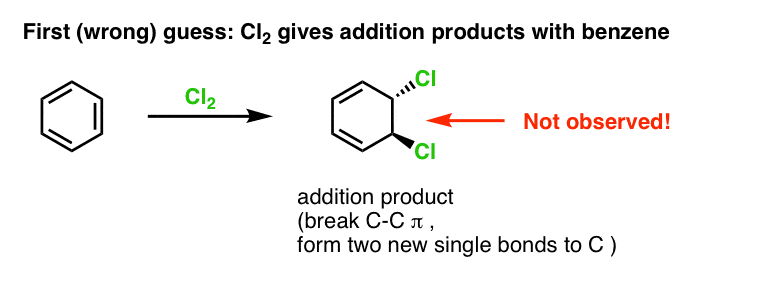
これは実際に観察した生成ではないですね!
その代わりに、ベンゼンを Cl2 で処理すると、最終的に(そして非常にゆっくりと)次の生成物が得られます:クロロベンゼンです。 π結合はすべてそのままなので、これは付加反応ではありません。
以前にも置換反応の例を見ましたが、あれは求核置換で、求核剤(例えば、π結合)を使って置換するものでした。 RS-)をハロゲン化アルキル求電子剤(R-Brなど)に付加し、脱離基(ここではBr-)を置換してC-Nuc結合(この場合はC-S)を形成し、C-LG結合(ここではC-Br)を切断します。
ではCl2とベンゼンの反応も同様に求核置換反応なのでしょうか? いいえ、そうではありません。
Cl2は非常に貧弱な求核剤で、強いルイス酸(例えば、下のAlCl3)とだけ電子供与体として反応する。 アルケンのπ結合のような比較的穏やかな求核剤と組み合わせた場合は、アルケンとの反応で見たように親電子(電子受容体)として振る舞う。
このようにCl2とベンゼンの反応は求電子芳香族置換(略称EAS)と呼ばれている。
- 求電子的というのは、電子に乏しい種(求電子)を芳香族化合物(ベンゼン)に加えるからで、
- 置換というのは、C-H を壊して C-E (E は求電子(この場合、Cl)) を形成するからである。
Lewis Acids Accelerate The Rate of Electrophilic Aromatic Substitution Reactions
Cl2 とベンゼンの反応は足の爪の成長より速いですが、それほどでもありません(しかし、トルエンやフェノールなど、より電子豊富な芳香族でははるかに速くなります)。 そこで、反応が完了するのを待つために実験室で何週間も座っている代わりに、Cl2 の反応性を「スープアップ」する試薬を加えて、さらに優れた求電子剤、つまり触媒にすることができるのです。 update: メカニズムに関する投稿を参照
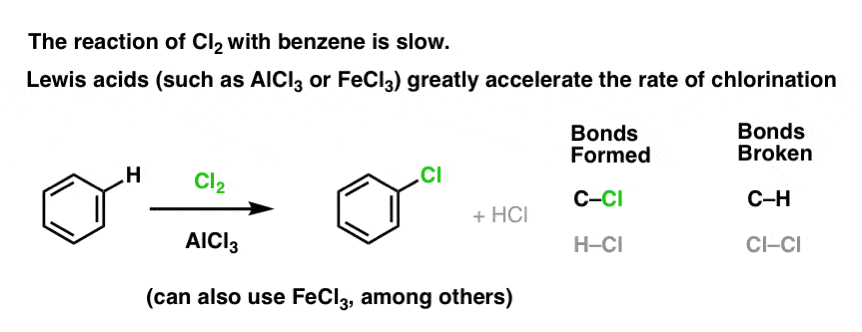
これはどのように作用するのでしょうか。
アルコールについてのシリーズで、アルコール (R-OH) は、強い酸を加えると (R-OH2+ を形成すると)、置換および脱離反応に参加させることができることを思い出していただければと思います。 H2OはHO-よりも弱い塩基なので、より良い脱離基となるのです。 エタノール自体はNaClと反応して塩化エチルを生成することはない。なぜなら、生成する脱離基HO-はCl-に対して強すぎる塩基であるため、反応をある程度まで進行させることができないからである。 しかし、HClなどの強酸でアルコールを共役酸R-OH2 +に変換すると、Cl-がはるかに弱い塩基H2Oを置き換えるので、反応を進めることができます。
H+がC-O結合を弱め、それによってそれに結合した炭素を親電子性にすると考えるのは有益な場合があります。
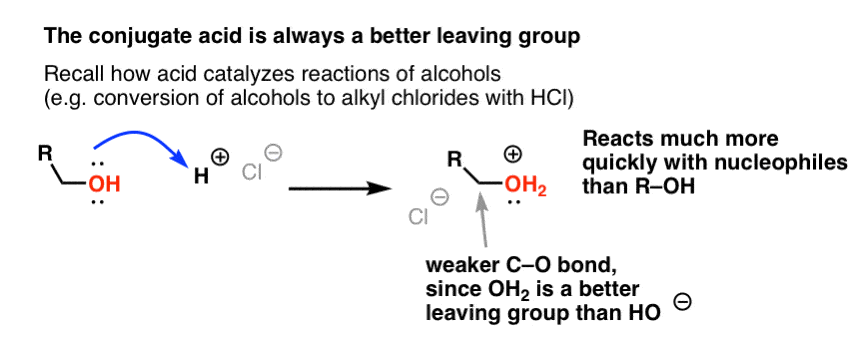
酸が水酸基を共役酸に変換して、その後の反応のために OH 基に結合した炭素を「プライミング」するように、ルイス酸も同様に Cl2 に対して同じマジックを行います (さらに言えば、これから扱うすべての求電子芳香族置換反応には、ある種の酸触媒が関与しています)。
塩素化の場合、ルイス酸(AlCl3、以下同様)はCl2から一対の電子を受け取ります。 これはCl-Cl結合を弱め、さらに良い求核剤にする。 遠位の Cl で求核剤が攻撃すると、Cl- ではなく、さらに弱い塩基 (したがって、より良い脱離基) AlCl4(-) が遊離します。
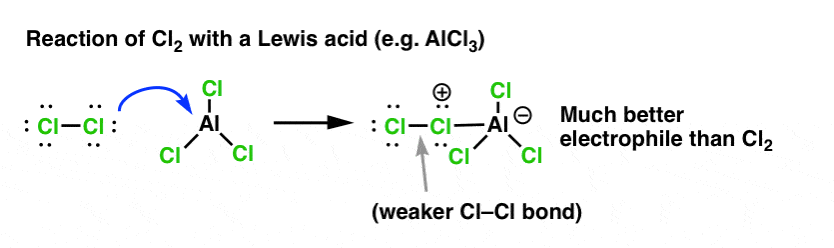
ルイス酸 (H2SO4 などブレンステッド酸も含む) の付加は、有機化学入門で通常扱われる 6 つの主要親電子芳香族置換に共通するものです。
6つの重要な求電子芳香族置換反応のキーパターン
このセクションでは、これら6つの重要な求電子芳香族置換反応を3つのペアにうまくまとめて紹介します。
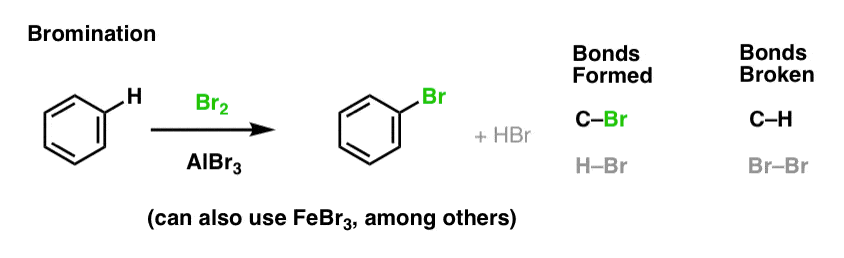
- 塩素化と臭素化
- ニトロ化とスルホン化
- Friedel-Crafts alkylation と Friedel-Crafts acylation
まだメカニズムには立ち入るつもりはありません。
ここで重要なのは、どのような結合が形成され、切断されるかを追うことで、重要なパターンがわかるようにすることです。 Br2はベンゼンと適度な速度で反応するほど強い求電子剤ではないので、AlBr3やFeBr3などのルイス酸を使って反応を促進させます。 .
芳香族分子のニトロ化とスルホン化
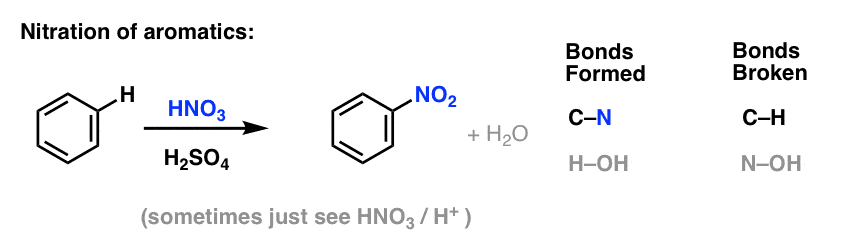
ニトロ化(HをNO2基で置換)はアルケンの項で見た反応ではないが、ベンゼンなどの芳香族分子ではよく見られる反応である。 メチルベンゼン(トルエン)が2,4,6-トリニトロトルエンに変換される反応もこれです。
ニトロ化は、硝酸(HNO3)をNO2源として、硫酸(H2SO4)をルイス酸として、HをNO2に置換する反応です。
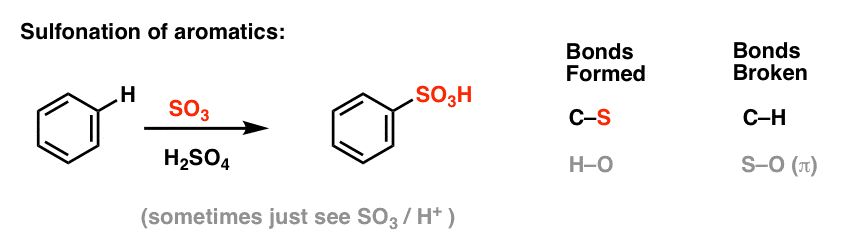
スルホン化(HをSO3H基に置換)も有用な反応であることがわかっています。 これはルイス酸として硫酸(H2SO4)の存在下で三酸化硫黄(SO3)を加えることによって行うことができる:
Friedel-Crafts Alkylation and Acylation
上の4つの反応で、C-Cl, C-Br, C-N および C-S が生成することが確認された。
また、ルイス酸の存在下でアルキルまたはアシルハライドを加えることによって、芳香族分子に炭素-炭素結合を形成することも可能である。 これらの反応は、発明者の名前をとってフリーデル・クラフツ反応と呼ばれています(この反応は1877年にさかのぼります)。
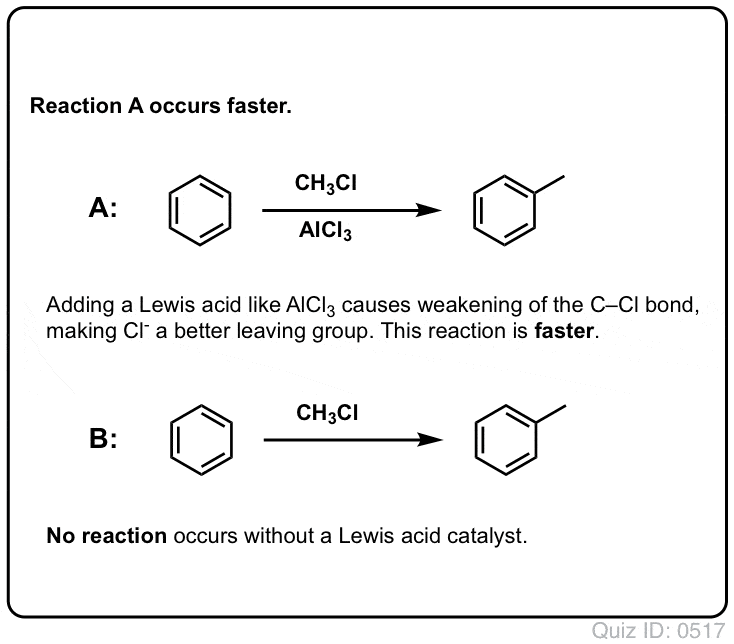
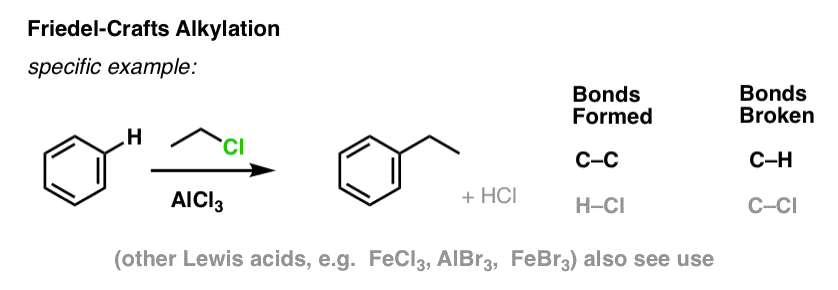
フリーデル・クラフツ・アルキル化では、CH3CH2Clなどのアルキルハライド「R-X」から始めて、AlCl3 やFeCl3 などのルイス酸を添加します。 Cl2の場合と同様に、ルイス酸はハロゲンに配位して反応を促進し、C-Cl結合を弱め、より良い脱離基にして、付着した炭素が求核剤によってより容易に攻撃されるようにする。 ルイス酸がなければ反応は起こりません。
ここで、C-C を形成して C-H を切断することに注意してください。
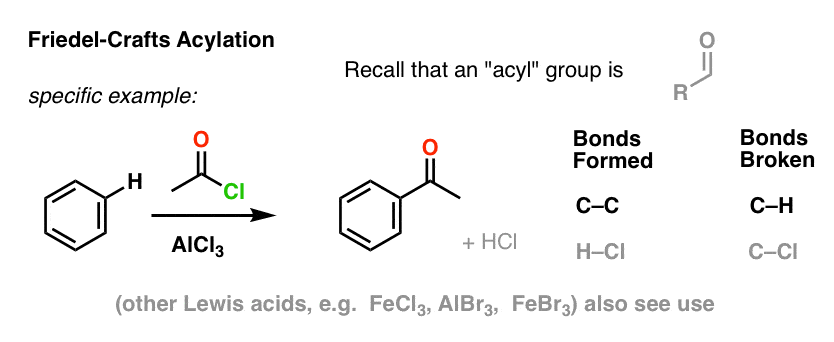
Friedel-Crafts Acylation も同様ですが、ハロゲン化アシルから開始します。 ルイス酸の添加により、C-Cの形成とC-Hの切断が起こります。
まとめ:6 つの主要な求電子芳香族置換反応
6つの主要な求電子芳香族置換反応(塩素化、臭素化、ニトロ化、スルホン化、およびフリーデル・クラフツのアルキル化、アシル化)と C-H の切断と C-E (ここで “E” は問題の求電子剤)の生成に関することを紹介しました。
しかし、形成と切断の結合を知ることは始まりに過ぎません。
- ベンゼンの置換基はこの反応にどう影響するのでしょうか。 例えば、メチルベンゼンやフェノール、クロロベンゼンでこの反応を行った場合、どのような影響を受けるでしょうか。
- 電子供与性、電子吸引性の置換基は、反応速度にどのような影響を与えますか。 しかし、モノ置換体から始めて親電子的芳香族置換を行うとどうでしょうか。 置換基の行き着く先はどこなのでしょうか?
- この反応はどのように行われるのでしょうか? C-Eの生成とC-Hの切断をどう説明するか。
- 他の芳香族基(ベンゼン以外)についてはどうでしょうか。 ピロール、ピリジン、ナフタレンなどに対する求電子的芳香族置換反応はどうでしょうか。
次回は、最初の質問である電子供与性置換基と電子吸引性置換基の効果について述べたいと思います。 活性化基と不活性化基についてお話します。
次の記事へ 活性化基と不活性化基
お読みいただきありがとうございました!
Matthew Knowe氏に感謝いたします。
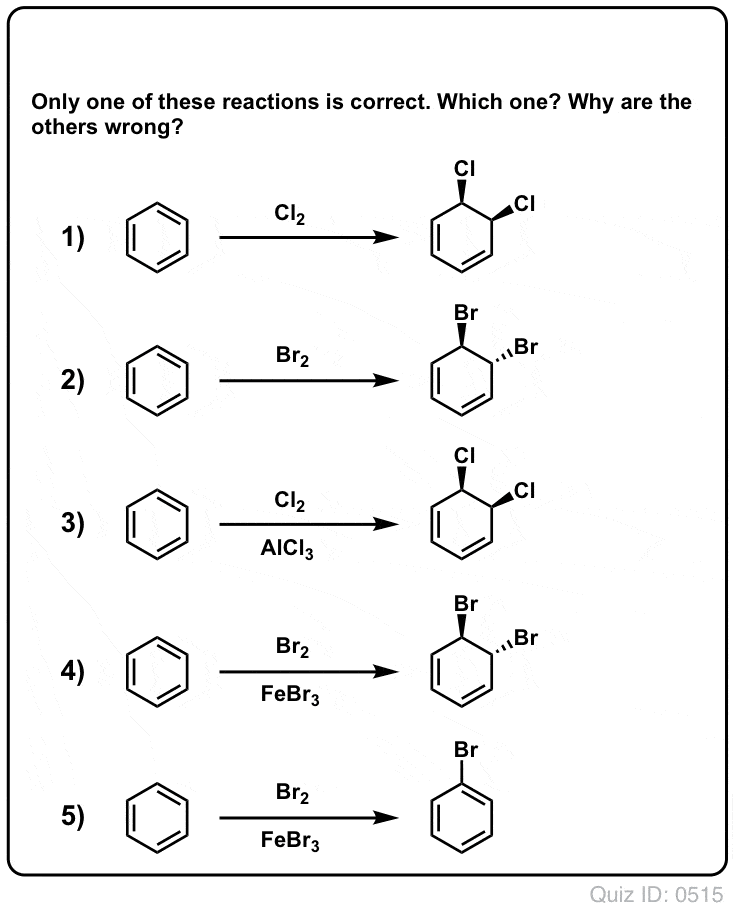
Quiz Yourself!
 Click to Flip
Click to Flip 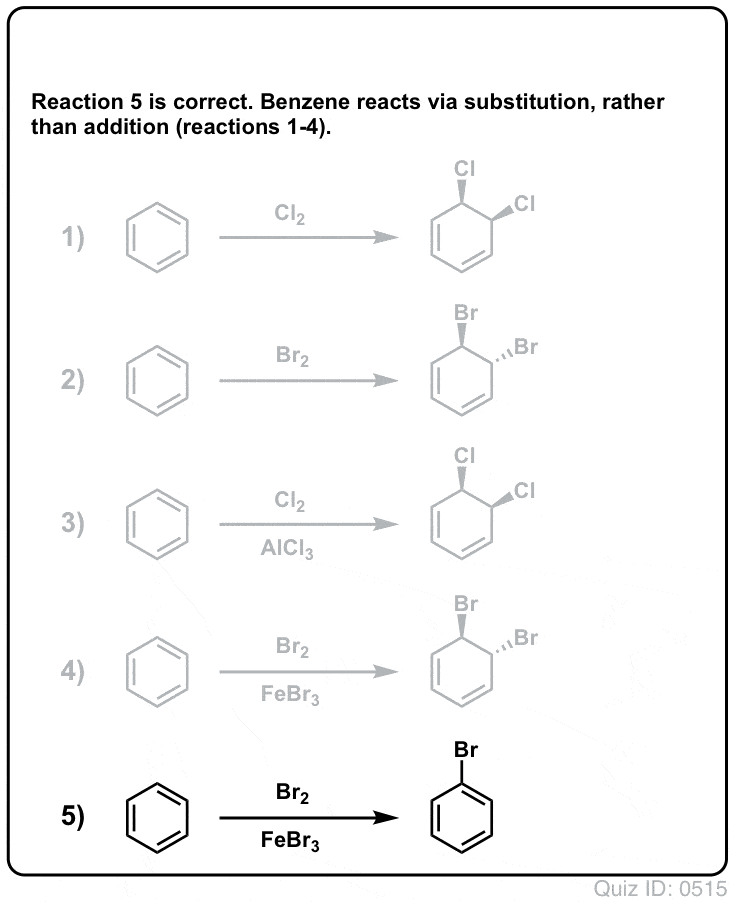
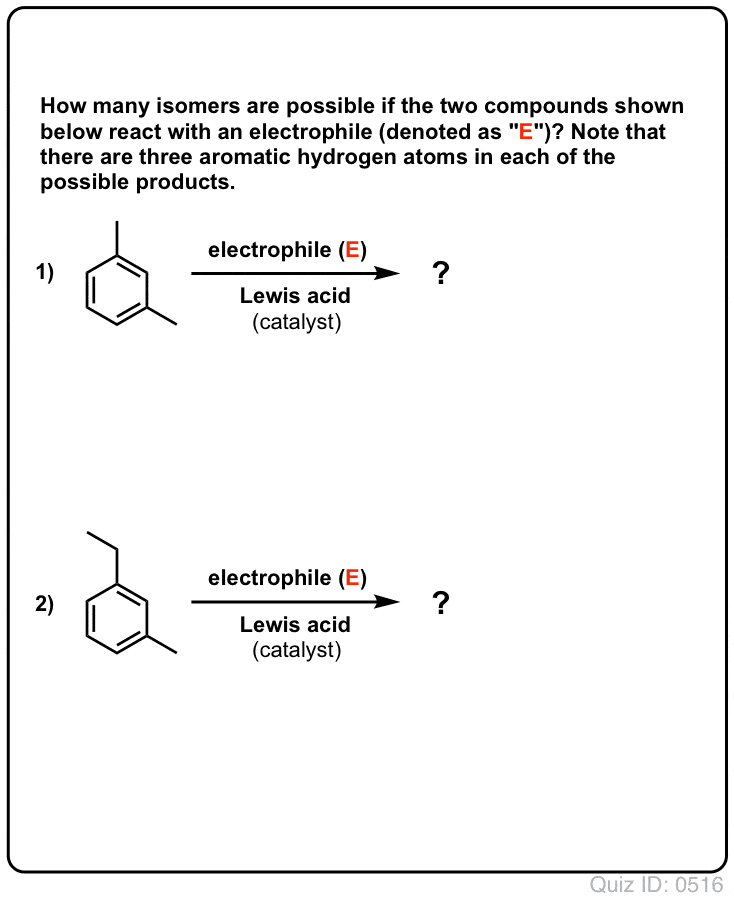 クリックで反転
クリックで反転 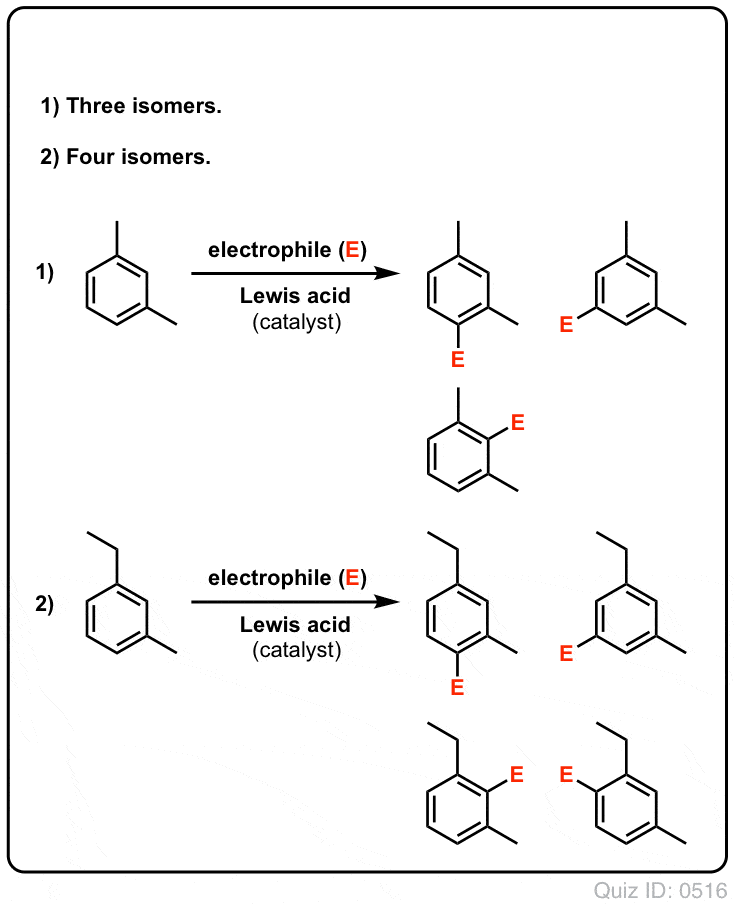
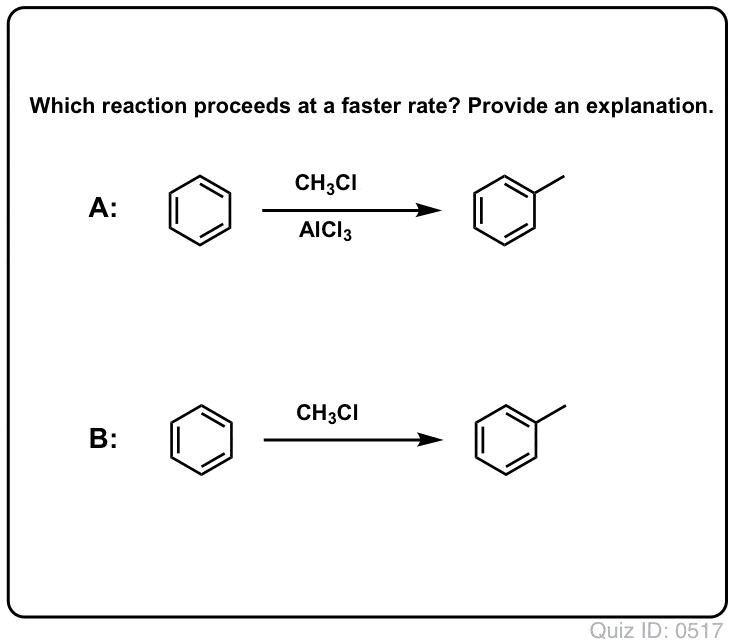 クリックで反転
クリックで反転