Gebogen pijlen gebruiken
We gaan nu terug naar een oude vriend van ons, \(CH_3CNO\), die we hebben geïntroduceerd toen we voor het eerst over resonantiestructuren spraken. We gebruiken deze verbinding om verder te illustreren hoe mobiele elektronen worden “geduwd” om van de ene resonantiestructuur naar de andere te komen.
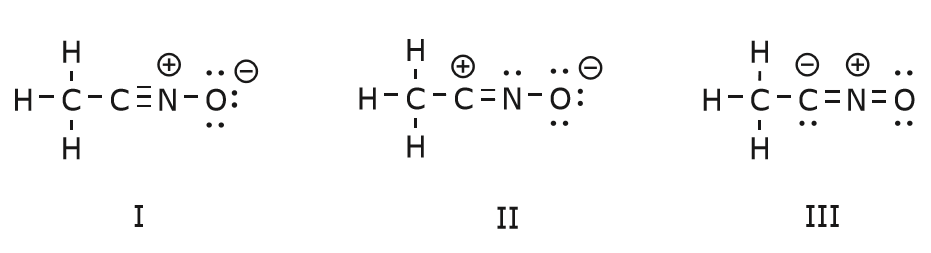
De elektronenbeweging die plaatsvindt om van structuur I naar structuur II te komen, begint met de drievoudige binding tussen koolstof en stikstof. We verplaatsen een van de twee bindingen die deel uitmaken van de drievoudige binding naar de positieve lading van stikstof, zoals weergegeven:
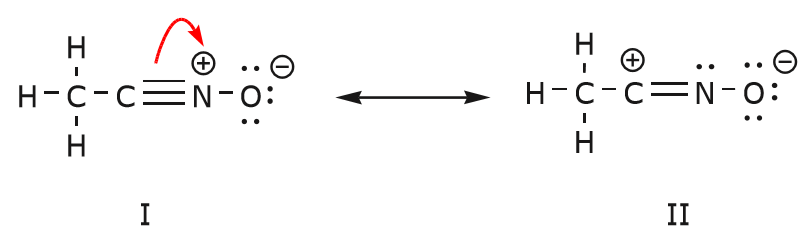
Wanneer we dit doen, letten we goed op de nieuwe status van de betrokken atomen en maken we de nodige aanpassingen aan de ladingen, bindingen en niet-gedeelde elektronen om de geldigheid van de resulterende formules te behouden. In dit geval, bijvoorbeeld, moet de koolstof die deel uitmaakt van de drievoudige binding in structuur I een positieve lading krijgen in structuur II omdat hij een elektron heeft verloren. De stikstof daarentegen is nu neutraal omdat hij één elektron heeft gewonnen en hij drie bindingen vormt in plaats van vier.
We kunnen ook van structuur I naar structuur III komen door elektronen op de volgende manier te verschuiven. De pijlen zijn in dit voorbeeld genummerd om aan te geven welke beweging het eerst begint, maar dat maakt geen deel uit van de conventies die in het gebogen-pijlformalisme worden gebruikt.
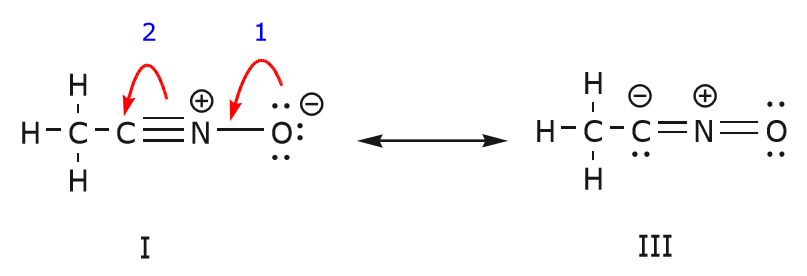
Als we een paar ongedeelde elektronen van zuurstof naar het stikstofatoom verplaatsen, zoals te zien is in stap 1, zijn we gedwongen om elektronen van stikstof naar koolstof te verplaatsen, zoals te zien is in stap 2. Anders zouden we een stikstof met 5 bindingen krijgen, wat onmogelijk is, al is het maar voor even. Merk opnieuw op dat in stap 1 de pijl uitgaat van een ongedeeld elektronenpaar van zuurstof en zich verplaatst naar de positieve lading van stikstof. Er ontstaat een nieuwe binding tussen stikstof en zuurstof. Tegelijkertijd worden de elektronen die in stap 2 naar koolstof zijn verplaatst een paar ongedeelde elektronen in structuur III. Tenslotte verandert ook de hybridisatietoestand van sommige atomen. Bijvoorbeeld het koolstofatoom in structuur I is sp gehybridiseerd, maar in structuur III is het sp gehybridiseerd.
Je kunt misschien nog wat verder spelen en kijken of je van structuur II naar structuur III kunt komen, enz. Maar wees gewaarschuwd dat het soms lastiger is dan het op het eerste gezicht lijkt.
Extra regels voor het verplaatsen van elektronen om Resonantiestructuren te schrijven:
- Elektronenparen kunnen alleen naar aangrenzende posities verplaatsen. Aangrenzende posities betekent naburige atomen en/of bindingen.
- De Lewis-structuren die het resultaat zijn van het verplaatsen van elektronen moeten geldig zijn en moeten dezelfde netto lading bevatten als alle andere resonantiestructuren.
Het volgende voorbeeld illustreert hoe een eenzaam elektronenpaar van koolstof kan worden verplaatst om een nieuwe binding te maken met een aangrenzende koolstof, en hoe de elektronen tussen koolstof en zuurstof kunnen worden verplaatst om een paar ongedeelde elektronen op zuurstof te worden. Geen van de voorgaande regels is in deze voorbeelden overtreden.
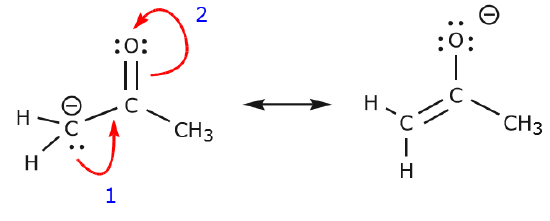
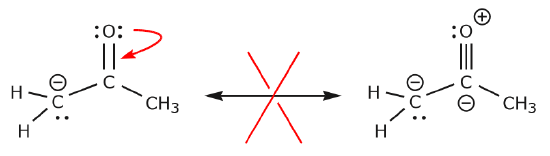
Laten we nu eens kijken naar enkele voorbeelden van HOE ELECTRONEN NIET TE VERPLAATSEN. Door hetzelfde voorbeeld te gebruiken, maar de elektronen op een andere manier te verplaatsen, wordt geïllustreerd hoe zo’n verplaatsing zou resulteren in ongeldige Lewis-formules, en dus onaanvaardbaar is. Niet alleen verplaatsen we de elektronen in de verkeerde richting (weg van een elektronegatiever atoom), maar de resulterende structuur schendt verschillende conventies. Ten eerste heeft de centrale koolstof vijf bindingen en is dus in strijd met de octet-regel. Ten tweede is de totale lading van de tweede structuur anders dan die van de eerste. Om een koolstof met vijf bindingen te vermijden, zouden we een van de C-C enkelvoudige bindingen moeten vernietigen, waardoor het moleculaire skelet zou worden vernietigd.
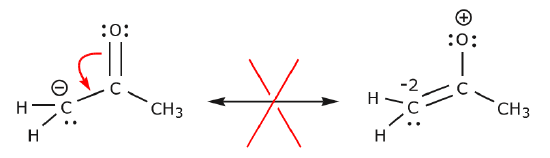
In het onderstaande voorbeeld worden elektronen verplaatst naar een gebied met een hoge elektronendichtheid (een negatieve lading), in plaats van naar een positieve lading. Bovendien wordt de octetregel overtreden voor koolstof in de resulterende structuur, waar het meer dan acht elektronen deelt.
Extra voorbeelden illustreren de regels waar we het over hebben gehad.
(a) Ongedeelde elektronenparen (lone pairs) die zich op een bepaald atoom bevinden, kunnen alleen naar een aangrenzende positie verhuizen om een nieuwe binding te maken met het volgende atoom.
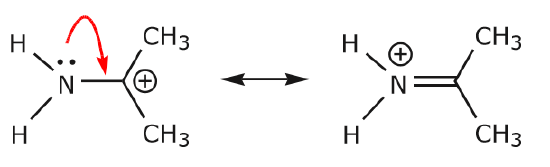
(b) Tenzij er een positieve lading op het volgende atoom staat (koolstof boven), zullen andere elektronen verplaatst moeten worden om de octetregel te behouden. In resonantiestructuren zijn dit bijna altijd sigma-elektronen, en bijna nooit sigma-elektronen.
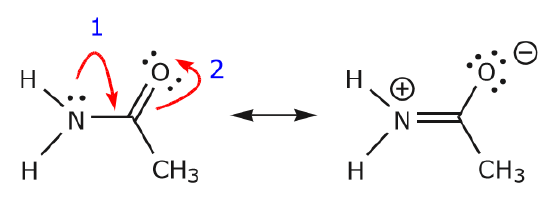
Als de elektronen van het stikstof lone paar naar de naburige koolstof bewegen om een nieuwe binding te maken, moeten de elektronen die de C=O binding vormen naar de zuurstof worden verplaatst om te voorkomen dat er vijf bindingen met de centrale koolstof ontstaan.
c) Zoals hierboven is te zien, kunnen de elektronen naar een van de twee atomen die ze delen worden verplaatst om een nieuw lone paar te vormen. In het voorbeeld hierboven zijn de elektronen van de C=O binding naar de zuurstof gegaan om een nieuw lone paar te vormen. Een ander voorbeeld is:
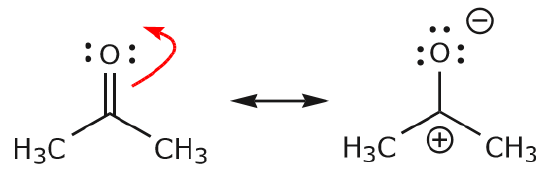
(d) De elektronen van de C=O binding kunnen ook naar een aangrenzende positie bewegen om een nieuwe lone paar te vormen. Ook hier moet de octetregel in acht worden genomen:
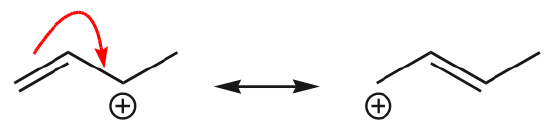
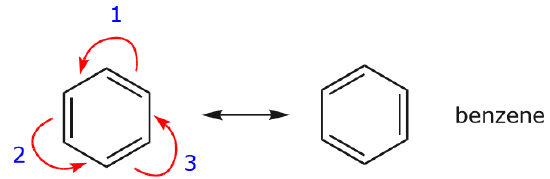
Een van de meest voorkomende voorbeelden van deze eigenschap wordt waargenomen bij het schrijven van resonantievormen voor benzeen en soortgelijke ringen.