Utilizarea săgeților curbe
Ne întoarcem acum la un vechi prieten de-al nostru, \(CH_3CNO\), pe care l-am introdus când am vorbit pentru prima dată despre structurile de rezonanță. Folosim acest compus pentru a ilustra în continuare modul în care electronii mobili sunt „împinși” pentru a ajunge de la o structură de rezonanță la alta.
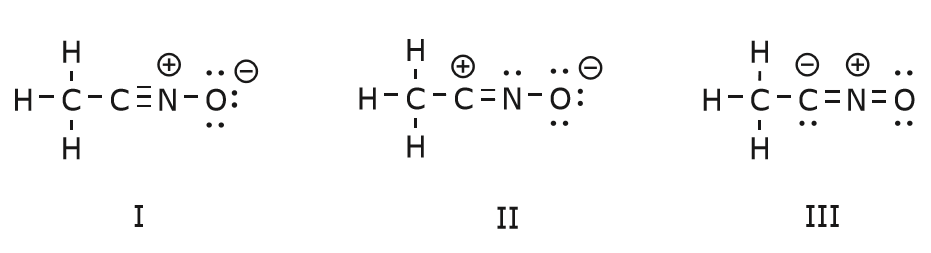
Mișcarea de electroni care are loc pentru a ajunge la structura II din structura I începe cu tripla legătură dintre carbon și azot. Vom muta una dintre cele două legături \(\pi\) care fac parte din tripla legătură spre sarcina pozitivă a azotului, așa cum se arată:
Când facem acest lucru, acordăm o atenție deosebită noii stări a atomilor afectați și facem toate ajustările necesare sarcinilor, legăturilor și electronilor neîmpărțiți pentru a păstra validitatea formulelor rezultate. În acest caz, de exemplu, carbonul care face parte din tripla legătură din structura I trebuie să dobândească o sarcină pozitivă în structura II, deoarece a pierdut un electron. Azotul, pe de altă parte, este acum neutru pentru că a câștigat un electron și formează trei legături în loc de patru.
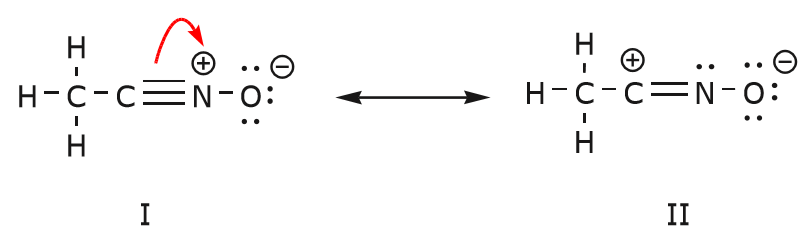
De asemenea, putem ajunge de la structura I la structura III prin împingerea electronilor în felul următor. Săgețile au fost numerotate în acest exemplu pentru a indica ce mișcare începe prima, dar acest lucru nu face parte din convențiile folosite în formalismul săgeților curbe.
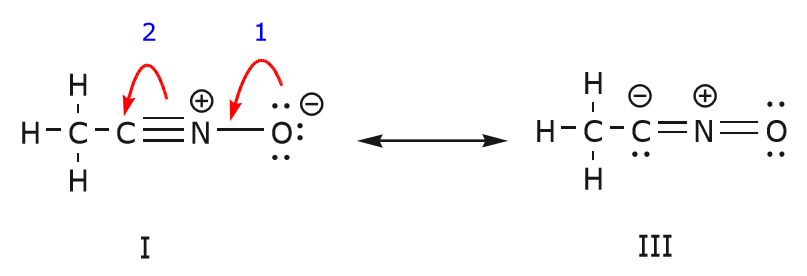
În timp ce deplasăm o pereche de electroni neîmpărtășiți de la oxigen spre atomul de azot, așa cum se arată în pasul 1, suntem forțați să deplasăm electroni de la azot spre carbon, așa cum se arată în pasul 2. În caz contrar, ne-am trezi cu un azot cu 5 legături, ceea ce este imposibil, chiar și numai momentan. Din nou, observați că, în pasul 1, săgeata pornește de la o pereche de electroni neîmpărtășită de la oxigen și se deplasează spre sarcina pozitivă de pe azot. Se formează o nouă legătură \(\pi\) între azot și oxigen. În același timp, electronii \(\pi\) care sunt deplasați spre carbon în etapa 2 devin o pereche de electroni neîmpărtășiți în structura III. În cele din urmă, se schimbă și starea de hibridizare a unor atomi. De exemplu, atomul de carbon din structura I este hibridizat sp, dar în structura III este hibridizat \(sp^3\).
S-ar putea să vă mai jucați puțin și să vedeți dacă puteți ajunge de la structura II la structura III, etc. Cu toate acestea, vă avertizăm că uneori este mai complicat decât pare la prima vedere.
Reguli suplimentare pentru mutarea electronilor pentru a scrie structuri de rezonanță:
- Parii de electroni se pot muta numai în poziții adiacente. Poziții adiacente înseamnă atomi și/sau legături vecine.
- Structurile Lewis care rezultă din deplasarea electronilor trebuie să fie valide și trebuie să conțină aceeași sarcină netă ca toate celelalte structuri de rezonanță.
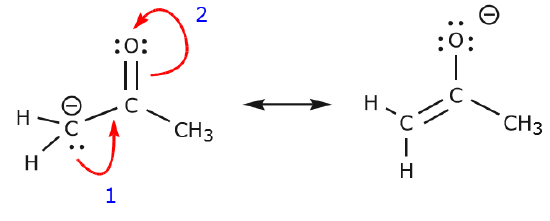
Exemplul următor ilustrează modul în care o pereche de electroni solitari din carbon poate fi mutată pentru a realiza o nouă legătură \(\pi\) cu un carbon adiacent și cum electronii \(\pi\) dintre carbon și oxigen pot fi mutați pentru a deveni o pereche de electroni neîmpărtășiți pe oxigen. Niciuna dintre regulile anterioare nu a fost încălcată în niciunul dintre aceste exemple.
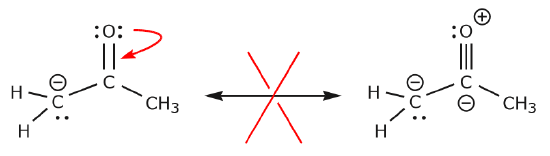
Acum să analizăm câteva exemple despre CUM NU SE MUTĂ ELECTRONII. Folosirea aceluiași exemplu, dar deplasarea electronilor într-un mod diferit, ilustrează modul în care o astfel de deplasare ar duce la formule Lewis invalide și, prin urmare, este inacceptabilă. Nu numai că mutăm electronii în direcția greșită (departe de un atom mai electronegativ), dar structura rezultată încalcă mai multe convenții. În primul rând, carbonul central are cinci legături și, prin urmare, încalcă regula octetului. În al doilea rând, sarcina totală a celei de-a doua structuri este diferită de prima. Pentru a evita să avem un carbon cu cinci legături ar trebui să distrugem una dintre legăturile simple C-C, distrugând în acest proces scheletul molecular.
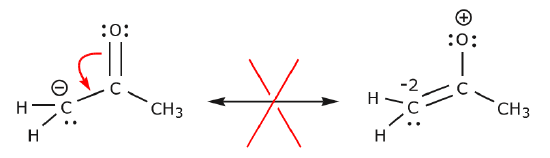
În exemplul de mai jos, electronii sunt mutați spre o zonă cu densitate mare de electroni (o sarcină negativă), mai degrabă decât spre o sarcină pozitivă. În plus, regula octetului este încălcată pentru carbon în structura rezultată, unde acesta împarte mai mult de opt electroni.
Exemple suplimentare ilustrează în continuare regulile despre care am vorbit.
(a) Perechile de electroni neîmpărtășite (perechi solitare) situate pe un anumit atom se pot deplasa într-o poziție adiacentă doar pentru a realiza o nouă legătură \(\pi\) cu următorul atom.
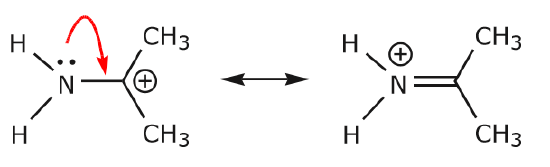
(b) Cu excepția cazului în care există o sarcină pozitivă pe următorul atom (carbonul de mai sus), alți electroni vor trebui să fie deplasați pentru a păstra regula octetului. În structurile de rezonanță, aceștia sunt aproape întotdeauna electroni \(\pi\) și aproape niciodată electroni sigma.
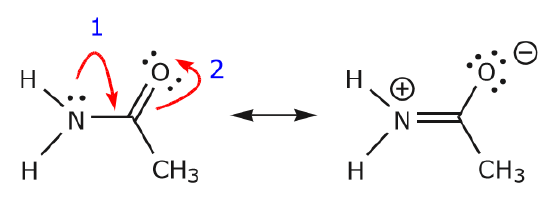
În timp ce electronii din perechea solitară de azot se deplasează spre carbonul vecin pentru a realiza o nouă legătură \(\pi\), electronii \(\pi\) care alcătuiesc legătura C=O trebuie să fie deplasați spre oxigen pentru a evita să se termine cu cinci legături la carbonul central.
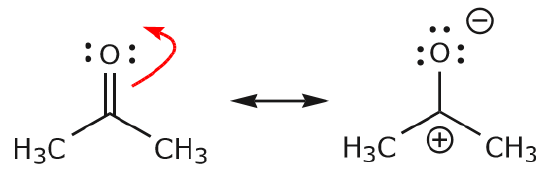
c) După cum se poate observa mai sus, electronii \(\pi\) se pot deplasa spre unul dintre cei doi atomi pe care îi împart pentru a forma o nouă pereche solitară. În exemplul de mai sus, electronii \(\pi\) din legătura C=O s-au deplasat spre oxigen pentru a forma o nouă pereche singuratică. Un alt exemplu este:
(d) electronii \(\pi\) se pot, de asemenea, deplasa către o poziție adiacentă pentru a forma o nouă legătură \(\pi\). Din nou, trebuie respectată regula octetului:
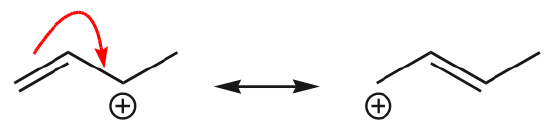
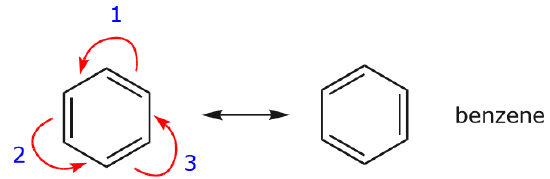
Unul dintre cele mai frecvente exemple ale acestei caracteristici se observă la scrierea formelor de rezonanță pentru benzen și inele similare.