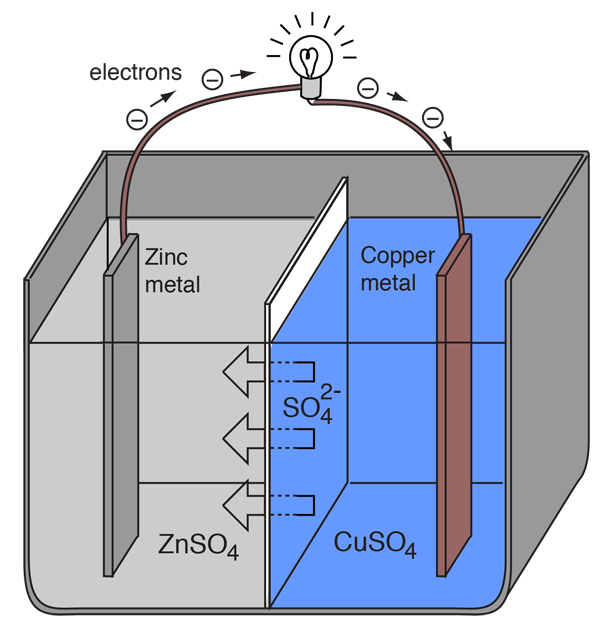
Una cella elettrochimica che causa un flusso di corrente elettrica esterna può essere creata usando due metalli diversi, poiché i metalli differiscono nella loro tendenza a perdere elettroni. Lo zinco perde elettroni più facilmente del rame, quindi ponendo lo zinco e il rame in soluzioni dei loro sali si può far fluire gli elettroni attraverso un filo esterno che porta dallo zinco al rame.
Aggiungi annotazione all’illustrazione
Quando un atomo di zinco fornisce gli elettroni, diventa uno ione positivo e va in soluzione acquosa, diminuendo la massa dell’elettrodo di zinco. Dal lato del rame, i due elettroni ricevuti gli permettono di convertire uno ione di rame dalla soluzione in un atomo di rame senza carica che si deposita sull’elettrodo di rame, aumentando la sua massa. Le due reazioni sono tipicamente scritte
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Le lettere tra parentesi sono solo per ricordare che lo zinco passa da un solido (s) in una soluzione acquosa (aq) e viceversa per il rame. È tipico nel linguaggio dell’elettrochimica riferirsi a questi due processi come “mezze reazioni” che avvengono ai due elettrodi.
Zn(s) -> Zn2+(aq) + 2e- |
La “mezza reazione” dello zinco è classificata come ossidazione poiché perde elettroni. Il terminale in cui avviene l’ossidazione è chiamato “anodo”. Per una batteria, questo è il terminale negativo. |
|
La “mezza reazione” del rame è classificata come riduzione poiché guadagna elettroni. Il terminale in cui avviene la riduzione è chiamato “catodo”. Per una batteria, questo è il terminale positivo. |
Cu2+(aq) + 2e- -> Cu(s) |
Affinché la cella voltaica continui a produrre una corrente elettrica esterna, ci deve essere un movimento degli ioni solfato in soluzione da destra a sinistra per bilanciare il flusso di elettroni nel circuito esterno. Agli stessi ioni metallici deve essere impedito di muoversi tra gli elettrodi, quindi un qualche tipo di membrana porosa o altro meccanismo deve prevedere il movimento selettivo degli ioni negativi nell’elettrolita da destra a sinistra.
È necessaria energia per forzare gli elettroni a muoversi dall’elettrodo di zinco a quello di rame, e la quantità di energia per unità di carica disponibile dalla cella voltaica è chiamata forza elettromotrice (emf) della cella. L’energia per unità di carica è espressa in volt (1 volt = 1 joule/coulomb).
E’ chiaro che per ottenere energia dalla cella, bisogna ottenere più energia liberata dall’ossidazione dello zinco di quanta ne serve per ridurre il rame. La cella può produrre una quantità finita di energia da questo processo, essendo il processo limitato dalla quantità di materiale disponibile nell’elettrolita o negli elettrodi metallici. Per esempio, se ci fosse una mole di ioni solfato SO42- sul lato rame, allora il processo è limitato al trasferimento di due moli di elettroni attraverso il circuito esterno. La quantità di carica elettrica contenuta in una mole di elettroni è chiamata costante di Faraday, ed è uguale al numero di Avogadro per la carica dell’elettrone:
La resa energetica di una cella voltaica è data dalla tensione della cella per il numero di moli di elettroni trasferiti per la costante di Faraday.
Energia elettrica prodotta = nFEcell
L’emf della cella Ecell può essere previsto dai potenziali standard degli elettrodi per i due metalli. Per la cella zinco/rame nelle condizioni standard, il potenziale di cella calcolato è di 1,1 volt.
| Celle a secco | Batterie al piombo |