De seks vigtigste elektrofil aromatiske substitutionsreaktioner
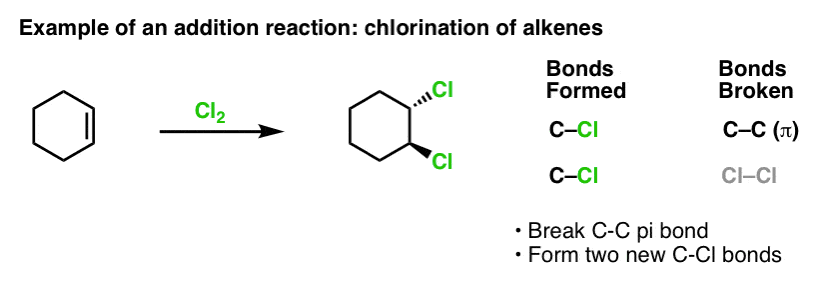
En af de vigtigste reaktioner for aromatiske forbindelser er elektrofil aromatisk substitution, hvor en C-H-binding brydes og en ny C-E-binding (E er et elektrofilt atom som Cl, Br, N…) dannes.
Inholdsfortegnelse
- Alkener giver “additionsprodukter” ved reaktion med elektrofiler. Hvordan kan benzen så sammenlignes?
- Elektrofil aromatisk substitution
- Lewis-syrer fremskynder hastigheden af elektrofil aromatiske substitutionsreaktioner
- Nøglemønsteret for seks vigtige elektrofil aromatiske substitutionsreaktioner
- Aromatisk klorering og bromering
- Aromatisk nitrering og sulfonering
- Friedel-Crafts alkylering og acylering
- Summarum: De seks vigtigste elektrofiliske aromatiske substitutionsreaktioner
- Quiz dig selv!
- Alkener giver “additions”-produkter ved reaktion med elektrofiler. Så hvordan kan benzen sammenlignes?
- Elektrofil aromatisk substitution
- Lewis-syrer fremskynder hastigheden af elektrofile aromatiske substitutionsreaktioner
- Nøglemønsteret for seks vigtige elektrofile aromatiske substitutionsreaktioner
- Chlorering og bromering af aromatiske molekyler
- Nitration og sulfonering af aromatiske molekyler
- Friedel-Crafts Alkylering og Acylering
- Summary: The Six Key Electrophilic Aromatic Substitution Reactions
- Quiz dig selv!
Alkener giver “additions”-produkter ved reaktion med elektrofiler. Så hvordan kan benzen sammenlignes?
Da vi dækkede alkenernes reaktioner for et stykke tid siden – en masse reaktioner! – så vi, at langt de fleste faldt ind under den klasse af reaktioner, vi kalder additionsreaktioner. Det er der, hvor vi bryder en (relativt svag) C-C (pi)-binding og danner to nye enkeltbindinger til kulstof. Klorering af alkener med Cl2 er et klassisk eksempel:
Når vi nu er ved emnet benzen, er det naturligt at spørge sig selv, hvor godt pi-bindingerne i aromatiske systemer (som benzen) står i forhold til reaktiviteten i forhold til pi-bindingerne i alkener, og i forlængelse heraf, hvordan reaktioner af aromatiske forbindelser står i forhold til reaktioner af alkener.
Vi har set, at benzen har usædvanlig stabilitet (36 kcal/mol resonansenergi) i forhold til, hvad vi ville forvente for teoretisk “cyclohexatrien”, hvilket helt sikkert ville få os til at forudsige, at pi-bindingerne i aromatiske molekyler vil være mindre reaktive, i forhold til alkener.
Du husker måske også, at benzen selv er usædvanlig vanskelig at hydrogenere. Hydrogen (H2) kan bringes til at tilføje på tværs af de fleste alkener i tilstedeværelse af en katalytisk mængde fint fordelt palladium på kulstof (Pd/C), men man skal virkelig bryde ud af dåsen Aldrich Brand Whup-Ass® (dvs. høje temperaturer, høje tryk af H2 , forlængede reaktionstider ) for at få succes med at tilsætte H2 til benzen, i forhold til “typiske” alkener.
Med denne viden, hvordan kan vi så forvente, at elektrofiler som Cl2 eller Br2 reagerer med aromatiske forbindelser som benzen?
Elektrofil aromatisk substitution
Vores første gæt kunne være, at benzen reagerer med Cl2 for at give et “additions”-produkt som det nedenfor viste (om end langsommere end med en “normal” alken):
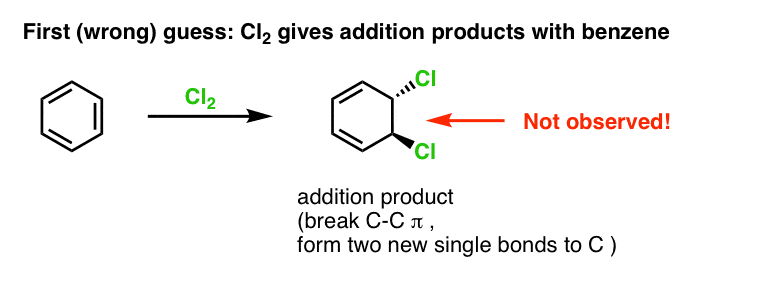
Det er faktisk ikke det produkt, vi observerer!
Hvis man i stedet behandler benzen med Cl2, vil man til sidst (og meget langsomt) opnå følgende produkt: chlorbenzen.
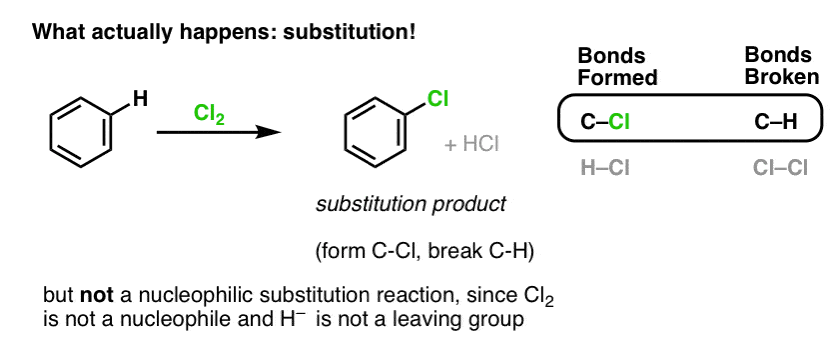
Hvilke bindinger blev dannet og hvilke bindinger blev brudt i denne reaktion?
Vi dannede C-Cl og brød C-H . Da pi-bindingerne alle er intakte, er der ikke tale om en additionsreaktion. I stedet er der derfor tale om en type substitutionsreaktion, hvor vi danner og bryder en binding på et enkelt kulstof.
Vi har set et eksempel på substitutionsreaktioner før, men det var nukleofile substitutioner, hvor en nukleofil (f.eks. RS- ) tilsættes til en alkylhalogenidelektrofil (f.eks. R-Br), hvorved en afgangsgruppe (Br- her) fortrænges og danner en C-Nuc-binding (C-S i dette tilfælde) og bryder en C-LG-binding (C-Br her).
Så er reaktionen af Cl2 med benzen ligeledes en nukleofil substitutionsreaktion? Nej!
Cl2 er en ekstremt dårlig nukleofil, der kun reagerer som elektrondonor med stærke Lewis-syrer (f.eks. AlCl3, nedenfor). Når det kombineres med selv en relativt mild nukleofil, som f.eks. pi-bindingen i en alken, opfører det sig som en elektrofil (elektronacceptor), som vi så i dets reaktion med alkener.
Reaktionen af Cl2 med benzen kaldes således en elektrofil aromatisk substitution (forkortet EAS):
- Elektrofil, fordi vi tilføjer en elektronfattig art (elektrofil),
- til en aromatisk forbindelse (benzen);
- substitution, fordi vi bryder C-H og danner C-E, hvor E er vores elektrofile (Cl i dette tilfælde).
Lewis-syrer fremskynder hastigheden af elektrofile aromatiske substitutionsreaktioner
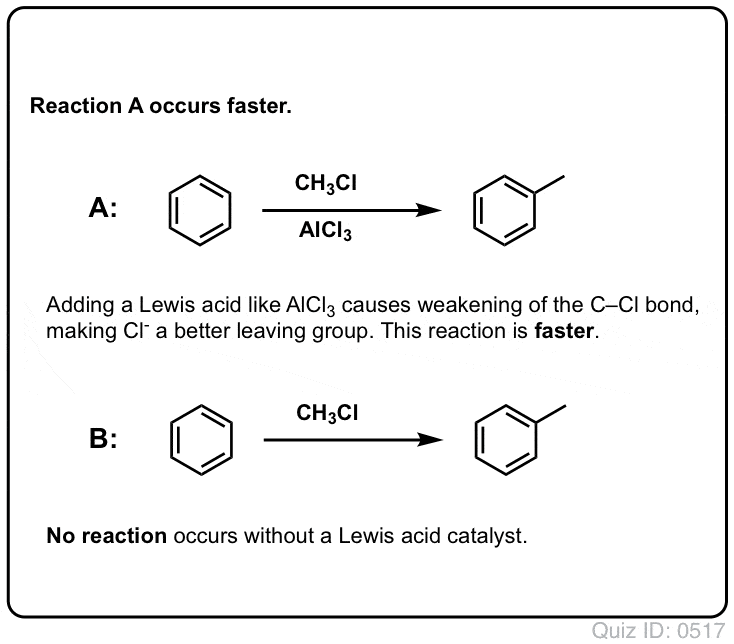
Reaktionen af Cl2 med benzen er hurtigere end tåneglernes vækst, men ikke meget (Den er dog meget hurtigere med mere elektronrige aromater som f.eks. toluen og phenol). Så i stedet for at sidde i laboratoriet i ugevis og vente på, at en reaktion skal afsluttes, kan vi tilføje et reagens, der “opsupper” Cl2’s reaktivitet for at gøre det til en endnu bedre elektrofil: en katalysator, med andre ord.
Tilføjelse af en god Lewis-syre som AlCl3 eller FeCl3 gør tricket. . opdatering: se indlæg om mekanisme
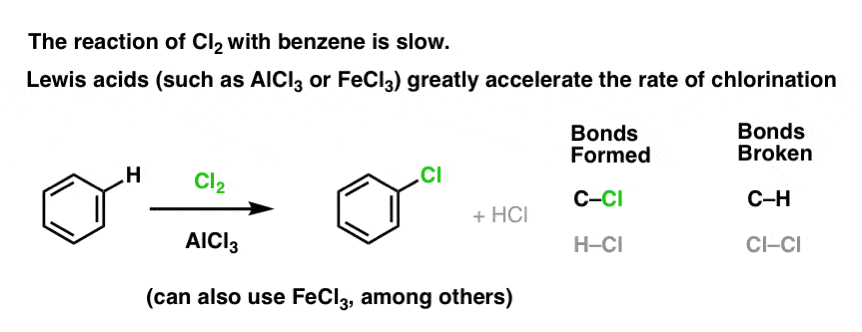
Hvordan virker det?
Fra vores serie om alkoholer husker du måske, at alkoholer (R-OH) kan overtales til at deltage i substitutions- og eliminationsreaktioner, hvis man tilsætter en stærk syre ( danner R-OH2+ ). Det skyldes, at den konjugerede syre altid er en bedre afgangsgruppe ; H2O er en svagere base, og dermed en meget bedre afgangsgruppe, end HO- . Ethanol selv vil aldrig reagere med NaCl for at give ethylchlorid, fordi den resulterende afgangsgruppe HO- er for stærk en base i forhold til Cl- til at reaktionen kan forløbe i nogen grad. Men hvis vi omdanner alkoholen til dens konjugerede syre R-OH2 + med en stærk syre som HCl, kan reaktionen derefter fortsætte, da Cl- fortrænger den meget svagere base H2O.
Det kan være nyttigt at tænke på H+ som en svækkelse af C-O-bindingen, og dermed gøre det tilknyttede kulstof til en bedre elektrofil.
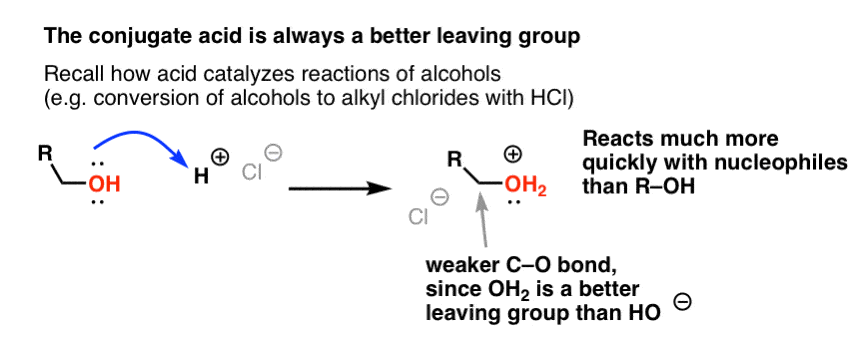
Sådan som syre “primer” det kulstof, der er knyttet til OH-gruppen, til en efterfølgende reaktion ved at omdanne hydroxylgruppen til dens konjugerede syre, virker Lewis-syrer på samme måde den samme magi på Cl2 (og for den sags skyld vil alle de elektrofile aromatiske substitutionsreaktioner, som vi vil dække, involvere en eller anden form for syrekatalyse).
I tilfældet med klorering accepterer Lewis-syren (AlCl3, nedenfor) et par elektroner fra Cl2. Dette svækker Cl-Cl-bindingen og gør den til en endnu bedre nukleofil. Angreb af en nukleofil ved den distale Cl vil frigøre ikke Cl- , men den endnu svagere base (og dermed bedre afgangsgruppe) AlCl4(-).
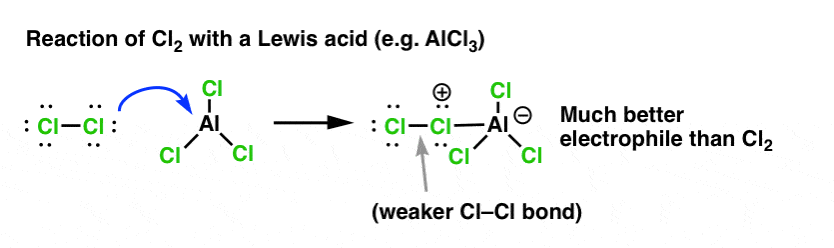
tilsætning af en Lewis-syre (som, husk det, omfatter Brønsted-syrer som H2SO4 ) er en rød tråd i de seks centrale elektrofiliske aromatiske substitutioner, som generelt behandles i introduktionskursus i organisk kemi.
Nøglemønsteret for seks vigtige elektrofile aromatiske substitutionsreaktioner
I dette afsnit vil vi introducere disse seks centrale elektrofile aromatiske substitutionsreaktioner, som fint grupperer sig i tre par:
- chlorering og bromering
- nitrering og sulfonylering
- Friedel-Crafts alkylering og Friedel-Crafts acylering
Vi vil ikke komme ind på mekanismerne endnu. Pointen her er blot at følge, hvilke bindinger der dannes og brydes, så man ser nøglemønstret.
Her er det:
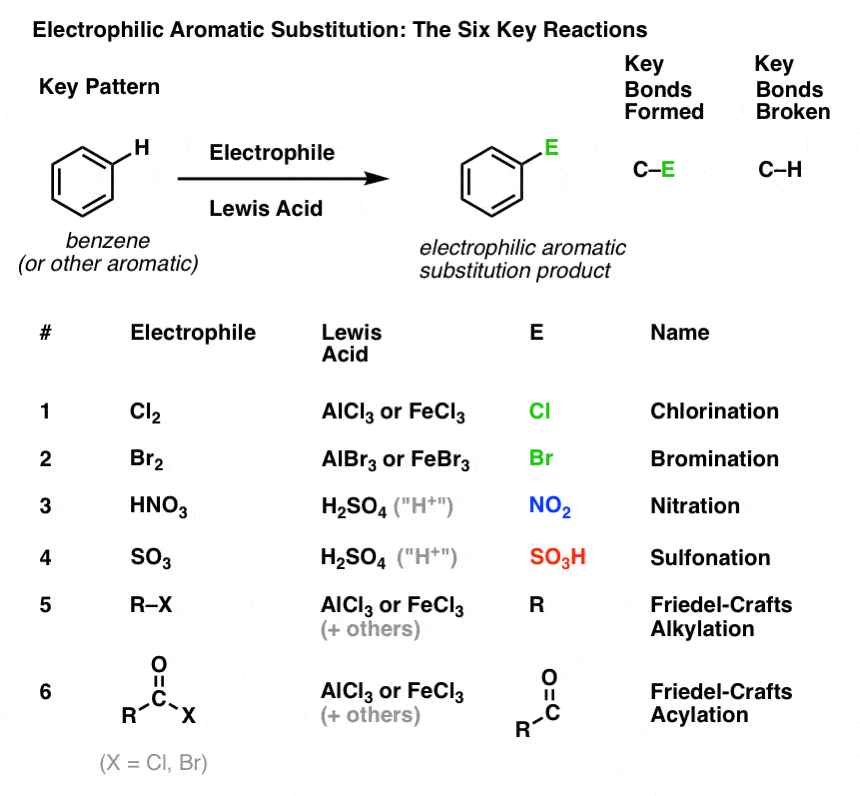

Chlorering og bromering af aromatiske molekyler
Vi har set chlorering (ovenfor); bromering er meget lig det. Da Br2 i sig selv ikke er en stærk nok elektrofil til at reagere med benzen med en rimelig hastighed, bruger vi en Lewis-syre som AlBr3 eller FeBr3 til at fremskynde reaktionen. .
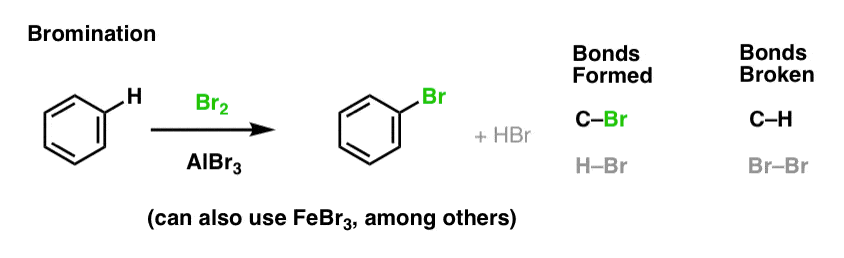
Nitration og sulfonering af aromatiske molekyler
Nitration (udskiftning af H med en NO2-gruppe) er ikke en reaktion, som vi så i vores afsnit om alkener, men det er en populær reaktion med aromatiske molekyler som benzen. Det er den reaktion, hvormed methylbenzen (toluen) omdannes til 2,4,6-trinitrotoluen. Du er sandsynligvis mere bekendt med dette molekyle som det højeksplosive TNT.
Nitration er udskiftning af H med NO2, hvor man bruger salpetersyre (HNO3) som NO2-kilde og svovlsyre (H2SO4) som Lewis-syre:
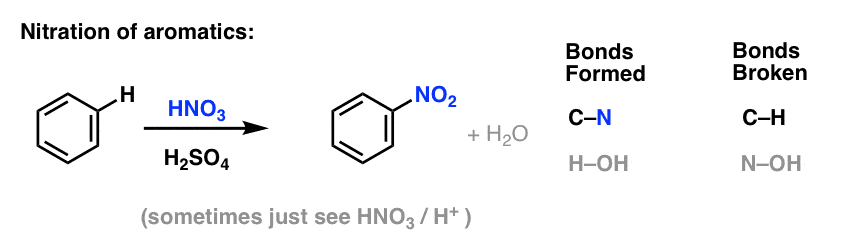
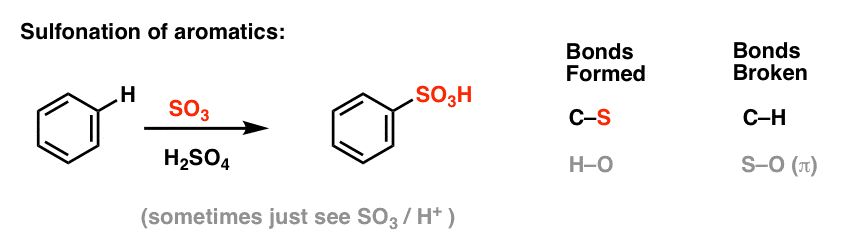
Sulfonering (udskiftning af H med en SO3H-gruppe) viser sig også at være en nyttig reaktion. Den kan udføres ved at tilsætte svovltrioxid (SO3) i tilstedeværelse af svovlsyre (H2SO4) som Lewis-syre:
Friedel-Crafts Alkylering og Acylering
I de fire reaktioner ovenfor observerede vi dannelsen af C-Cl, C-Br, C-N og C-S.
Det er også muligt at danne kulstof-kulstof-bindinger til aromatiske molekyler ved at tilsætte alkyl- eller acylhalogenider i tilstedeværelse af Lewis-syrer. Disse reaktioner er kendt som Friedel-Crafts-reaktioner, efter deres opfindere (reaktionen stammer fra 1877).
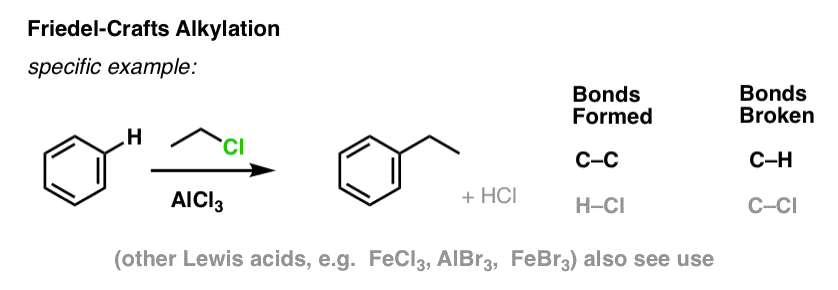
I Friedel-Crafts alkylering starter vi med et alkylhalogenid “R-X” som CH3CH2Cl og tilføjer derefter en Lewis-syre som AlCl3 eller FeCl3 . Som med Cl2 fremskynder Lewis-syren reaktionen ved at koordinere til halogenet, svække C-Cl-bindingen og gøre den til en bedre afgangsgruppe og dermed gøre det muligt for det tilknyttede kulstof at blive lettere angrebet af nukleofile stoffer. Der sker ingen reaktion uden Lewis-syre.
Bemærk, at vi her danner C-C og bryder C-H.
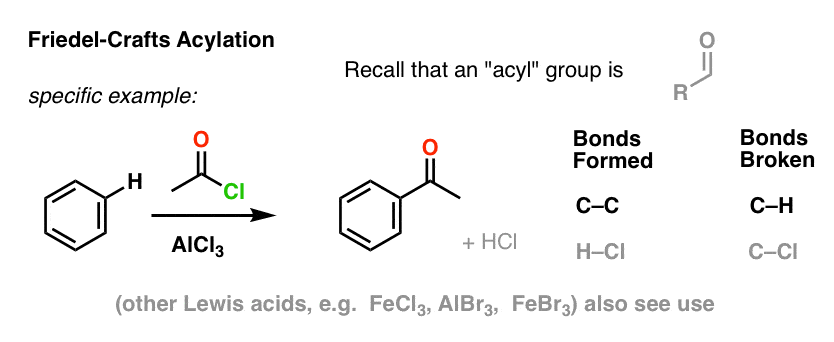
Den Friedel-Crafts Acylering er tilsvarende, men vi starter med et acylhalogenid. Tilsætning af vores Lewis-syre resulterer i dannelse af C-C og brud af C-H.
Summary: The Six Key Electrophilic Aromatic Substitution Reactions
Vi har vist seks vigtige elektrofile aromatiske substitutionsreaktioner (chlorering, bromering, nitrering, sulfonylering og Friedel-Crafts alkylering og acylering), og at de alle involverer brud på C-H og dannelse af C-E (hvor “E” er den pågældende elektrofil).
Men at kende de bindinger, der dannes og brydes, er kun begyndelsen.
Her er nogle spørgsmål, som vi gerne vil have svar på:
- Hvordan påvirker substituenterne på benzen denne reaktion? Hvordan ville disse reaktioner f.eks. blive påvirket, hvis vi udførte dem på methylbenzen? eller phenol? eller chlorbenzen?
- Hvordan påvirker elektrondonorerende eller elektrontrækkende substituenter reaktionshastigheden?
- Med benzen kan der muligvis kun dannes ét mono-substitueret produkt. Men hvad nu hvis vi starter med et mono-substitueret produkt og foretager en elektrofil aromatisk substitution på det? Hvor ender substituenterne?
- Hvordan foregår reaktionen? Hvordan forklarer vi dannelsen af C-E og bruddet af C-H?
- Hvad med andre aromatiske grupper (ud over benzen). Hvordan forholder det sig med elektrofile aromatiske substitutionsreaktioner på pyrrol, pyridin, naftalen eller andre grupper?
I næste indlæg vil vi diskutere det første spørgsmål: virkningen af elektronafgivende og elektrontrækningsgivende substituenter. Vi vil tale om aktiverende og deaktiverende grupper.
Næste indlæg:
Tak for læsning!
Meget stor tak til Matthew Knowe for hjælp til dette indlæg.
Quiz dig selv!
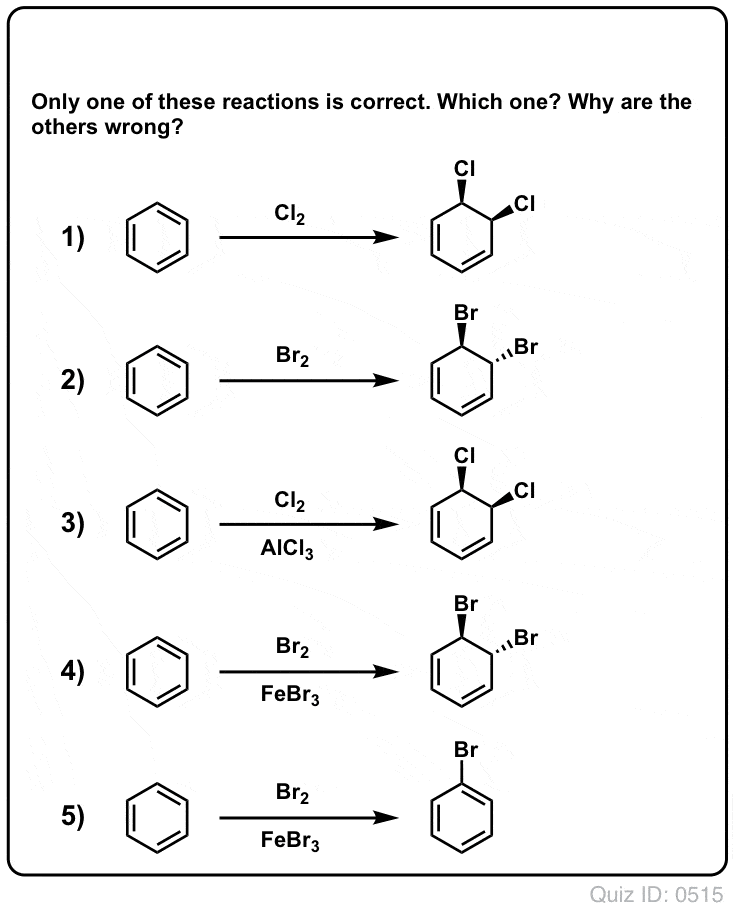 Klik for at vende
Klik for at vende 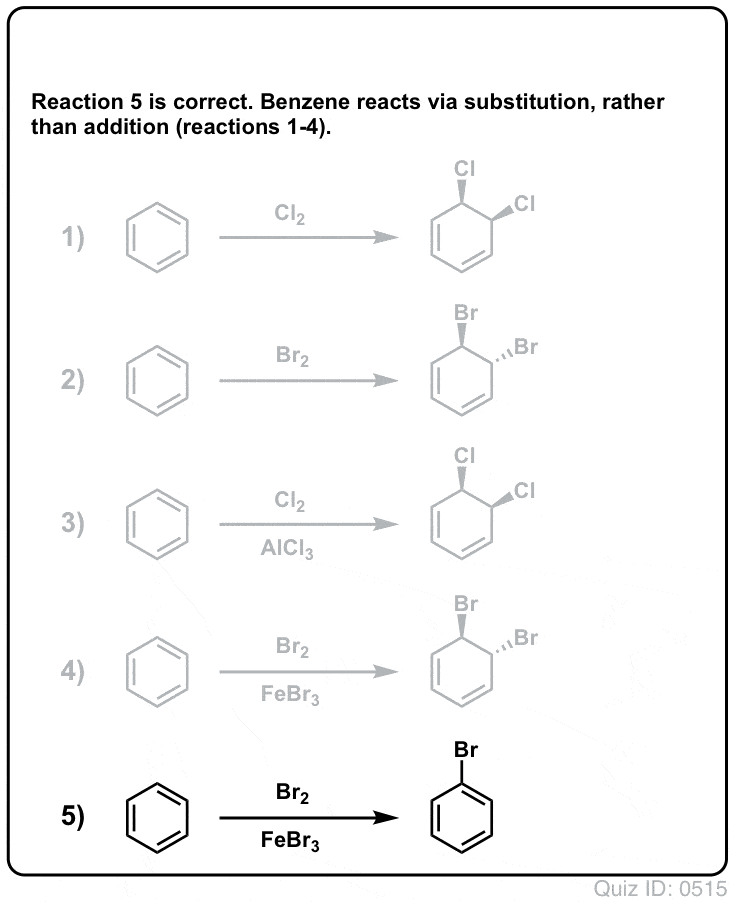
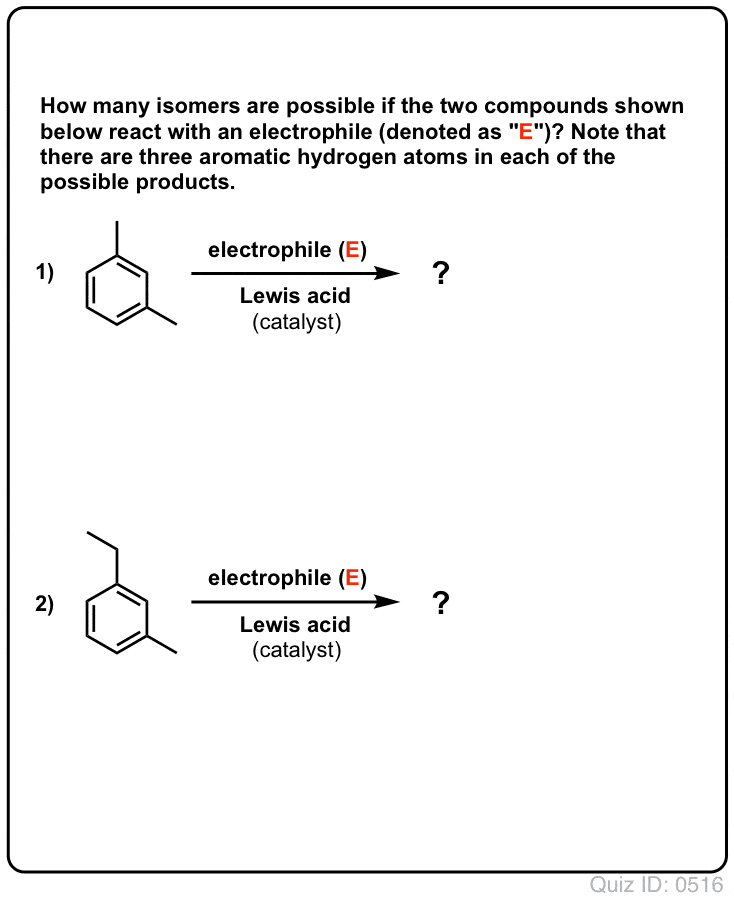 Klik for at vende
Klik for at vende 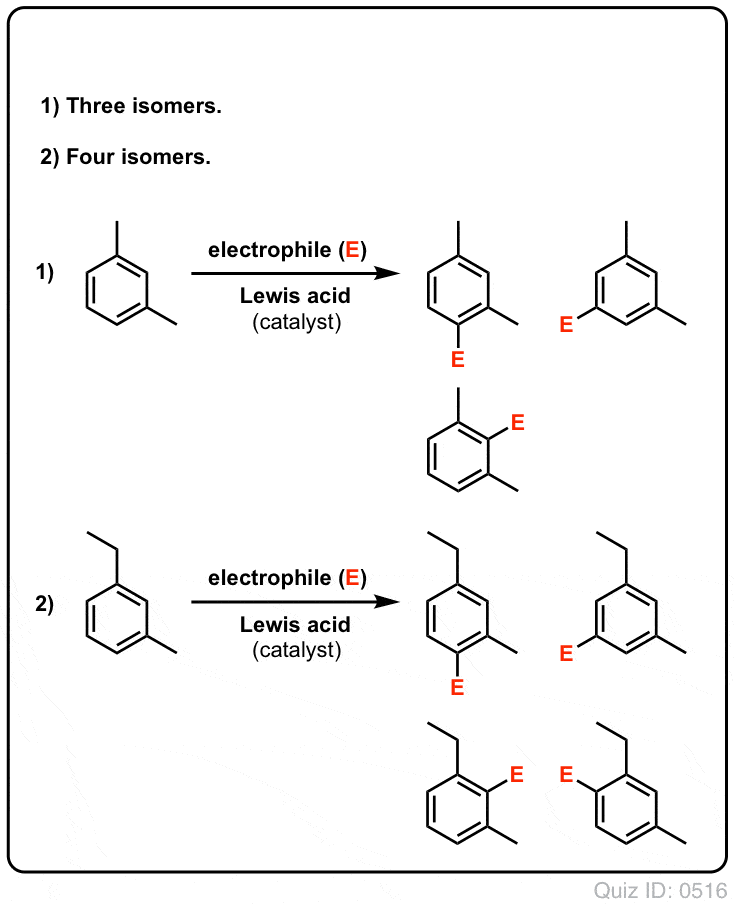
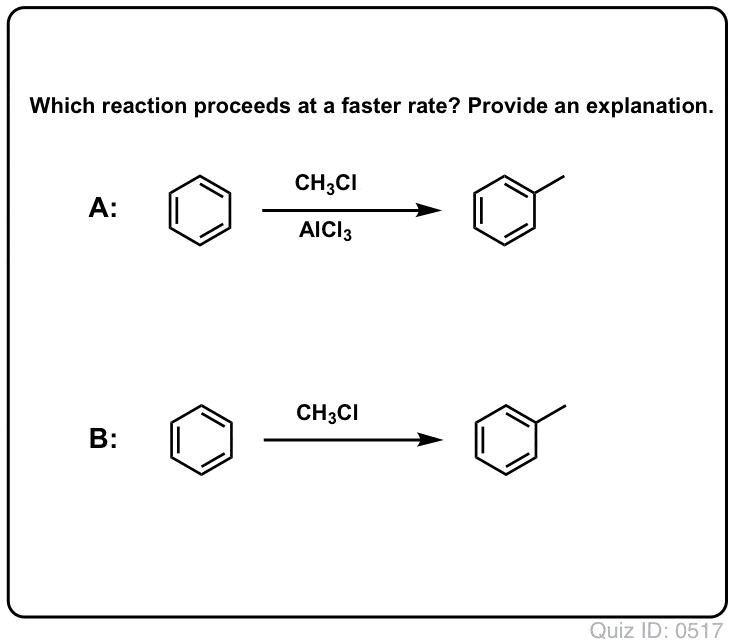 Klik for at vende
Klik for at vende