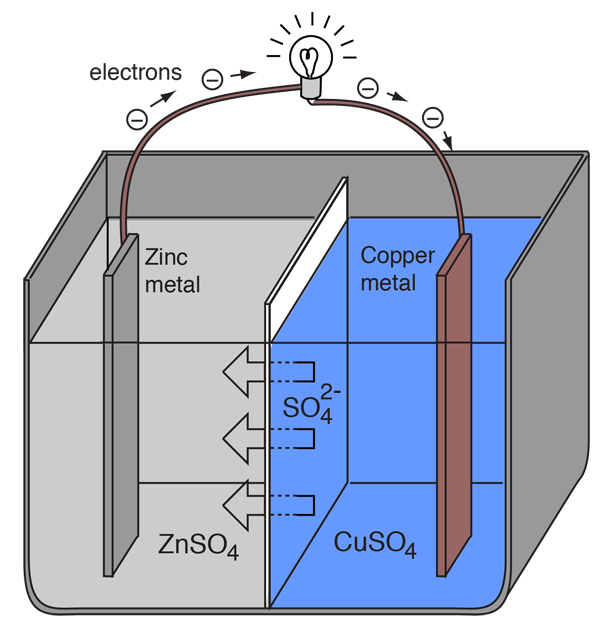
En elektrokemisk celle, der forårsager ekstern elektrisk strøm, kan oprettes ved hjælp af to forskellige metaller, da metaller adskiller sig fra hinanden i deres tendens til at miste elektroner. Zink mister lettere elektroner end kobber, så ved at placere zink- og kobbermetal i opløsninger af deres salte kan man få elektroner til at strømme gennem en ekstern ledning, der fører fra zink til kobber.
Føj annotation til illustration
Da et zinkatom leverer elektronerne, bliver det en positiv ion og går i en vandig opløsning, hvilket mindsker zinkelektrodens masse. På kobbersiden gør de to modtagne elektroner det muligt at omdanne en kobberion fra opløsningen til et uladet kobberatom, som aflejrer sig på kobberelektroden, hvilket øger dens masse. De to reaktioner skrives typisk
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Bogstaverne i parentes er blot en påmindelse om, at zinken går fra et fast stof (s) til en vandopløsning (aq) og omvendt for kobberets vedkommende. Det er typisk i elektrokemiens sprog at betegne disse to processer som “halvreaktioner”, der finder sted ved de to elektroder.
Zn(s) -> Zn2+(aq) + 2e- |
Zink “halvreaktion” klassificeres som oxidation, da det mister elektroner. Den terminal, hvor der sker oxidation, kaldes “anoden”. I et batteri er dette den negative pol. |
|
Kobberets “halvreaktion” klassificeres som reduktion, da det får elektroner. Den terminal, hvor reduktionen finder sted, kaldes “katode”. For et batteri er dette den positive terminal. |
Cu2+(aq) + 2e- -> Cu(s) |
For at voltacellen fortsat kan producere en ekstern elektrisk strøm, skal der ske en bevægelse af sulfat-ionerne i opløsningen fra højre til venstre for at balancere elektronstrømmen i det eksterne kredsløb. Metalionerne selv skal forhindres i at bevæge sig mellem elektroderne, så en eller anden form for porøs membran eller en anden mekanisme skal sørge for en selektiv bevægelse af de negative ioner i elektrolytten fra højre til venstre.
Der kræves energi for at tvinge elektronerne til at bevæge sig fra zink- til kobberelektroden, og den energimængde pr. ladningsenhed, der er til rådighed i voltacellen, kaldes cellens elektromotoriske kraft (emf). Energi pr. ladningsenhed udtrykkes i volt (1 volt = 1 joule/coulomb).
Det er klart, at for at få energi fra cellen skal der frigøres mere energi fra oxidationen af zinken, end der skal bruges til at reducere kobberet. Cellen kan give en begrænset mængde energi fra denne proces, idet processen er begrænset af mængden af tilgængeligt materiale enten i elektrolytten eller i metalelektroderne. Hvis der f.eks. var et mol af sulfationerne SO42- på kobbersiden, er processen begrænset til at overføre to mol elektroner gennem det eksterne kredsløb. Den elektriske ladning, der er indeholdt i et mol elektroner, kaldes Faraday-konstanten og er lig med Avogadros tal gange elektronladningen:
Energiudbyttet fra en voltacelle er givet ved cellens spænding gange antallet af mol elektroner, der overføres, gange Faraday-konstanten.
Elektrisk energiudbytte = nFEcell
Celleemf Ecell kan forudsiges ud fra standardelektrodepotentialerne for de to metaller. For zink/kobber-cellen under standardbetingelserne er det beregnede cellepotentiale 1,1 volt.
| Tørre celler | Blybatterier |