De zes belangrijkste elektrofiele aromatische substitutiereacties
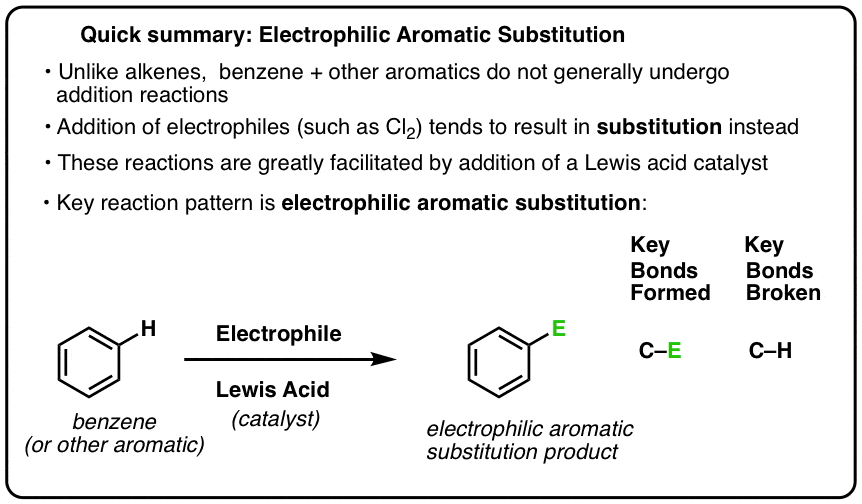
Een belangrijke reactie van aromatische verbindingen is de elektrofiele aromatische substitutie, waarbij een C-H binding wordt verbroken en een nieuwe C-E binding wordt gevormd (E is een elektrofiel atoom zoals Cl, Br, N…).
Inhoudsopgave
- Alkenen geven “additie”-producten bij reactie met elektrofielen. Hoe is Benzeen daarmee te vergelijken?
- Elektrofiele aromatische substitutie
- Lewiszuren versnellen de snelheid van elektrofiele aromatische substitutiereacties
- Het sleutelpatroon voor zes belangrijke elektrofiele aromatische substitutiereacties
- Aromatische chlorering en broommining
- Aromatische nitrering en sulfonering
- Friedel-Crafts Alkylering en Acylering
- Samenvatting: De zes belangrijkste elektrofiele aromatische substitutiereacties
- Quiz Yourself!
- Alkenen geven “additie” producten bij reactie met elektrofielen. Hoe verhoudt zich dat tot benzeen?
- Elektrofiele aromatische substitutie
- Lewis zuren versnellen de snelheid van elektrofiele aromatische substitutiereacties
- Het sleutelpatroon voor zes belangrijke elektrofiele aromatische substitutiereacties
- Chlorering en broomminering van aromatische moleculen
- Nitratie en sulfonering van aromatische moleculen
- Friedel-Crafts Alkylering en Acylering
- Samenvatting: De zes belangrijkste elektrofiele aromatische substitutiereacties
- Quiz Yourself!
Alkenen geven “additie” producten bij reactie met elektrofielen. Hoe verhoudt zich dat tot benzeen?
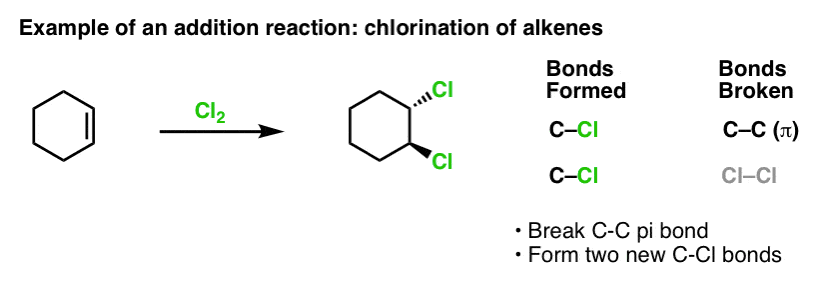
Toen we een tijdje geleden de reacties van alkenen behandelden – een heleboel reacties! – zagen we dat de overgrote meerderheid viel in de klasse van reacties die we additiereacties noemen. Daarin verbreken we een (relatief zwakke) C-C (pi)-binding en vormen we twee nieuwe enkelvoudige bindingen met koolstof. Chlorering van alkenen met Cl2 is een klassiek voorbeeld:
Nu we het toch over benzeen hebben, is het natuurlijk de vraag hoe goed de pi bindingen in aromatische systemen (zoals benzeen) zich verhouden tot de pi bindingen in alkenen, en bij uitbreiding, hoe de reacties van aromatische verbindingen zich verhouden tot de reacties van alkenen.
We hebben gezien dat benzeen een ongewone stabiliteit heeft (36 kcal/mol resonantie-energie) ten opzichte van wat we zouden verwachten voor theoretisch “cyclohexatriene”, wat ons er zeker toe zou brengen te voorspellen dat de pi bindingen in aromatische moleculen minder reactief zullen zijn, ten opzichte van alkenen.
Je zou je ook kunnen herinneren dat benzeen zelf ongewoon moeilijk te hydrogeneren is. Waterstof (H2) kan aan de meeste alkenen worden toegevoegd in aanwezigheid van een katalytische hoeveelheid fijn verdeeld palladium op koolstof (Pd/C), maar je moet echt het blikje Whup-Ass® van het merk Aldrich openmaken (d.w.z. hoge temperaturen, hoge drukken van H2 , langere reactietijden) om met succes H2 aan benzeen toe te voegen, in vergelijking met “typische” alkenen.
Dit wetende, hoe kunnen we verwachten dat elektrofielen zoals Cl2 of Br2 reageren met aromatische verbindingen zoals benzeen?
Elektrofiele aromatische substitutie
Ons eerste vermoeden zou kunnen zijn dat benzeen met Cl2 reageert tot een “additie”-product zoals hieronder afgebeeld (zij het langzamer dan met een “normaal” alkeen):
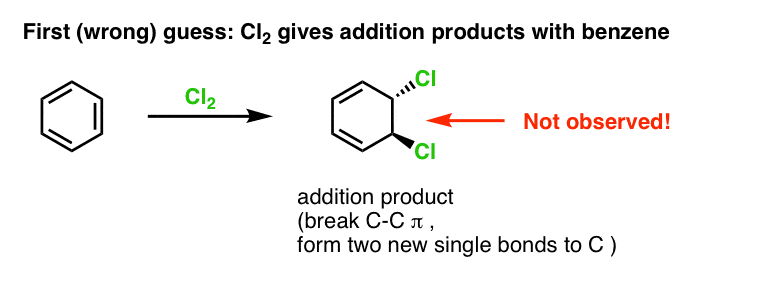
Dat is eigenlijk niet het product dat we waarnemen!
In plaats daarvan krijg je bij de behandeling van benzeen met Cl2 uiteindelijk (en heel langzaam) het volgende product: chloorbenzeen.
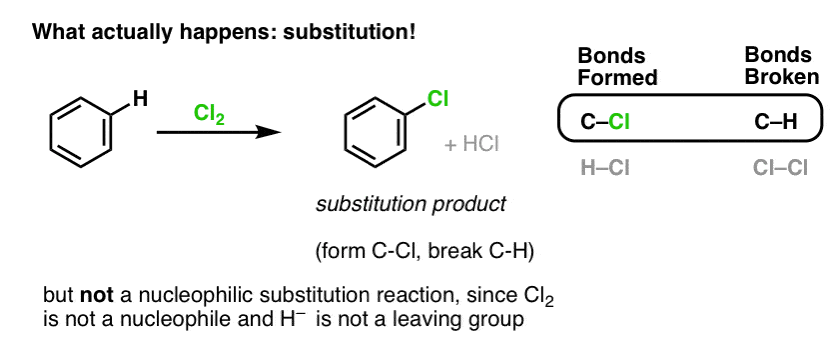
Welke bindingen zijn er bij deze reactie gevormd en welke bindingen zijn er gebroken?
We hebben C-Cl gevormd en C-H gebroken. Omdat de pi bindingen allemaal intact zijn, is dit geen additiereactie. In plaats daarvan is dit dus een soort substitutiereactie, waarbij we een binding vormen en verbreken op een enkele koolstof.
We hebben al eerder een voorbeeld van substitutiereacties gezien, maar dat waren nucleofiele substituties, waarbij een nucleofiel (bijv. RS- ) wordt toegevoegd aan een alkylhalogenide-elektrofiel (b.v. R-Br), waarbij een vertrekkende groep (Br- hier) wordt verdrongen en een C-Nuc binding wordt gevormd (C-S in dit geval) en een C-LG binding wordt verbroken (C-Br hier).
Dus is de reactie van Cl2 met benzeen ook een nucleofiele substitutiereactie? Nee!
Cl2 is een uiterst slecht nucleofiel, dat alleen reageert als elektron-donor met sterke Lewiszuren (b.v. AlCl3, hieronder). In combinatie met zelfs een relatief mild nucleofiel, zoals de pi-bond in een alkeen, gedraagt het zich als een elektrofiel (elektronenacceptor), zoals we zagen in zijn reactie met alkenen.
De reactie van Cl2 met benzeen wordt dus een elektrofiele aromatische substitutie (afgekort EAS) genoemd:
- Elektrofiele, omdat we een elektron-arme soort (elektrofiel) toevoegen,
- aan een aromatische verbinding (benzeen);
- substitutie, omdat we C-H breken en C-E vormen, waarbij E ons elektrofiel is (Cl in dit geval).
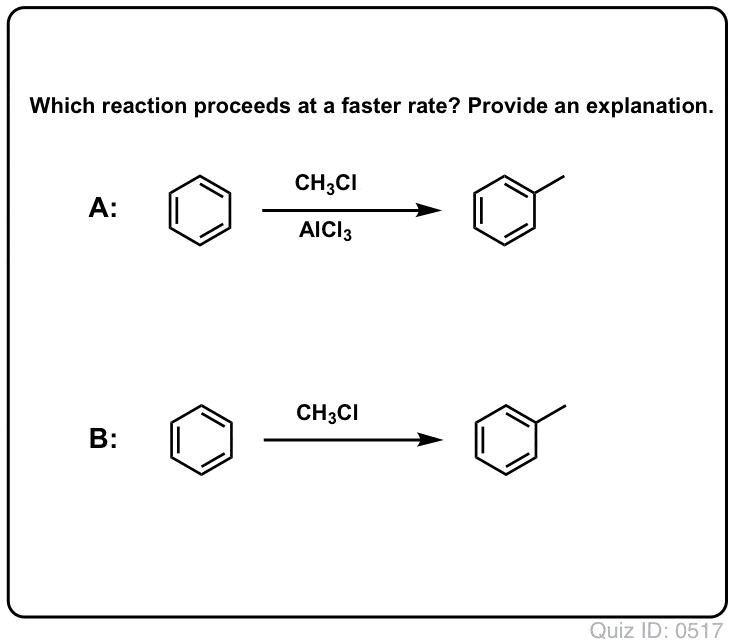
Lewis zuren versnellen de snelheid van elektrofiele aromatische substitutiereacties
De reactie van Cl2 met benzeen is sneller dan de groei van teennagels, maar niet veel (Het is echter veel sneller met meer elektron-rijke aromaten zoals tolueen en fenol). Dus in plaats van weken in het lab te zitten wachten tot een reactie is afgelopen, kunnen we een reagens toevoegen dat de reactiviteit van Cl2 “verzacht” om er een nog beter elektrofiel van te maken: een katalysator, met andere woorden.
Een goed Lewiszuur zoals AlCl3 of FeCl3 toevoegen doet de truc.
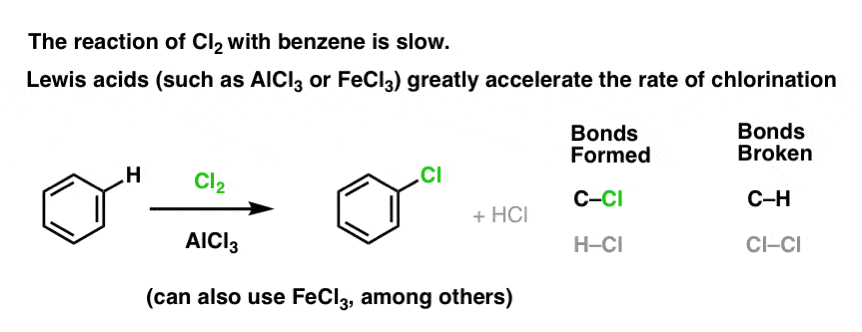
Hoe werkt dit?
U herinnert zich misschien uit onze serie over alcoholen dat alcoholen (R-OH) kunnen worden overgehaald om deel te nemen aan substitutie- en eliminatiereacties als een sterk zuur wordt toegevoegd (waarbij R-OH2+ wordt gevormd). Dat komt omdat het geconjugeerde zuur altijd een betere groep is om te vertrekken ; H2O is een zwakkere base, en dus een veel betere groep om te vertrekken, dan HO- . Ethanol zelf zal nooit reageren met NaCl om ethylchloride te geven, omdat de resulterende groep HO- een te sterke base is ten opzichte van Cl- om de reactie te laten verlopen. Maar als we de alcohol omzetten in zijn conjugaatzuur R-OH2+ met een sterk zuur zoals HCl, dan kan de reactie wel doorgaan, omdat Cl- de veel zwakkere base H2O verdringt.
H+ kan nuttig zijn om te denken dat het de C-O binding verzwakt, waardoor de koolstof die eraan vastzit een beter elektrofiel wordt.
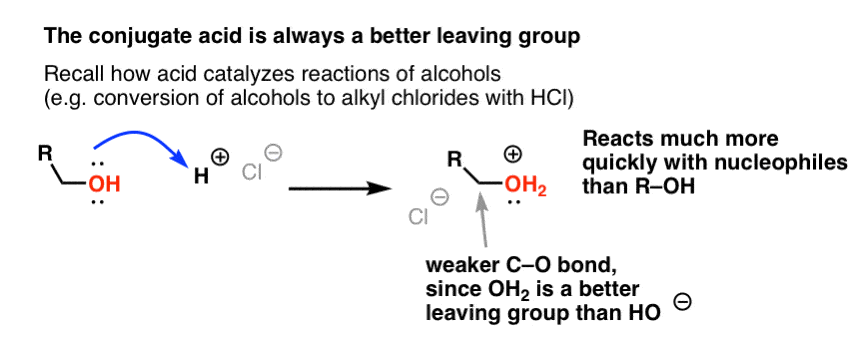
Net zoals zuren de koolstof die aan de OH-groep zit “klaarmaken” voor een volgende reactie door de hydroxylgroep om te zetten in zijn conjugaatzuur, zo werken Lewiszuren op dezelfde manier op Cl2 (en trouwens, bij alle elektrofiele aromatische substitutiereacties die we zullen behandelen, zal een of andere vorm van zuurkatalyse betrokken zijn).
In het geval van chlorering accepteert het Lewiszuur (AlCl3, hieronder) een elektronenpaar van Cl2. Dit verzwakt de Cl-Cl binding, waardoor het een nog beter nucleofiel wordt. Aanval van een nucleofiel op de distale Cl maakt niet Cl- vrij, maar de nog zwakkere base (en dus betere vertrekgroep) AlCl4(-).
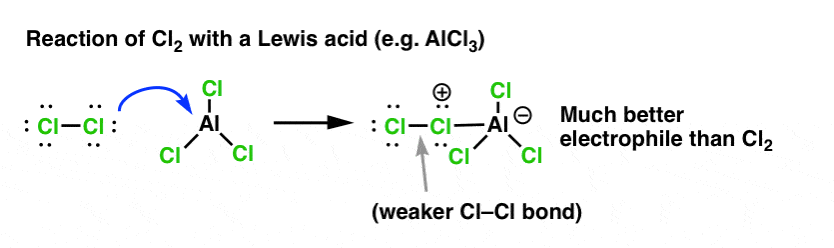
Toevoeging van een Lewiszuur (waaronder, ter herinnering, ook Brønsted zuren als H2SO4 vallen) is een rode draad in de zes belangrijkste elektrofiele aromatische substituties die in de inleidende organische chemie algemeen worden behandeld.
Het sleutelpatroon voor zes belangrijke elektrofiele aromatische substitutiereacties
In dit deel zullen we deze zes belangrijke elektrofiele aromatische substitutiereacties introduceren, die mooi in drie paren zijn gegroepeerd:
- chlorering en bromering
- nitrering en sulfonylering
- Friedel-Crafts alkylering en Friedel-Crafts acylering
We gaan nu nog niet in op de mechanismen. Het gaat er hier alleen om te volgen welke bindingen gevormd en verbroken worden, zodat je het belangrijkste patroon ziet.
Hier is het:
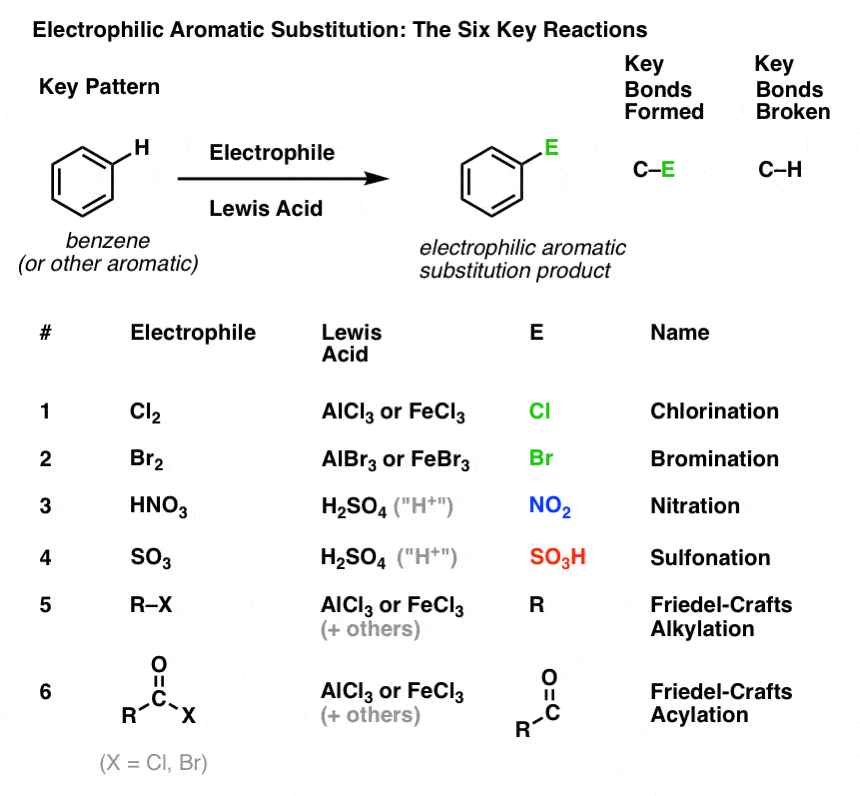
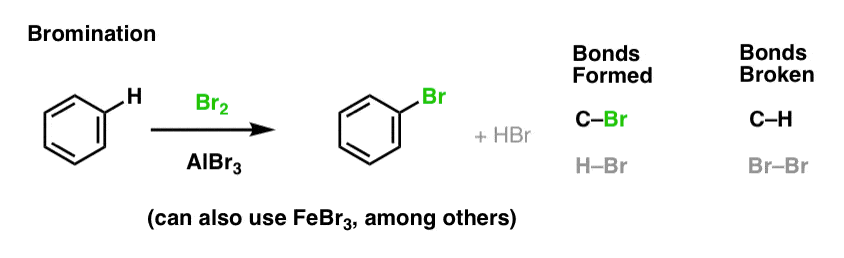
Chlorering en broomminering van aromatische moleculen
We hebben chlorering gezien (hierboven); broomminering lijkt er sterk op. Aangezien Br2 op zichzelf geen sterk genoeg elektrofiel is om met een redelijke snelheid met benzeen te reageren, gebruiken we een Lewiszuur zoals AlBr3 of FeBr3 om de reactie te versnellen.
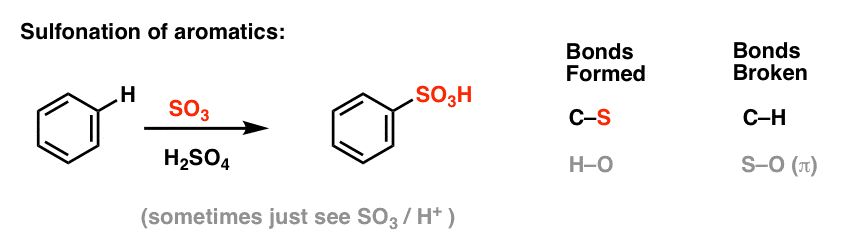
Nitratie en sulfonering van aromatische moleculen
Nitratie (vervanging van H door een NO2-groep) is geen reactie die we in ons hoofdstuk over alkenen hebben gezien, maar het is een populaire reactie met aromatische moleculen zoals benzeen. Dit is de reactie waarbij methylbenzeen (tolueen) wordt omgezet in 2,4,6-trinitrotolueen. U bent waarschijnlijk meer bekend met dit molecuul als het hoge explosief TNT.
Nitratie is de vervanging van H door NO2, waarbij salpeterzuur (HNO3) als bron van NO2 wordt gebruikt en zwavelzuur (H2SO4) als Lewiszuur:
Sulfonering (vervanging van H door een SO3H-groep) blijkt ook een nuttige reactie te zijn. Deze kan worden uitgevoerd door zwaveltrioxide (SO3) toe te voegen in aanwezigheid van zwavelzuur (H2SO4) als Lewiszuur:
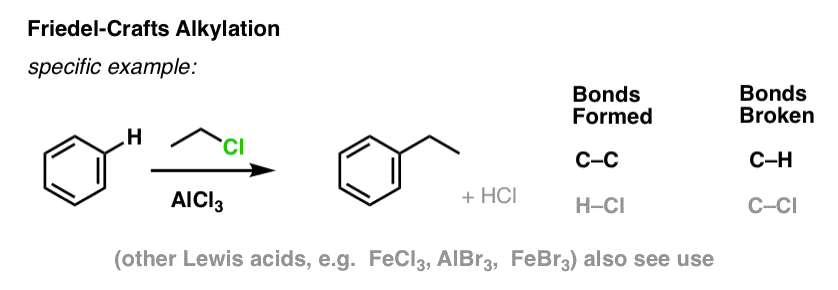
Friedel-Crafts Alkylering en Acylering
In de vier bovenstaande reacties hebben we de vorming van C-Cl, C-Br, C-N en C-S waargenomen.
Het is ook mogelijk om koolstof-koolstofbindingen te vormen aan aromatische moleculen door alkyl- of acylhalogeniden toe te voegen in de aanwezigheid van Lewiszuren. Deze reacties staan bekend als Friedel-Crafts-reacties, naar hun uitvinders (de reactie stamt uit 1877).
In Friedel-Crafts Alkylering beginnen we met een alkylhalogenide “R-X” zoals CH3CH2Cl en voegen dan een Lewiszuur toe zoals AlCl3 of FeCl3 . Net als bij Cl2 versnelt het Lewiszuur de reactie door te coördineren met het halogeen, waardoor de C-Cl binding verzwakt, en het een betere groep wordt die de verbinding verlaat, zodat de aangehechte koolstof gemakkelijker door nucleofielen kan worden aangevallen. Zonder het Lewiszuur vindt geen reactie plaats.
Merk op dat we hier C-C vormen en C-H verbreken.
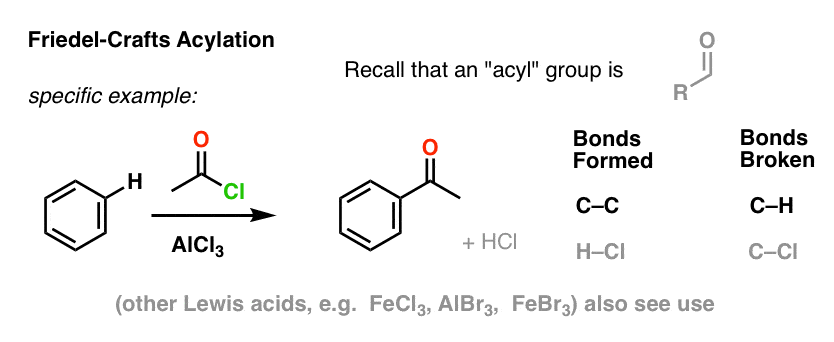
De Friedel-Crafts Acylering is vergelijkbaar, maar we beginnen met een acylhalogenide. Toevoeging van ons Lewiszuur leidt tot de vorming van C-C en de breuk van C-H.
Samenvatting: De zes belangrijkste elektrofiele aromatische substitutiereacties
We hebben zes belangrijke elektrofiele aromatische substitutiereacties laten zien (chlorering, brominering, nitrering, sulfonylering, en de Friedel-Crafts alkylering en acylering) en dat ze allemaal gepaard gaan met de afbraak van C-H en de vorming van C-E (waarbij “E” het elektrofile in kwestie is).
Maar weten welke bindingen worden gevormd en verbroken is nog maar het begin.
Hier zijn enkele vragen waarop we graag het antwoord zouden willen weten:
- Welke invloed hebben de substituenten op benzeen op deze reactie? Hoe zouden deze reacties bijvoorbeeld verlopen als we ze zouden uitvoeren op methylbenzeen? of fenol? of chloorbenzeen?
- Hoe beïnvloeden elektron-donerende of elektron-onttrekkende substituenten de snelheid van de reactie?
- Met benzeen kan mogelijk slechts één mono-gesubstitueerd product worden gevormd. Maar wat als we beginnen met een mono-substitueerd product en daar een elektrofiele aromatische substitutie op uitvoeren? Waar komen de substituenten terecht?
- Hoe gaat de reactie in zijn werk? Hoe verklaren we de vorming van C-E en de breuk van C-H?
- Hoe zit het met andere aromatische groepen (dan benzeen). Hoe verhouden zich elektrofiele aromatische substitutiereacties op pyrrol, pyridine, naftaleen, of andere groepen?
In het volgende bericht zullen we de eerste vraag bespreken: het effect van elektron-donerende en elektron-onttrekkende substituenten. We zullen het hebben over activerende en deactiverende groepen.
Volgende post: Activerende en Desactiverende Groepen
Dank voor het lezen!
Met dank aan Matthew Knowe voor hulp bij dit artikel.
Quiz Yourself!
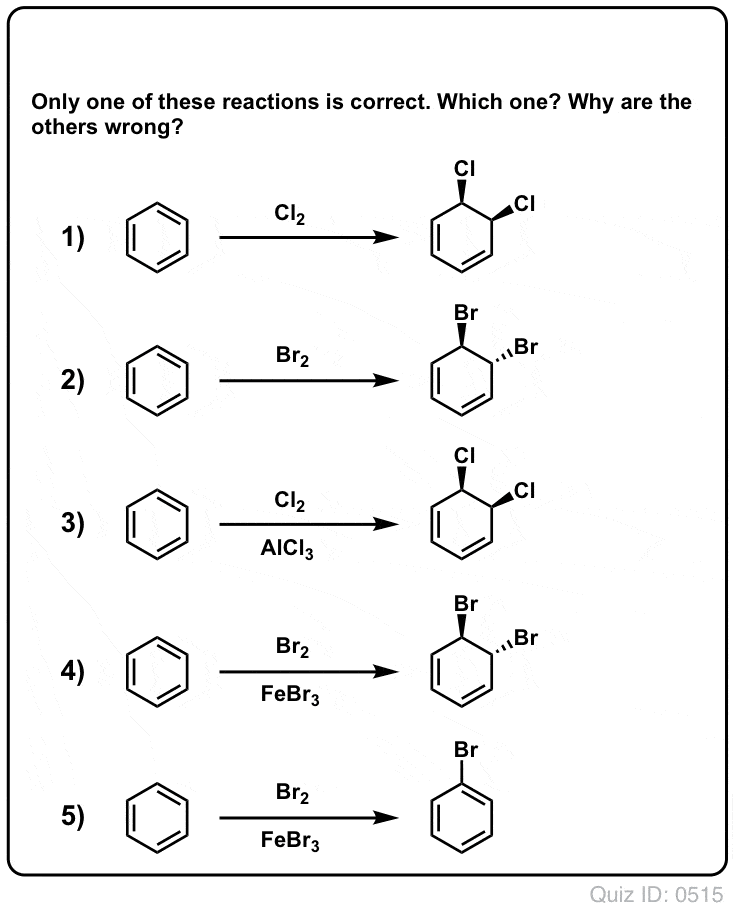 Klik om te flippen
Klik om te flippen 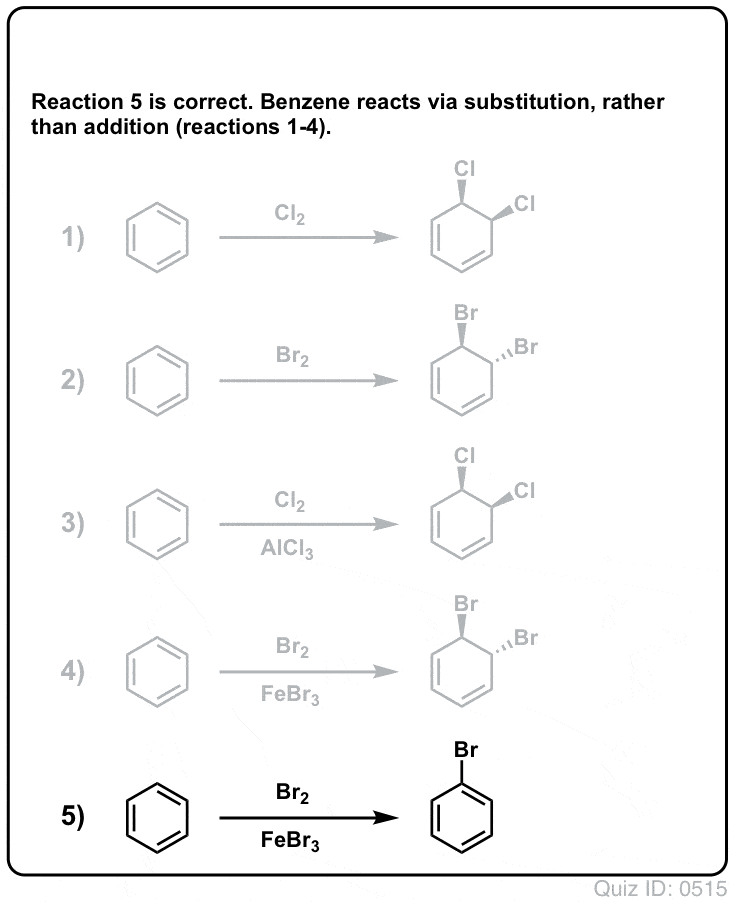
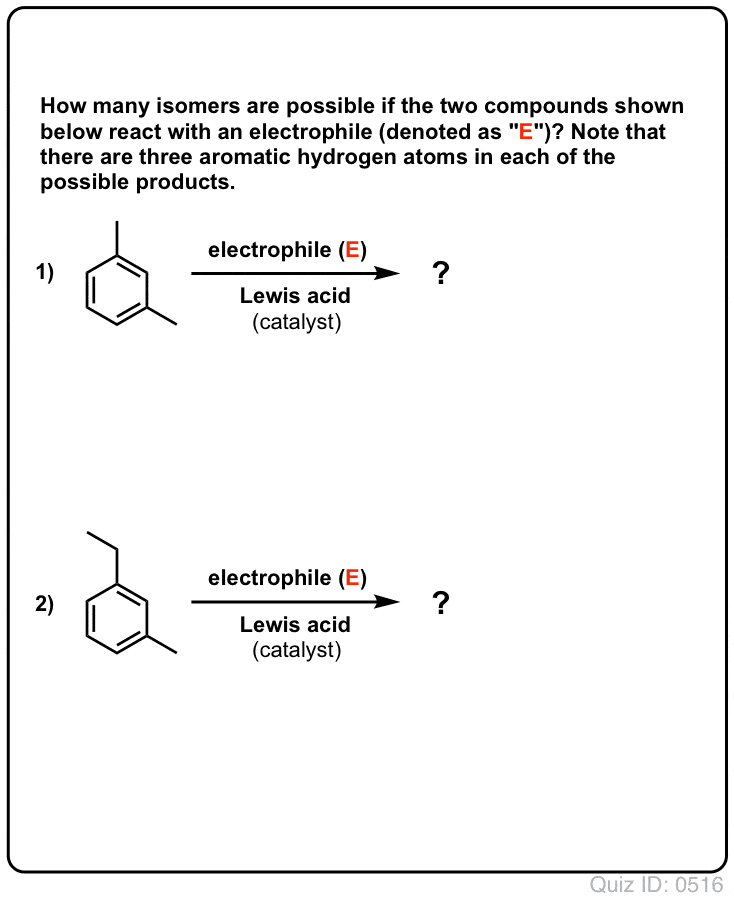 Klik om te flippen
Klik om te flippen 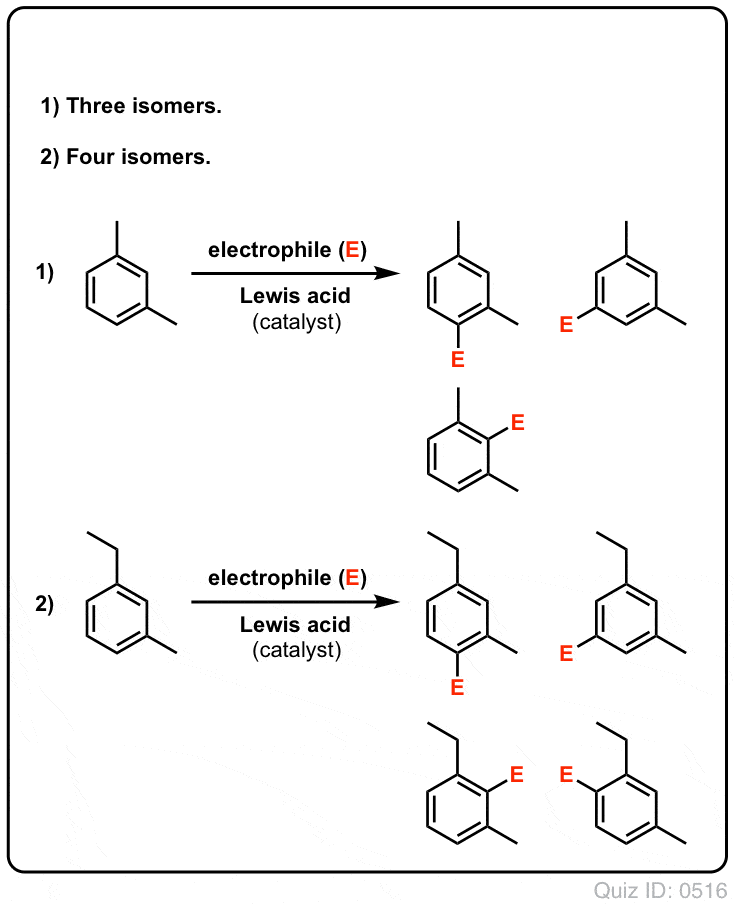
 Klik om te flippen
Klik om te flippen 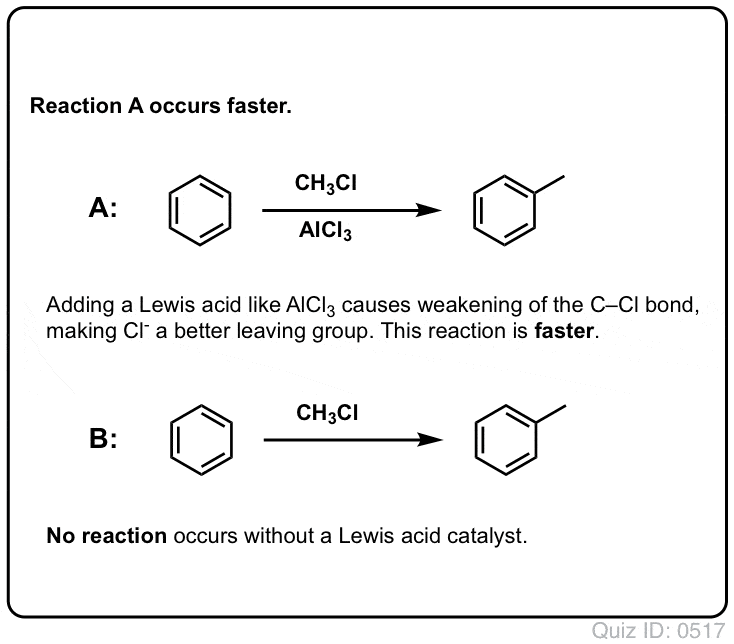
>