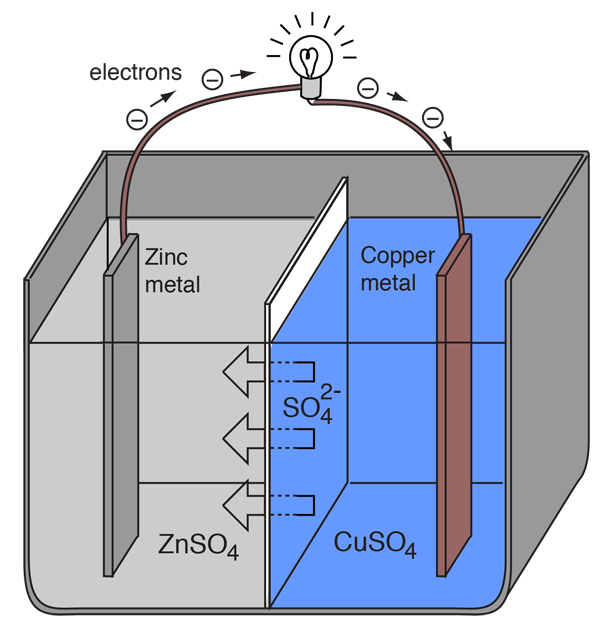
Uma célula eletroquímica que causa o fluxo externo de corrente elétrica pode ser criada usando dois metais diferentes, uma vez que os metais diferem na sua tendência de perder elétrons. O zinco perde mais facilmente electrões do que o cobre, pelo que a colocação de zinco e cobre metálico em soluções dos seus sais pode causar o fluxo de electrões através de um fio externo que conduz do zinco para o cobre.
Adicionar anotação à ilustração
Como um átomo de zinco fornece os elétrons, ele se torna um íon positivo e entra em solução aquosa, diminuindo a massa do eletrodo de zinco. No lado do cobre, os dois elétrons recebidos permitem converter um íon de cobre da solução em um átomo de cobre não carregado que se deposita no eletrodo de cobre, aumentando a sua massa. As duas reacções são tipicamente escritas
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
As letras entre parênteses são apenas lembretes de que o zinco vai de um sólido (s) para uma solução de água (aq) e vice-versa para o cobre. É típico na linguagem da electroquímica referir-se a estes dois processos como “semi-reacções” que ocorrem nos dois eléctrodos.
Zn(s) -> Zn2+(aq) + 2e- |
O zinco “semi-reacções” é classificado como oxidação uma vez que perde electrões. O terminal no qual ocorre a oxidação é chamado de “ânodo”. Para uma bateria, este é o terminal negativo. |
|
A “meia-reacção” de cobre é classificada como redução, uma vez que ganha electrões. O terminal em que ocorre a redução é chamado de “cátodo”. Para uma bateria, este é o terminal positivo. |
Cu2+(aq) + 2e- -> Cu(s) |
Para que a célula voltaica continue a produzir uma corrente eléctrica externa, deve haver um movimento dos iões sulfato em solução da direita para a esquerda para equilibrar o fluxo de electrões no circuito externo. Os íons metálicos em si devem ser impedidos de se mover entre os eletrodos, portanto algum tipo de membrana porosa ou outro mecanismo deve prever o movimento seletivo dos íons negativos no eletrólito da direita para a esquerda.
Energia é necessária para forçar os elétrons a se moverem do zinco para o eletrodo de cobre, e a quantidade de energia por unidade de carga disponível da célula voltaica é chamada de força eletromotiva (emf) da célula. A energia por unidade de carga é expressa em volts (1 volt = 1 joule/coulomb).
Claramente, para obter energia da célula, é necessário obter mais energia libertada da oxidação do zinco do que é necessário para reduzir o cobre. A célula pode obter uma quantidade finita de energia deste processo, sendo o processo limitado pela quantidade de material disponível quer no electrólito quer nos eléctrodos metálicos. Por exemplo, se houvesse uma toupeira dos íons sulfato SO42- no lado do cobre, então o processo é limitado a transferir dois moles de elétrons através do circuito externo. A quantidade de carga elétrica contida em uma molécula de elétrons é chamada constante de Faraday, e é igual ao número de vezes que a carga de elétrons da Avogadro:
O rendimento energético de uma célula voltaica é dado pela voltagem da célula vezes o número de moles de electrões transferidos vezes a constante de Faraday.
Electrical energy output = nFEcell
A célula emf Ecell pode ser prevista a partir dos potenciais de eléctrodos padrão para os dois metais. Para a célula de zinco/cobre sob as condições padrão, o potencial da célula calculado é de 1,1 volts.
| Células secas | Bateria de chumbo-ácido |