Popis struktury a funkce proteinů
Proteiny jsou polymery aminokyselin. Každá aminokyselina obsahuje centrální uhlík, vodík, karboxylovou skupinu, aminoskupinu a proměnnou R skupinu. Skupina R určuje, do které třídy aminokyselin patří: elektricky nabité hydrofilní postranní řetězce, polární, ale nenabité postranní řetězce, nepolární hydrofobní postranní řetězce a zvláštní případy.
Proteiny mají různé „vrstvy“ struktury: primární, sekundární, terciární, kvartérní.
Proteiny mají v buňkách různé funkce. Mezi hlavní funkce patří působení jako enzymy, receptory, transportní molekuly, regulační proteiny pro genovou expresi atd. Enzymy jsou biologické katalyzátory, které urychlují chemickou reakci, aniž by se trvale změnila. Mají „aktivní místa“, na která se váže substrát/reaktant, a mohou být buď aktivovány, nebo inhibovány (kompetitivní a/nebo nekompetitivní inhibitory).
Cíle výuky
- Demonstrovat znalost monomerních jednotek proteinů: Aminokyseliny
- Definice různých vrstev struktury bílkovin
- Identifikace několika hlavních funkcí bílkovin
Aminokyseliny
Bílkoviny jsou jedny z nejrozšířenějších organických molekul v živých systémech a mají nejrozmanitější škálu funkcí ze všech makromolekul. Bílkoviny mohou být strukturní, regulační, kontraktilní nebo ochranné, mohou sloužit v transportu, skladování nebo membránách, mohou být toxiny nebo enzymy. Každá buňka v živém systému může obsahovat tisíce proteinů, z nichž každý má jedinečnou funkci. Jejich struktura se stejně jako jejich funkce značně liší. Všechny jsou však polymery aminokyselin uspořádaných v lineárním sledu.

Obrázek 1. Bílkoviny. Aminokyseliny mají centrální asymetrický uhlík, na který je navázána aminoskupina, karboxylová skupina, atom vodíku a postranní řetězec (skupina R).
Aminokyseliny jsou monomery, které tvoří bílkoviny. Každá aminokyselina má stejnou základní strukturu, která se skládá z centrálního atomu uhlíku, známého také jako uhlík alfa (α), vázaného na aminoskupinu (NH2), karboxylovou skupinu (COOH) a na atom vodíku. Každá aminokyselina má také další atom nebo skupinu atomů vázaných na centrální atom známý jako skupina R (obrázek 1).
Název „aminokyselina“ je odvozen od skutečnosti, že ve své základní struktuře obsahují jak aminoskupinu, tak karboxylovou skupinu. Jak již bylo uvedeno, v bílkovinách je přítomno 20 aminokyselin. Deset z nich je u člověka považováno za esenciální aminokyseliny, protože si je lidské tělo nedokáže vyrobit a získává je ze stravy.
U každé aminokyseliny je skupina R (neboli postranní řetězec) jiná (obrázek 2).
Praktická otázka

Obrázek 2. Aminokyseliny, které jsou pro člověka esenciální? V bílkovinách se běžně vyskytuje 20 běžných aminokyselin, z nichž každá má jinou R skupinu (variantní skupinu), která určuje její chemickou povahu.
Které kategorie aminokyselin byste očekávali na povrchu rozpustné bílkoviny a které byste očekávali uvnitř? Jaké rozložení aminokyselin byste očekávali u bílkoviny zabudované v lipidové dvojvrstvě?
Chemická povaha postranního řetězce určuje povahu aminokyseliny (tj. zda je kyselá, zásaditá, polární nebo nepolární). Například aminokyselina glycin má jako R skupinu atom vodíku. Aminokyseliny jako valin, metionin a alanin jsou nepolární nebo hydrofobní povahy, zatímco aminokyseliny jako serin, treonin a cystein jsou polární a mají hydrofilní postranní řetězce. Postranní řetězce lysinu a argininu jsou kladně nabité, a proto se tyto aminokyseliny označují také jako bazické aminokyseliny. Prolin má R skupinu, která je spojena s aminoskupinou a tvoří prstencovou strukturu. Prolin je výjimkou ze standardní struktury animokyseliny, protože jeho aminoskupina není oddělena od postranního řetězce (obrázek 2).
Aminokyseliny se označují jedním velkým písmenem nebo třípísmennou zkratkou. Například valin je znám pod písmenem V nebo třípísmennou zkratkou val. Stejně jako jsou pro stravu nezbytné některé mastné kyseliny, jsou nezbytné i některé aminokyseliny. Označují se jako esenciální aminokyseliny a u člověka mezi ně patří izoleucin, leucin a cystein. Jako esenciální aminokyseliny se označují ty, které jsou nezbytné pro stavbu bílkovin v těle, i když si je tělo samo nevytváří; to, které aminokyseliny jsou esenciální, se liší organismus od organismu.

Obrázek 3: Esenciální aminokyseliny. Tvorba peptidové vazby je dehydratační syntézní reakcí. Karboxylová skupina jedné aminokyseliny je spojena s aminoskupinou vstupní aminokyseliny. Při tomto procesu se uvolňuje molekula vody.
Sekvence a počet aminokyselin nakonec určují tvar, velikost a funkci bílkoviny. Každá aminokyselina je připojena k jiné aminokyselině kovalentní vazbou, známou jako peptidová vazba, která vzniká dehydratační reakcí. Karboxylová skupina jedné aminokyseliny a aminoskupina příchozí aminokyseliny se spojí a uvolní se molekula vody. Vzniklá vazba je peptidová vazba (obrázek 3).
Produkty vzniklé takovými vazbami se nazývají peptidy. Když se k tomuto rostoucímu řetězci připojí další aminokyseliny, výsledný řetězec se nazývá polypeptid. Každý polypeptid má na jednom konci volnou aminoskupinu. Tento konec se nazývá N terminál neboli aminoterminál a druhý konec má volnou karboxylovou skupinu, známou také jako C nebo karboxylový terminál. Ačkoli se termíny polypeptid a protein někdy používají zaměnitelně, polypeptid je technicky vzato polymer aminokyselin, zatímco termín protein se používá pro polypeptid nebo polypeptidy, které se spolu spojily, často mají navázané nepeptidové prostetické skupiny, mají odlišný tvar a jedinečnou funkci. Po syntéze bílkovin (translaci) je většina bílkovin modifikována. Tyto modifikace se označují jako posttranslační modifikace. Mohou projít štěpením, fosforylací nebo mohou vyžadovat přidání dalších chemických skupin. Teprve po těchto modifikacích je protein zcela funkční.
Evoluční význam cytochromu c
Cytochrom c je důležitou součástí elektronového transportního řetězce, který je součástí buněčného dýchání, a běžně se nachází v buněčné organele, mitochondrii. Tento protein má protetickou skupinu hemu a centrální ion hemu se při přenosu elektronů střídavě redukuje a oxiduje. Protože úloha této základní bílkoviny při výrobě buněčné energie je klíčová, za miliony let se změnila jen velmi málo. Sekvenování proteinů ukázalo, že mezi různými druhy existuje značné množství homologie sekvence aminokyselin cytochromu c; jinými slovy, evoluční příbuznost lze posoudit měřením podobností nebo rozdílů mezi sekvencemi DNA nebo proteinů různých druhů.
Vědci zjistili, že lidský cytochrom c obsahuje 104 aminokyselin. U každé molekuly cytochromu c z různých organismů, která byla dosud sekvenována, se 37 z těchto aminokyselin objevuje na stejném místě ve všech vzorcích cytochromu c. To naznačuje, že mohl existovat společný předek. Při porovnání sekvencí lidských a šimpanzích proteinů nebyl zjištěn žádný sekvenční rozdíl. Při porovnání sekvencí člověka a opice rhesus byl nalezen jediný rozdíl v jedné aminokyselině. Při dalším srovnání sekvencí člověka a kvasinky byl zjištěn rozdíl na 44. pozici.
Struktura proteinu
Jak již bylo uvedeno, tvar proteinu je rozhodující pro jeho funkci. Například enzym se může vázat na určitý substrát v místě známém jako aktivní místo. Pokud je toto aktivní místo změněno v důsledku lokálních změn nebo změn celkové struktury proteinu, enzym nemusí být schopen se na substrát vázat. Abychom pochopili, jak protein získává svůj konečný tvar nebo konformaci, musíme porozumět čtyřem úrovním struktury proteinu: primární, sekundární, terciární a kvartérní.
Primární struktura
Jedinečná sekvence aminokyselin v polypeptidovém řetězci je jeho primární struktura. Například hormon slinivky břišní inzulin má dva polypeptidové řetězce, A a B, a jsou spojeny disulfidovými vazbami. Koncovou aminokyselinou N řetězce A je glycin, zatímco koncovou aminokyselinou C je asparagin (obrázek 4). Sekvence aminokyselin v řetězcích A a B jsou pro inzulin jedinečné.
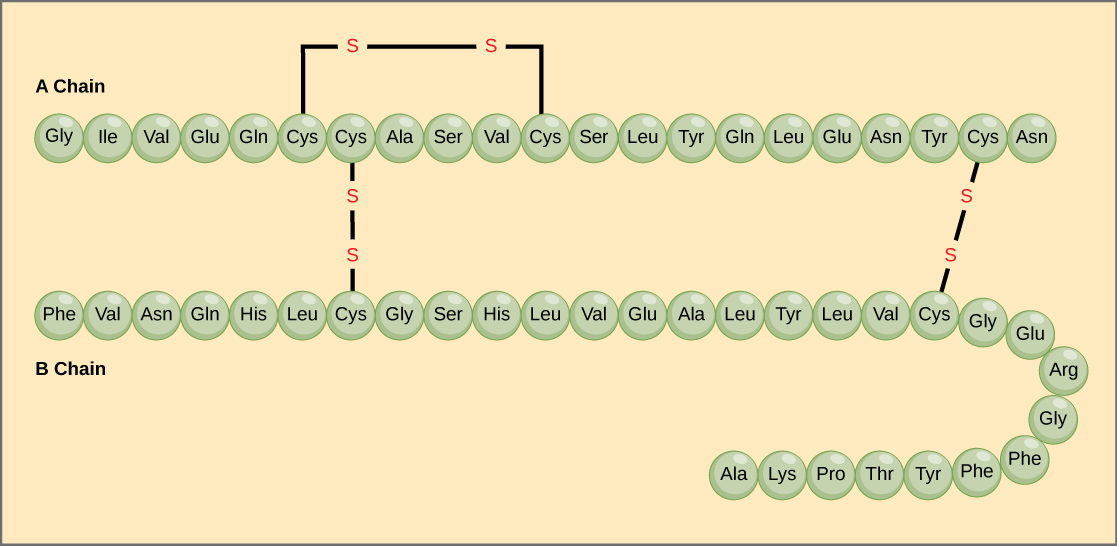
Obrázek 4. Hovězí sérový inzulin je bílkovinný hormon tvořený dvěma peptidovými řetězci, A (o délce 21 aminokyselin) a B (o délce 30 aminokyselin). V každém řetězci je primární struktura označena třípísmennými zkratkami, které představují názvy aminokyselin v pořadí, v jakém jsou přítomny. Aminokyselina cystein (cys) má jako postranní řetězec sulfhydrylovou (SH) skupinu. Dvě sulfhydrylové skupiny mohou v přítomnosti kyslíku reagovat za vzniku disulfidické (S-S) vazby. Dvě disulfidové vazby spojují řetězce A a B dohromady a třetí pomáhá řetězci A složit se do správného tvaru. Všimněte si, že všechny disulfidové vazby jsou stejně dlouhé, ale pro názornost jsou nakresleny různě velké.
Jedinečná sekvence každého proteinu je nakonec určena genem, který daný protein kóduje. Změna v sekvenci nukleotidů kódující oblasti genu může vést k tomu, že se do rostoucího polypeptidového řetězce přidá jiná aminokyselina, což způsobí změnu struktury a funkce proteinu. U srpkovité anémie dochází v řetězci β hemoglobinu (jehož malá část je znázorněna na obrázku 5) k záměně jedné aminokyseliny, což způsobuje změnu struktury a funkce proteinu.
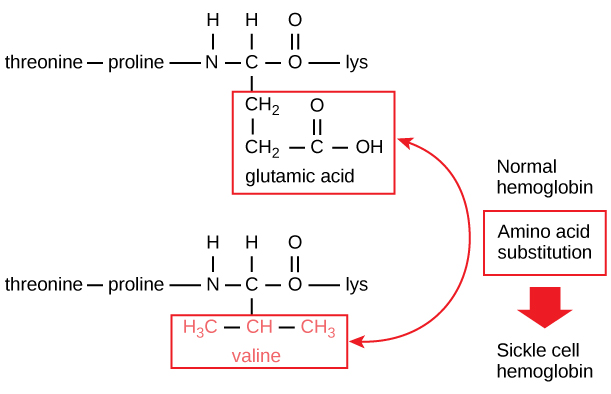
Obrázek 5. Řetězec beta hemoglobinu má 147 zbytků, přesto jediná aminokyselinová záměna vede k srpkovité anémii. V normálním hemoglobinu je aminokyselinou na pozici sedm glutamát. V srpkovitém hemoglobinu je tento glutamát nahrazen valinem.
V řetězci β je konkrétně aminokyselina kyselina glutamová nahrazena valinem. Nejpozoruhodnější je, že molekula hemoglobinu se skládá ze dvou řetězců alfa a dvou řetězců beta, z nichž každý se skládá z přibližně 150 aminokyselin. Molekula má tedy asi 600 aminokyselin. Strukturní rozdíl mezi normální molekulou hemoglobinu a srpkovitou molekulou – který dramaticky snižuje očekávanou délku života – je jediná aminokyselina z oněch 600. Ještě pozoruhodnější je, že těchto 600 aminokyselin je kódováno každá třemi nukleotidy a mutace je způsobena změnou jediné báze (bodová mutace), 1 na 1800 bází.
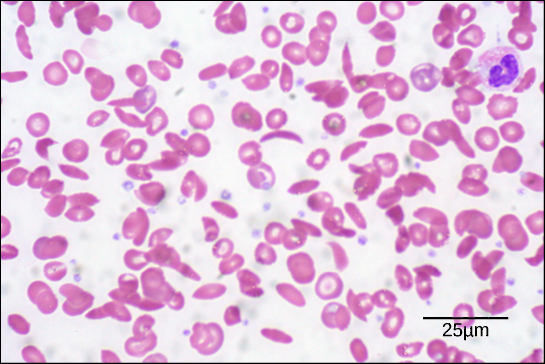
Obrázek 6. Na tomto krevním nátěru, vizualizovaném při zvětšení 535x pomocí mikroskopie v jasném poli, mají srpkovité buňky tvar půlměsíce, zatímco normální buňky mají tvar disku. (kredit: úprava práce Eda Uthmana; data v měřítku sloupce od Matta Russella)
V důsledku této změny jedné aminokyseliny v řetězci vytvářejí molekuly hemoglobinu dlouhá vlákna, která narušují bikonkávní neboli diskovité červené krvinky a nabývají tvaru půlměsíce neboli „srpku“, který ucpává tepny (obrázek 6). To může vést k nesčetným závažným zdravotním problémům, jako je dušnost, závratě, bolesti hlavy a břicha u osob postižených touto chorobou.
Sekundární struktura
Místní skládání polypeptidu v některých oblastech dává vzniknout sekundární struktuře bílkoviny. Nejběžnější jsou struktury α-helixu a β-skládaného listu (obrázek 7). Obě struktury představují strukturu α-helixu – šroubovice drží tvar pomocí vodíkových vazeb. Vodíkové vazby vznikají mezi atomem kyslíku v karbonylové skupině v jedné aminokyselině a jinou aminokyselinou, která je o čtyři aminokyseliny dále v řetězci.
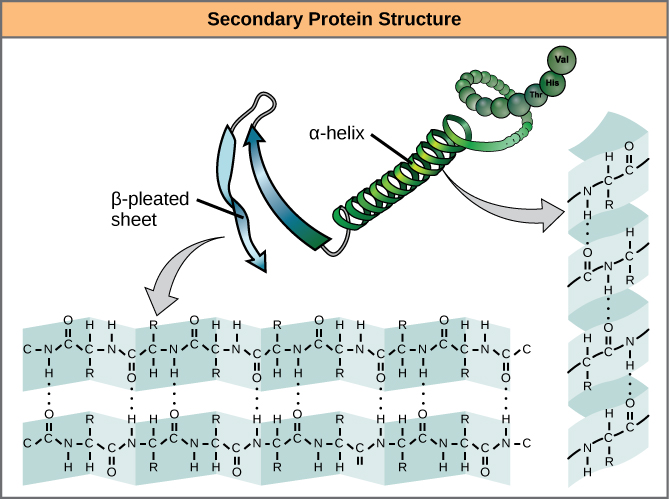
Obrázek 7. α-helix a β-skládaný list jsou sekundární struktury proteinů, které vznikají díky vodíkové vazbě mezi karbonylovými a aminoskupinami v peptidové páteři. Některé aminokyseliny mají sklon k tvorbě α-helixu, zatímco jiné mají sklon k tvorbě β-pleated listu.
Každý závit v alfa-helixu má 3,6 aminokyselinových zbytků. Skupiny R (variantní skupiny) polypeptidu vyčnívají z řetězce α-helixu. V β-šroubovici jsou „záhyby“ tvořeny vodíkovou vazbou mezi atomy na páteři polypeptidového řetězce. Skupiny R jsou navázány na uhlíky a vystupují nad a pod záhyby plisé. Plisované segmenty jsou navzájem rovnoběžné nebo antiparalelní a vodíkové vazby vznikají mezi částečně kladným atomem dusíku v aminoskupině a částečně záporným atomem kyslíku v karbonylové skupině páteře peptidového řetězce. Struktury α-helix a β-pleated sheet se vyskytují ve většině globulárních a vláknitých proteinů a hrají důležitou strukturní roli.
Terciární struktura
Jedinečnou trojrozměrnou strukturou polypeptidu je jeho terciární struktura (obrázek 8). Tato struktura je částečně způsobena chemickými interakcemi působícími na polypeptidový řetězec. Především interakce mezi R skupinami vytvářejí složitou trojrozměrnou terciární strukturu proteinu. Povaha R skupin, které se nacházejí v příslušných aminokyselinách, může působit proti vzniku vodíkových vazeb popsaných u standardních sekundárních struktur. Například R skupiny se stejnými náboji se vzájemně odpuzují a skupiny s nepodobnými náboji se vzájemně přitahují (iontové vazby). Při skládání bílkovin se hydrofobní R skupiny nepolárních aminokyselin nacházejí uvnitř bílkoviny, zatímco hydrofilní R skupiny leží na vnější straně. První typy interakcí jsou také známy jako hydrofobní interakce. Interakce mezi postranními řetězci cysteinů vytváří za přítomnosti kyslíku disulfidické vazby, které jsou jedinou kovalentní vazbou vznikající během skládání bílkovin.
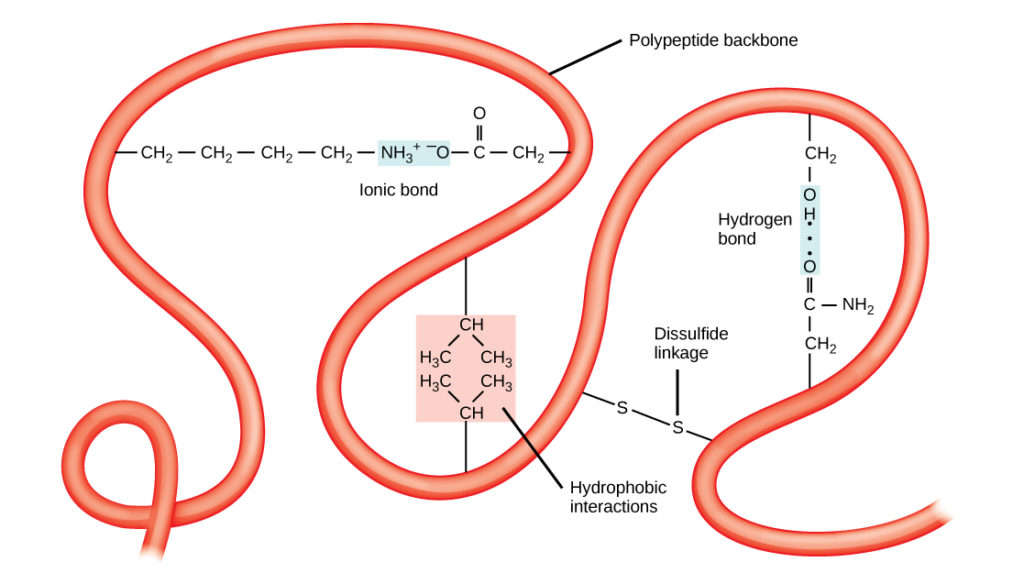
Obrázek 8. Vzájemná interakce hydrofobních řetězců. Terciární struktura proteinů je dána řadou chemických interakcí. Patří mezi ně hydrofobní interakce, iontové vazby, vodíkové vazby a disulfidové vazby.
Všechny tyto interakce, slabé i silné, určují konečný trojrozměrný tvar proteinu. Když protein ztratí svůj trojrozměrný tvar, nemusí být nadále funkční.
Kvartérní struktura
V přírodě jsou některé proteiny tvořeny několika polypeptidy, známými také jako podjednotky, a interakce těchto podjednotek tvoří kvartérní strukturu. Slabé interakce mezi podjednotkami pomáhají stabilizovat celkovou strukturu. Například inzulin (globulární protein) má kombinaci vodíkových a disulfidických vazeb, které způsobují, že je z větší části shlukován do tvaru koule. Inzulin začíná jako jediný polypeptid a po vytvoření disulfidových vazeb, které drží zbývající řetězce pohromadě, ztrácí některé vnitřní sekvence v důsledku posttranslační modifikace. Hedvábí (vláknitá bílkovina) má však strukturu β-skládaného listu, která je výsledkem vodíkových vazeb mezi různými řetězci.
Čtyři úrovně struktury bílkovin (primární, sekundární, terciární a kvartérní) jsou znázorněny na obrázku 9.
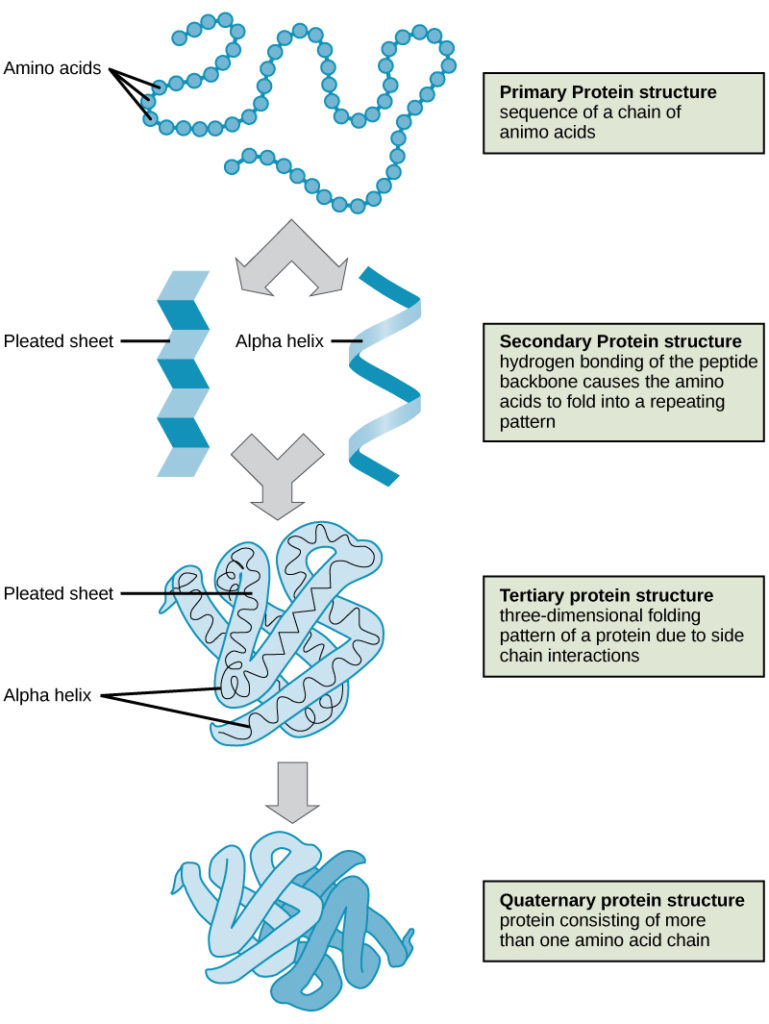
Obrázek 9: Struktura bílkovin. Na těchto obrázcích lze pozorovat čtyři úrovně struktury bílkovin. (kredit: úprava práce National Human Genome Research Institute)
Denaturace a skládání proteinů
Každý protein má svou vlastní jedinečnou sekvenci a tvar, které drží pohromadě díky chemickým interakcím. Pokud je protein vystaven změnám teploty, pH nebo působení chemických látek, může dojít ke změně struktury proteinu, který ztratí svůj tvar, aniž by ztratil svou primární sekvenci, což se nazývá denaturace. Denaturace je často vratná, protože primární struktura polypeptidu je v tomto procesu zachována, pokud je denaturační činidlo odstraněno, což umožňuje proteinu obnovit jeho funkci. Někdy je denaturace nevratná, což vede ke ztrátě funkce. Jedním z příkladů nevratné denaturace bílkovin je smažení vajec. Bílkovina albumin v tekutém vaječném bílku je po vložení na horkou pánev denaturována. Ne všechny bílkoviny jsou denaturovány při vysokých teplotách; například bakterie, které přežívají v horkých pramenech, mají bílkoviny, které fungují při teplotách blízkých varu. Žaludek je také velmi kyselý, má nízké pH a v rámci procesu trávení denaturuje bílkoviny; trávicí enzymy žaludku si však za těchto podmínek zachovávají svou aktivitu.
Skládání bílkovin je pro jejich funkci rozhodující. Původně se předpokládalo, že za proces skládání jsou zodpovědné samotné bílkoviny. Teprve nedávno se zjistilo, že jim při skládání často pomáhají pomocné proteiny známé jako chaperony (nebo chaperoniny), které se během procesu skládání spojují s cílovým proteinem. Působí tak, že zabraňují agregaci polypeptidů, které tvoří kompletní strukturu bílkoviny, a oddělují se od bílkoviny, jakmile je cílová bílkovina složena.
Funkce proteinů
Základní typy a funkce proteinů jsou uvedeny v tabulce 1.
| Tabulka 1. Typy a funkce bílkovin | ||
|---|---|---|
| Typ | Příklady | Funkce |
| Trávicí enzymy | Amyláza, lipáza, pepsin, trypsin | Pomáhají při trávení potravy katabolizací živin na monomerní jednotky |
| Transport | Hemoglobin, albumin | Přenášejí látky v krvi nebo lymfě po celém těle |
| Strukturní | Aktin, tubulin, keratin | Vytvářejí různé struktury, jako je cytoskelet |
| Hormony | Insulin, tyroxin | Koordinují činnost různých tělesných systémů |
| Obrana | Imunoglobuliny | Chrání tělo před cizorodými patogeny |
| Kontrakční | Aktin, myosin | Působí svalovou kontrakci |
| Skladovací | Skladovací bílkoviny, vaječný bílek (albumin) | Zajišťují výživu v raném vývoji embrya a semenáčku |
Dva zvláštní a běžné typy bílkovin jsou enzymy a hormony. Enzymy, které jsou produkovány živými buňkami, jsou katalyzátory biochemických reakcí (např. trávení) a obvykle se jedná o složené nebo konjugované bílkoviny. Každý enzym je specifický pro substrát (reaktant, který se váže na enzym), na který působí. Enzym může pomáhat při rozkladných, přeskupovacích nebo syntetických reakcích. Enzymy, které rozkládají své substráty, se nazývají katabolické enzymy, enzymy, které ze svých substrátů staví složitější molekuly, se nazývají anabolické enzymy a enzymy, které ovlivňují rychlost reakce, se nazývají katalytické enzymy. Je třeba poznamenat, že všechny enzymy zvyšují rychlost reakce, a proto jsou považovány za organické katalyzátory. Příkladem enzymu je slinná amyláza, která hydrolyzuje svůj substrát amylózu, složku škrobu.
Hormony jsou chemicko-signální molekuly, obvykle malé proteiny nebo steroidy, vylučované endokrinními buňkami, které působí na řízení nebo regulaci specifických fyziologických procesů, včetně růstu, vývoje, metabolismu a reprodukce. Například inzulin je bílkovinný hormon, který pomáhá regulovat hladinu glukózy v krvi.
Bílkoviny mají různý tvar a molekulovou hmotnost; některé bílkoviny mají kulovitý tvar, zatímco jiné jsou vláknité povahy. Například hemoglobin je kulovitá bílkovina, ale kolagen, který se nachází v naší kůži, je vláknitá bílkovina. Tvar bílkovin je rozhodující pro jejich funkci a tento tvar je udržován mnoha různými typy chemických vazeb. Změny teploty, pH a působení chemických látek mohou vést k trvalým změnám tvaru bílkoviny, což vede ke ztrátě její funkce, tzv. denaturaci. Všechny bílkoviny se skládají z různých uspořádání stejných 20 typů aminokyselin.
Shrnutí: Bílkoviny
Bílkoviny jsou třídou makromolekul, které pro buňku plní rozmanité funkce. Pomáhají při metabolismu tím, že poskytují strukturální podporu a působí jako enzymy, přenašeče nebo hormony. Stavebními kameny bílkovin (monomery) jsou aminokyseliny. Každá aminokyselina má centrální uhlík, který je spojen s aminoskupinou, karboxylovou skupinou, atomem vodíku a R skupinou nebo postranním řetězcem. Existuje 20 běžně se vyskytujících aminokyselin, z nichž každá se liší R skupinou. Každá aminokyselina je spojena se svými sousedy peptidovou vazbou. Dlouhý řetězec aminokyselin se nazývá polypeptid.
Proteiny jsou uspořádány na čtyřech úrovních: primární, sekundární, terciární a (volitelně) kvartérní. Primární struktura je jedinečná sekvence aminokyselin. Lokální skládání polypeptidu do struktur, jako je α šroubovice a β-skládaný list, představuje sekundární strukturu. Celková trojrozměrná struktura je terciární struktura. Když se dva nebo více polypeptidů spojí a vytvoří kompletní strukturu bílkoviny, je tato konfigurace známá jako kvartérní struktura bílkoviny. Tvar a funkce bílkovin jsou úzce propojeny; jakákoli změna tvaru způsobená změnou teploty nebo pH může vést k denaturaci bílkovin a ztrátě jejich funkce.
Ověřte si své porozumění
Odpovězte na níže uvedené otázky, abyste zjistili, jak dobře rozumíte tématům probíraným v předchozí části. Tento krátký kvíz se nezapočítává do vašeho hodnocení v hodině a můžete jej opakovat neomezený početkrát.
Pomocí tohoto kvízu si můžete ověřit své porozumění a rozhodnout se, zda (1) budete předchozí oddíl dále studovat, nebo (2) přejdete k dalšímu oddílu.
.