- Beschrijf de structuur en functie van proteïnen
- Leerdoelen
- Aminozuren
- Praktijkvraag
- De evolutionaire betekenis van cytochroom c
- Proteïnestructuur
- Priminaire structuur
- Secundaire structuur
- Tertiaire structuur
- Quaternaire structuur
- Denaturatie en eiwitvouwing
- Functie van eiwitten
- In samenvatting: Eiwitten
- Check Your Understanding
Beschrijf de structuur en functie van proteïnen
Proteïnen zijn polymeren van aminozuren. Elk aminozuur bevat een centrale koolstof, een waterstof, een carboxylgroep, een aminogroep, en een variabele R-groep. De R-groep specificeert tot welke klasse aminozuren het behoort: elektrisch geladen hydrofiele zijketens, polaire maar ongeladen zijketens, apolaire hydrofobe zijketens, en speciale gevallen.
Eiwitten hebben verschillende “lagen” van structuur: primair, secundair, tertiair, quaternair.
Eiwitten hebben een verscheidenheid van functies in de cellen. Belangrijke functies zijn die van enzymen, receptoren, transportmoleculen, regulerende eiwitten voor genexpressie, enzovoort. Enzymen zijn biologische katalysatoren die een chemische reactie versnellen zonder blijvend te veranderen. Zij hebben “actieve plaatsen” waar het substraat/reactiemiddel zich bindt, en zij kunnen worden geactiveerd of geremd (competitieve en/of niet-competitieve remmers).
Leerdoelen
- Kennismaken met monomere eenheden van eiwitten: aminozuren
- Definieer de verschillende lagen van de eiwitstructuur
- Identificeer verschillende belangrijke functies van eiwitten
Aminozuren
Eiwitten zijn een van de meest overvloedige organische moleculen in levende systemen en hebben het meest diverse scala aan functies van alle macromoleculen. Eiwitten kunnen structureel, regulerend, samentrekkend of beschermend zijn; zij kunnen dienen in transport, opslag, of membranen; of zij kunnen toxinen of enzymen zijn. Elke cel in een levend systeem kan duizenden eiwitten bevatten, elk met een unieke functie. Hun structuur kan, net als hun functie, sterk variëren. Het zijn echter allemaal polymeren van aminozuren, gerangschikt in een lineaire volgorde.

Figuur 1. Aminozuren hebben een centrale asymmetrische koolstof waaraan een aminogroep, een carboxylgroep, een waterstofatoom en een zijketen (R-groep) zijn gehecht.
Aminozuren zijn de monomeren waaruit proteïnen zijn opgebouwd. Elk aminozuur heeft dezelfde fundamentele structuur, die bestaat uit een centraal koolstofatoom, ook bekend als de alpha (α) koolstof, gebonden aan een aminogroep (NH2), een carboxylgroep (COOH), en aan een waterstofatoom. Elk aminozuur heeft ook een ander atoom of groep atomen gebonden aan het centrale atoom, bekend als de R-groep (figuur 1).
De naam “aminozuur” is afgeleid van het feit dat zij zowel een aminogroep als een carboxylzuurgroep in hun basisstructuur bevatten. Zoals gezegd, zijn er 20 aminozuren aanwezig in proteïnen. Tien daarvan worden voor de mens als essentiële aminozuren beschouwd, omdat het menselijk lichaam ze niet kan aanmaken en ze uit de voeding moeten worden gehaald.
Voor elk aminozuur is de R-groep (of zijketen) anders (figuur 2).
Praktijkvraag

Figuur 2. Er zijn 20 aminozuren die veel voorkomen in eiwitten, elk met een andere R-groep (variantgroep) die de chemische aard bepaalt.
Welke categorieën aminozuren zou je verwachten aan het oppervlak van een oplosbaar eiwit, en welke zou je verwachten aan de binnenkant? Welke verdeling van aminozuren zou je verwachten te vinden in een eiwit ingebed in een lipide bilaag?
De chemische aard van de zijketen bepaalt de aard van het aminozuur (dat wil zeggen, of het zuur, basisch, polair, of niet-polair is). Bijvoorbeeld, het aminozuur glycine heeft een waterstofatoom als de R-groep. Aminozuren zoals valine, methionine, en alanine zijn niet polair of hydrofoob van aard, terwijl aminozuren zoals serine, threonine, en cysteïne polair zijn en hydrofiele zijketens hebben. De zijketens van lysine en arginine zijn positief geladen, en daarom zijn deze aminozuren ook bekend als basische aminozuren. Proline heeft een R-groep die aan de aminogroep is gekoppeld, en zo een ringvormige structuur vormt. Proline is een uitzondering op de standaardstructuur van een aminozuur, omdat de aminogroep niet gescheiden is van de zijketen (figuur 2).
Aminozuren worden aangeduid met één hoofdletter of een drieletterige afkorting. Valine bijvoorbeeld is bekend onder de letter V of het drieletterige symbool val. Net zoals sommige vetzuren essentieel zijn voor een dieet, zijn sommige aminozuren dat ook. Zij staan bekend als essentiële aminozuren, en bij de mens omvatten zij isoleucine, leucine, en cysteïne. Essentiële aminozuren zijn aminozuren die nodig zijn voor de opbouw van eiwitten in het lichaam, hoewel ze niet door het lichaam worden geproduceerd; welke aminozuren essentieel zijn, verschilt van organisme tot organisme.

Figuur 3. De vorming van een peptidebinding is een dehydratiesynthesereactie. De carboxylgroep van het ene aminozuur wordt gekoppeld aan de aminogroep van het inkomende aminozuur. Daarbij komt een molecuul water vrij.
De volgorde en het aantal aminozuren bepalen uiteindelijk de vorm, grootte en functie van het eiwit. Elk aminozuur is met een ander aminozuur verbonden door een covalente binding, een zogenaamde peptidebinding, die wordt gevormd door een dehydratatiereactie. De carboxylgroep van het ene aminozuur en de aminogroep van het inkomende aminozuur combineren, waarbij een watermolecuul vrijkomt. De resulterende binding is de peptidebinding (figuur 3).
De producten die door dergelijke bindingen worden gevormd, worden peptiden genoemd. Naarmate meer aminozuren zich bij deze groeiende keten aansluiten, wordt de resulterende keten een polypeptide genoemd. Elk polypeptide heeft een vrije aminogroep aan één uiteinde. Dit uiteinde wordt het N-eind genoemd, of het amino-eind, en het andere uiteinde heeft een vrije carboxylgroep, ook bekend als het C- of carboxyl-eind. Hoewel de termen polypeptide en proteïne soms door elkaar worden gebruikt, is een polypeptide technisch gezien een polymeer van aminozuren, terwijl de term proteïne wordt gebruikt voor een polypeptide of polypeptiden die zijn samengevoegd, vaak niet-peptide prothetische groepen hebben gebonden, een aparte vorm hebben en een unieke functie hebben. Na de eiwitsynthese (translatie) worden de meeste eiwitten gewijzigd. Deze staan bekend als post-translationele modificaties. Zij kunnen worden gesplitst, gefosforyleerd, of er kunnen andere chemische groepen aan worden toegevoegd. Pas na deze modificaties is het eiwit volledig functioneel.
De evolutionaire betekenis van cytochroom c
Cytochroom c is een belangrijk onderdeel van de elektronentransportketen, een onderdeel van de cellulaire ademhaling, en het wordt normaal aangetroffen in de cellulaire organel, de mitochondrion. Dit eiwit heeft een heemprothetische groep, en het centrale ion van het heem wordt tijdens de elektronenoverdracht afwisselend gereduceerd en geoxideerd. Omdat de rol van dit essentiële eiwit bij de productie van cellulaire energie cruciaal is, is het in de loop van miljoenen jaren maar weinig veranderd. Proteïne-sequencing heeft aangetoond dat er een aanzienlijke hoeveelheid cytochroom c aminozuursequentie-homologie is tussen verschillende soorten; met andere woorden, evolutionaire verwantschap kan worden beoordeeld door het meten van de overeenkomsten of verschillen tussen de DNA- of proteïne-sequenties van verschillende soorten.
Wetenschappers hebben vastgesteld dat het menselijke cytochroom c 104 aminozuren bevat. Voor elke cytochrome c-molecule van verschillende organismen die tot op heden van een sequentie is voorzien, komen 37 van deze aminozuren op dezelfde plaats voor in alle monsters van cytochrome c. Dit wijst erop dat er een gemeenschappelijke voorouder kan zijn geweest. Bij vergelijking van de menselijke en chimpansee-eiwitsequenties werd geen verschil in sequentie gevonden. Bij de vergelijking van de menselijke sequenties met die van resusaapjes werd slechts één aminozuur verschil gevonden. In een andere vergelijking, waarbij sequenties van mens met gist werden vergeleken, werd een verschil gevonden op de 44e positie.
Proteïnestructuur
Zoals eerder besproken, is de vorm van een eiwit van cruciaal belang voor de functie ervan. Zo kan een enzym zich binden aan een specifiek substraat op een plaats die bekend staat als de actieve plaats. Als deze actieve plaats veranderd is door plaatselijke veranderingen of door veranderingen in de algemene structuur van het eiwit, kan het enzym het substraat niet meer binden. Om te begrijpen hoe het eiwit zijn uiteindelijke vorm of conformatie krijgt, moeten we de vier niveaus van eiwitstructuur begrijpen: primair, secundair, tertiair en quaternair.
Priminaire structuur
De unieke opeenvolging van aminozuren in een polypeptideketen is de primaire structuur. Het pancreashormoon insuline bijvoorbeeld heeft twee polypeptideketens, A en B, en zij zijn met elkaar verbonden door disulfidebindingen. Het N-aminozuur van de A-keten is glycine, terwijl het C-aminozuur asparagine is (figuur 4). De volgorde van aminozuren in de A- en de B- keten is uniek voor insuline.
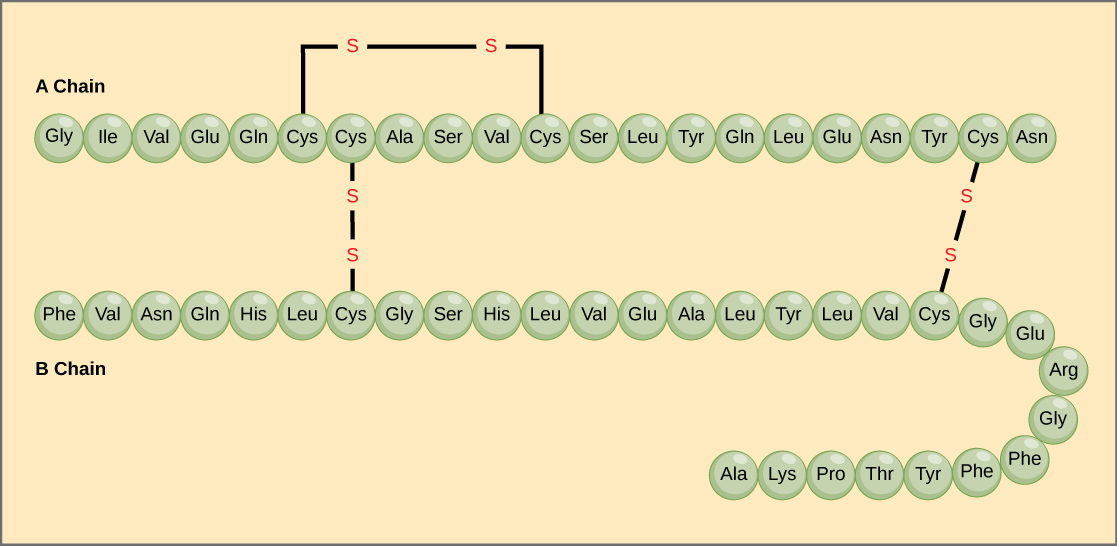
Figuur 4. Runderenseruminsuline is een eiwithormoon dat bestaat uit twee peptideketens, A (21 aminozuren lang) en B (30 aminozuren lang). In elke keten wordt de primaire structuur aangegeven met drieletterige afkortingen die de namen van de aminozuren weergeven in de volgorde waarin ze aanwezig zijn. Het aminozuur cysteïne (cys) heeft een sulfhydrylgroep (SH) als zijketen. Twee sulfhydrylgroepen kunnen in aanwezigheid van zuurstof reageren om een disulfidebinding (S-S) te vormen. Twee disulfidebindingen verbinden de A- en de B-keten met elkaar, en een derde helpt de A-keten in de juiste vorm te vouwen. Merk op dat alle disulfidebindingen even lang zijn, maar voor de duidelijkheid verschillend van grootte zijn getekend.
De unieke sequentie voor elk eiwit wordt uiteindelijk bepaald door het gen dat het eiwit codeert. Een verandering in de nucleotidevolgorde van de coderende regio van het gen kan ertoe leiden dat een ander aminozuur wordt toegevoegd aan de groeiende polypeptideketen, waardoor de structuur en functie van het eiwit veranderen. Bij sikkelcelanemie heeft de hemoglobine β-keten (waarvan een klein gedeelte in figuur 5 is afgebeeld) één aminozuursubstitutie, waardoor de eiwitstructuur en -functie veranderen.
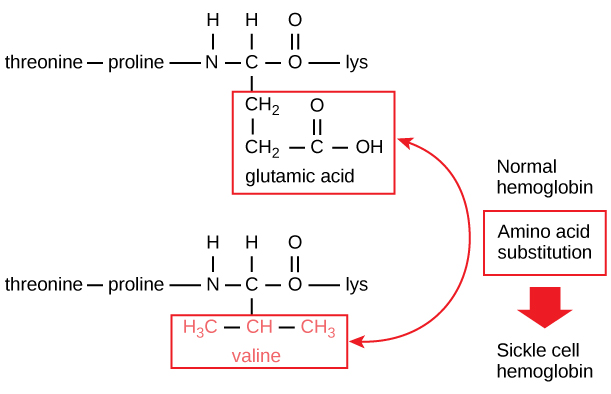
Figuur 5. De bètaketen van hemoglobine is 147 residuen lang, maar één enkele aminozuursubstitutie leidt tot sikkelcelanemie. In normaal hemoglobine is het aminozuur op positie zeven glutamaat. In sikkelcel hemoglobine is dit glutamaat vervangen door een valine.
Specifiek wordt het aminozuur glutaminezuur in de β-keten vervangen door valine. Het meest opmerkelijke is dat een hemoglobinemolecuul is opgebouwd uit twee alfaketens en twee betaketens die elk uit ongeveer 150 aminozuren bestaan. De molecule telt dus ongeveer 600 aminozuren. Het structurele verschil tussen een normale hemoglobinemolecule en een sikkelcelmolecule – die de levensverwachting drastisch vermindert – is één aminozuur van de 600. Wat nog opmerkelijker is, is dat die 600 aminozuren elk door drie nucleotiden worden gecodeerd, en dat de mutatie wordt veroorzaakt door één enkele basenverandering (puntmutatie), 1 op de 1800 basen.
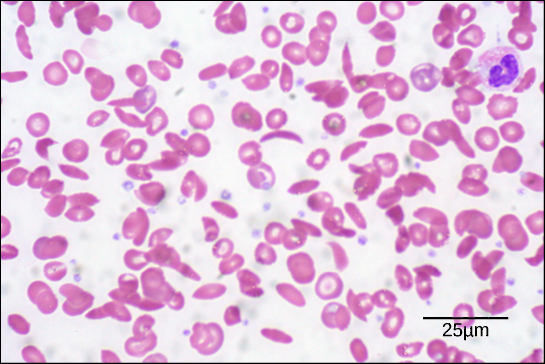
Figuur 6. In dit bloeduitstrijkje, gevisualiseerd bij 535x vergroting met helderveldmicroscopie, zijn de sikkelcellen halvemaanvormig, terwijl de normale cellen schijfvormig zijn. (credit: bewerking van werk van Ed Uthman; schaalbalkgegevens van Matt Russell)
Door deze verandering van één aminozuur in de keten vormen hemoglobinemoleculen lange vezels die de biconcave, of schijfvormige, rode bloedcellen vervormen en een sikkelvorm aannemen, waardoor slagaders verstopt raken (figuur 6). Dit kan leiden tot talloze ernstige gezondheidsproblemen zoals ademnood, duizeligheid, hoofdpijn en buikpijn voor degenen die aan deze ziekte lijden.
Secundaire structuur
De lokale vouwing van het polypeptide in sommige regio’s geeft aanleiding tot de secundaire structuur van het eiwit. De meest voorkomende zijn de α-helix- en de β-geplooide plaatstructuren (figuur 7). Beide structuren zijn de α-helixstructuur – de helix wordt in vorm gehouden door waterstofbruggen. De waterstofbruggen vormen zich tussen het zuurstofatoom in de carbonylgroep in het ene aminozuur en een ander aminozuur dat vier aminozuren verder in de keten ligt.
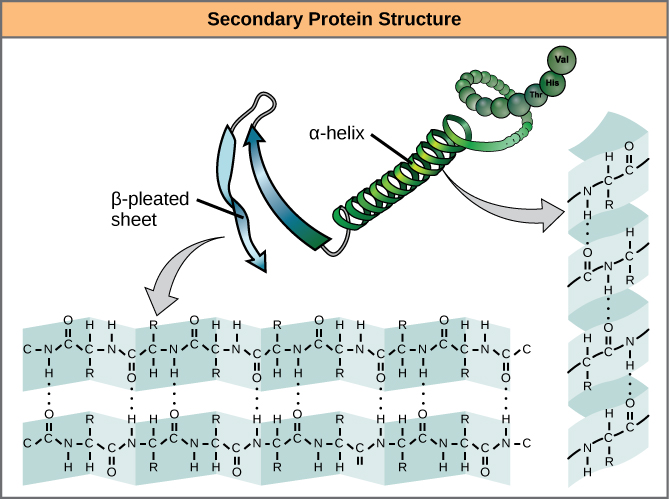
Figuur 7. De α-helix en de β-geplooide plaat zijn secundaire structuren van eiwitten die ontstaan door waterstofbinding tussen carbonyl- en aminogroepen in de peptide-backbone. Bepaalde aminozuren hebben de neiging een α-helix te vormen, terwijl andere de neiging hebben een β-geplooide plaat te vormen.
Elke spiraalvormige draai in een alfa-helix heeft 3,6 aminozuurresiduen. De R-groepen (de variantgroepen) van het polypeptide steken uit de α-helixketen. In de β-helix worden de “plooien” gevormd door waterstofbinding tussen atomen op de ruggengraat van de polypeptideketen. De R-groepen zitten vast aan de koolwaterstoffen en strekken zich uit boven en onder de plooien van de plooi. De geplooide segmenten liggen parallel of antiparallel aan elkaar, en er worden waterstofbruggen gevormd tussen het gedeeltelijk positieve stikstofatoom in de aminogroep en het gedeeltelijk negatieve zuurstofatoom in de carbonylgroep van de peptide-backbone. De α-helix en β-geplooide velstructuren worden aangetroffen in de meeste bolvormige en vezelige eiwitten en zij spelen een belangrijke structurele rol.
Tertiaire structuur
De unieke driedimensionale structuur van een polypeptide is de tertiaire structuur (figuur 8). Deze structuur is gedeeltelijk het gevolg van chemische interacties die op de polypeptideketen werkzaam zijn. Vooral de interacties tussen R-groepen creëren de complexe driedimensionale tertiaire structuur van een eiwit. De aard van de R-groepen in de betrokken aminozuren kan de vorming van de waterstofbruggen, zoals beschreven voor standaard secundaire structuren, tegenwerken. Bijvoorbeeld, R-groepen met gelijke ladingen worden door elkaar afgestoten en die met ongelijke ladingen worden door elkaar aangetrokken (ionische bindingen). Wanneer eiwitvouwing plaatsvindt, liggen de hydrofobe R-groepen van apolaire aminozuren in het inwendige van het eiwit, terwijl de hydrofiele R-groepen aan de buitenkant liggen. De eerstgenoemde soorten interacties worden ook wel hydrofobe interacties genoemd. Interactie tussen cysteïnezijketens vormt disulfidebindingen in aanwezigheid van zuurstof, de enige covalente binding die tijdens eiwitvouwing wordt gevormd.
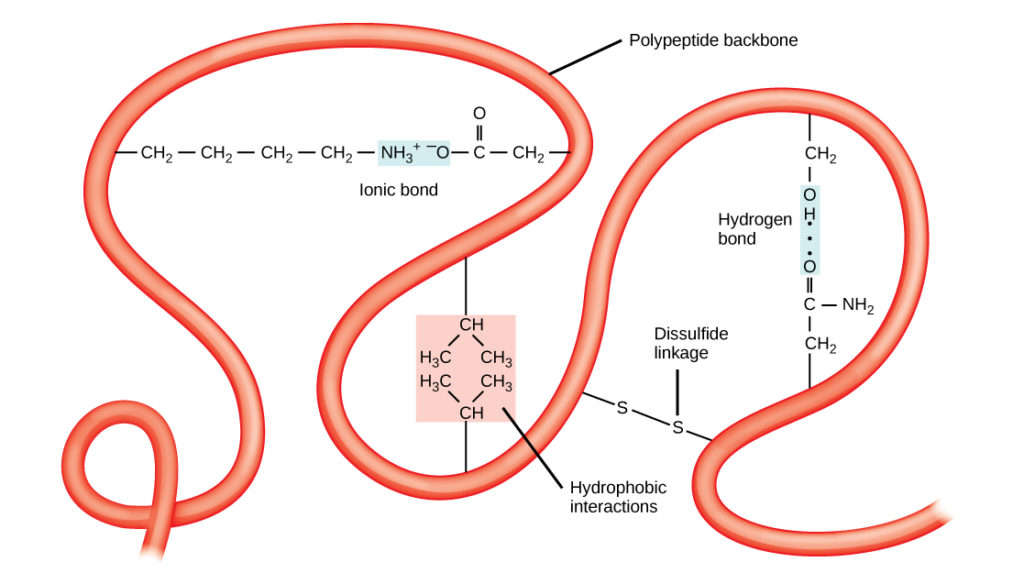
Figuur 8. De tertiaire structuur van proteïnen wordt bepaald door een verscheidenheid van chemische interacties. Deze omvatten hydrofobe interacties, ionische binding, waterstofbinding en disulfidebindingen.
Al deze interacties, zwak en sterk, bepalen de uiteindelijke driedimensionale vorm van het eiwit. Wanneer een eiwit zijn driedimensionale vorm verliest, kan het niet langer functioneel zijn.
Quaternaire structuur
In de natuur worden sommige eiwitten gevormd uit verschillende polypeptiden, ook wel subeenheden genoemd, en de interactie van deze subeenheden vormt de quaternaire structuur. Zwakke interacties tussen de subeenheden helpen om de totale structuur te stabiliseren. Zo heeft insuline (een bolvormig eiwit) een combinatie van waterstofbruggen en disulfidebruggen die ervoor zorgen dat het meestal samenklontert tot een bolvorm. Insuline begint als een enkel polypeptide en verliest enkele interne sequenties door posttranslationele modificatie na de vorming van de disulfidebindingen die de resterende ketens bijeenhouden. Zijde (een vezelig eiwit) daarentegen heeft een β-geplooide bladstructuur die het resultaat is van waterstofbinding tussen verschillende ketens.
De vier niveaus van eiwitstructuur (primair, secundair, tertiair en quaternair) worden geïllustreerd in figuur 9.
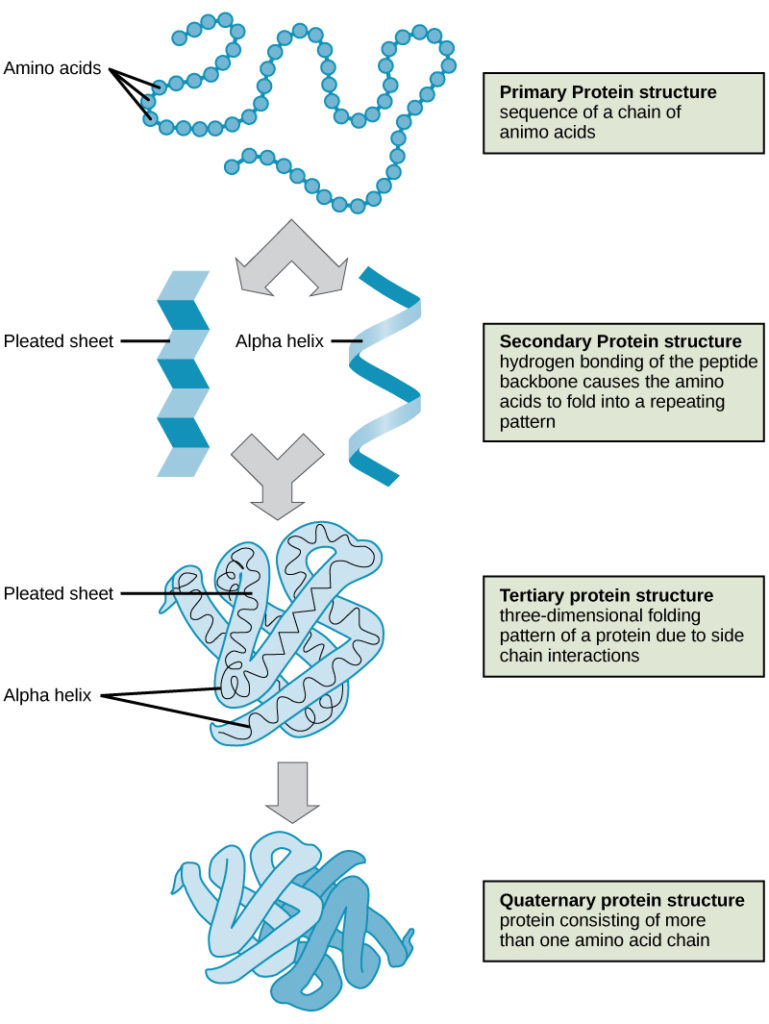
Figuur 9. De vier niveaus van de eiwitstructuur kunnen in deze illustraties worden waargenomen. (credit: modificatie van werk van National Human Genome Research Institute)
Denaturatie en eiwitvouwing
Elk eiwit heeft zijn eigen unieke volgorde en vorm die bij elkaar worden gehouden door chemische interacties. Als het eiwit wordt blootgesteld aan veranderingen in temperatuur, pH, of blootstelling aan chemicaliën, kan de eiwitstructuur veranderen, waarbij het zijn vorm verliest zonder zijn primaire volgorde te verliezen in wat denaturatie wordt genoemd. Denaturatie is vaak omkeerbaar omdat de primaire structuur van het polypeptide tijdens het proces behouden blijft als de denaturerende stof wordt verwijderd, waardoor het eiwit zijn functie kan hervatten. Soms is denaturatie onomkeerbaar en leidt het tot functieverlies. Een voorbeeld van onomkeerbare eiwitdenaturatie is wanneer een ei wordt gebakken. Het eiwit albumine in het vloeibare eiwit wordt gedenatureerd wanneer het in een hete pan wordt gelegd. Niet alle eiwitten worden gedenatureerd bij hoge temperaturen; bacteriën die overleven in hete bronnen hebben bijvoorbeeld eiwitten die functioneren bij temperaturen die dicht bij het kookpunt liggen. De maag is ook zeer zuur, heeft een lage pH, en denatureert eiwitten als onderdeel van het spijsverteringsproces; de spijsverteringsenzymen van de maag behouden echter hun activiteit onder deze omstandigheden.
De vouwing van eiwitten is van cruciaal belang voor hun functie. Oorspronkelijk dacht men dat de eiwitten zelf verantwoordelijk waren voor het vouwproces. Pas onlangs werd ontdekt dat zij bij het vouwproces vaak hulp krijgen van eiwithelpers die chaperones (of chaperoninen) worden genoemd en die zich tijdens het vouwproces met het doeleiwit associëren. Zij voorkomen aggregatie van polypeptiden die samen de volledige eiwitstructuur vormen, en zij maken zich los van het eiwit zodra het doeleiwit is gevouwen.
Functie van eiwitten
De primaire soorten en functies van eiwitten zijn vermeld in tabel 1.
| Tabel 1. Eiwittypes en functies | ||
|---|---|---|
| Type | Voorbeelden | Functies |
| Digestieve Enzymen | Amylase, lipase, pepsine, trypsine | Helpen bij de vertering van voedsel door het kataboliseren van voedingsstoffen tot monomere eenheden |
| Transport | Hemoglobine, albumine | Vervoert stoffen in het bloed of de lymfe door het lichaam |
| Structureel | Actine, tubuline, keratine | Bouwt verschillende structuren, zoals het cytoskelet |
| Hormonen | Insuline, thyroxine | Coördineren de activiteit van verschillende lichaamssystemen |
| Verdediging | Immunoglobulinen | Beschermen het lichaam tegen vreemde ziekteverwekkers |
| Contractiel | Actine, myosine | Beïnvloeden spiercontractie |
| Opslaan | Opslaan van eiwitten, eiwit (albumine) | Voorzien in de vroege ontwikkeling van het embryo en het kiemplantje |
Twee speciale en veel voorkomende soorten eiwitten zijn enzymen en hormonen. Enzymen, die door levende cellen worden geproduceerd, zijn katalysatoren in biochemische reacties (zoals de spijsvertering) en zijn gewoonlijk complexe of geconjugeerde eiwitten. Elk enzym is specifiek voor het substraat (een reactant die zich aan een enzym bindt) waarop het werkt. Het enzym kan helpen bij afbraak-, herschikkings-, of synthesereacties. Enzymen die hun substraten afbreken worden katabole enzymen genoemd, enzymen die complexere moleculen opbouwen uit hun substraten worden anabole enzymen genoemd, en enzymen die de reactiesnelheid beïnvloeden worden katalytische enzymen genoemd. Er zij op gewezen dat alle enzymen de reactiesnelheid verhogen en daarom als organische katalysatoren worden beschouwd. Een voorbeeld van een enzym is speekselamylase, dat zijn substraat amylose, een bestanddeel van zetmeel, hydrolyseert.
Hormonen zijn chemisch-signaalmoleculen, gewoonlijk kleine eiwitten of steroïden, die worden afgescheiden door endocriene cellen en die specifieke fysiologische processen, waaronder groei, ontwikkeling, metabolisme en voortplanting, controleren of reguleren. Insuline is bijvoorbeeld een eiwithormoon dat helpt bij het reguleren van de bloedglucosespiegel.
Eiwitten hebben verschillende vormen en molecuulgewichten; sommige eiwitten zijn bolvormig terwijl andere vezelig van aard zijn. Hemoglobine is bijvoorbeeld een bolvormig eiwit, maar collageen, dat in onze huid wordt aangetroffen, is een vezelig eiwit. De vorm van eiwitten is van cruciaal belang voor hun functie, en deze vorm wordt in stand gehouden door veel verschillende soorten chemische bindingen. Veranderingen in temperatuur, pH, en blootstelling aan chemicaliën kunnen leiden tot permanente veranderingen in de vorm van het eiwit, wat leidt tot verlies van functie, bekend als denaturatie. Alle eiwitten zijn opgebouwd uit verschillende rangschikkingen van dezelfde 20 soorten aminozuren.
In samenvatting: Eiwitten
Eiwitten zijn een klasse van macromoleculen die een uiteenlopende reeks functies voor de cel vervullen. Zij helpen bij de stofwisseling door structurele ondersteuning te bieden en door op te treden als enzymen, dragers of hormonen. De bouwstenen van eiwitten (monomeren) zijn aminozuren. Elk aminozuur heeft een centrale koolstof die is gekoppeld aan een aminogroep, een carboxylgroep, een waterstofatoom, en een R-groep of zijketen. Er zijn 20 veel voorkomende aminozuren, die elk verschillen in de R-groep. Elk aminozuur is met zijn buren verbonden door een peptidebinding. Een lange keten van aminozuren staat bekend als een polypeptide.
Eiwitten zijn georganiseerd op vier niveaus: primair, secundair, tertiair, en (optioneel) quaternair. De primaire structuur is de unieke opeenvolging van aminozuren. De lokale vouwing van het polypeptide tot structuren zoals de α-helix en de β-geplooide plaat vormt de secundaire structuur. De algemene driedimensionale structuur is de tertiaire structuur. Wanneer twee of meer polypeptiden samen de volledige eiwitstructuur vormen, wordt de configuratie de quaternaire structuur van een eiwit genoemd. Eiwitvorm en functie zijn nauw met elkaar verbonden; elke verandering in vorm veroorzaakt door veranderingen in temperatuur of pH kan leiden tot denaturatie van het eiwit en een verlies in functie.
Check Your Understanding
Beantwoord de onderstaande vraag (vragen) om te zien hoe goed je de onderwerpen uit het vorige deel begrijpt. Deze korte quiz telt niet mee voor uw cijfer en u kunt hem een onbeperkt aantal keren overdoen.
Gebruik deze quiz om uw begrip te toetsen en te beslissen of u (1) de vorige paragraaf verder wilt bestuderen of (2) verder wilt gaan met de volgende paragraaf.