Beskriv proteiners struktur och funktion
Proteiner är polymerer av aminosyror. Varje aminosyra innehåller ett centralt kol, ett väte, en karboxylgrupp, en aminogrupp och en variabel R-grupp. R-gruppen anger vilken klass av aminosyror den tillhör: elektriskt laddade hydrofila sidokedjor, polära men oladdade sidokedjor, opolära hydrofoba sidokedjor och specialfall.
Proteiner har olika ”lager” av struktur: primära, sekundära, tertiära, kvartära.
Proteiner har en mängd olika funktioner i celler. Bland de viktigaste funktionerna kan nämnas att de fungerar som enzymer, receptorer, transportmolekyler, reglerande proteiner för genuttryck och så vidare. Enzymer är biologiska katalysatorer som påskyndar en kemisk reaktion utan att förändras permanent. De har ”aktiva platser” där substratet/reaktanten binds, och de kan antingen aktiveras eller hämmas (kompetitiva och/eller icke-kompetitiva hämmare).
Lärandemål
- Demonstrera förtrogenhet med monomera enheter av proteiner: Aminosyror
- Definiera proteinstrukturens olika lager
- Identifiera flera viktiga funktioner hos proteiner
Aminosyror
Proteiner är en av de vanligaste organiska molekylerna i levande system och har det mest varierande utbudet av funktioner av alla makromolekyler. Proteiner kan vara strukturella, reglerande, kontraktila eller skyddande, de kan fungera i transport, lagring eller membran, eller de kan vara toxiner eller enzymer. Varje cell i ett levande system kan innehålla tusentals proteiner, var och en med en unik funktion. Deras strukturer, liksom deras funktioner, varierar kraftigt. De är dock alla polymerer av aminosyror som är ordnade i en linjär sekvens.

Figur 1. Aminosyror har ett centralt asymmetriskt kol till vilket en aminogrupp, en karboxylgrupp, en väteatom och en sidokedja (R-grupp) är knutna.
Aminosyror är de monomerer som utgör proteiner. Varje aminosyra har samma grundläggande struktur, som består av en central kolatom, även kallad alfa (α)-kol, som är bunden till en aminogrupp (NH2), en karboxylgrupp (COOH) och till en väteatom. Varje aminosyra har också en annan atom eller grupp av atomer bundna till den centrala atomen som kallas R-gruppen (figur 1).
Namnet ”aminosyra” härrör från det faktum att de innehåller både aminogrupp och karboxylsyragrupp i sin grundstruktur. Som nämnts finns det 20 aminosyror i proteiner. Tio av dessa anses vara essentiella aminosyror hos människan eftersom människokroppen inte kan producera dem och de fås genom kosten.
För varje aminosyra är R-gruppen (eller sidokedjan) olika (figur 2).
Praktikfråga

Figur 2. Det finns 20 vanliga aminosyror som vanligen finns i proteiner, var och en med en annan R-grupp (variantgrupp) som bestämmer dess kemiska natur.
Vilka kategorier av aminosyror skulle du förvänta dig att hitta på ytan av ett lösligt protein, och vilka skulle du förvänta dig att hitta i det inre? Vilken fördelning av aminosyror skulle du förvänta dig att hitta i ett protein som är inbäddat i ett lipiddubbelskikt?
Sidekedjans kemiska natur bestämmer aminosyrans natur (det vill säga om den är sur, basisk, polär eller opolär). Aminosyran glycin har till exempel en väteatom som R-grupp. Aminosyror som valin, metionin och alanin är opolära eller hydrofoba till sin natur, medan aminosyror som serin, threonin och cystein är polära och har hydrofila sidokedjor. Sidokedjorna hos lysin och arginin är positivt laddade och därför kallas dessa aminosyror också för basiska aminosyror. Prolin har en R-grupp som är kopplad till aminogruppen och bildar en ringliknande struktur. Prolin är ett undantag från standardstrukturen för en animosyra eftersom dess aminogrupp inte är skild från sidokedjan (figur 2).
Aminosyror representeras av en enda stor bokstav eller en förkortning med tre bokstäver. Valin är till exempel känt med bokstaven V eller symbolen val på tre bokstäver. Precis som vissa fettsyror är nödvändiga i en kost är vissa aminosyror också nödvändiga. De kallas essentiella aminosyror, och hos människor omfattar de isoleucin, leucin och cystein. Med essentiella aminosyror avses de aminosyror som är nödvändiga för uppbyggnaden av proteiner i kroppen, även om de inte produceras av kroppen; vilka aminosyror som är essentiella varierar från organism till organism.

Figur 3. Bildandet av peptidbindningar är en dehydreringssyntesreaktion. Karboxylgruppen i en aminosyra kopplas till aminogruppen i den inkommande aminosyran. I processen frigörs en vattenmolekyl.
Sekvensen och antalet aminosyror bestämmer i slutändan proteinets form, storlek och funktion. Varje aminosyra är knuten till en annan aminosyra genom en kovalent bindning, en så kallad peptidbindning, som bildas genom en dehydreringsreaktion. Karboxylgruppen i en aminosyra och aminogruppen i den inkommande aminosyran kombineras och frigör en vattenmolekyl. Den resulterande bindningen är peptidbindningen (figur 3).
De produkter som bildas av sådana bindningar kallas peptider. När fler aminosyror ansluter sig till denna växande kedja kallas den resulterande kedjan för en polypeptid. Varje polypeptid har en fri aminogrupp i ena änden. Denna ände kallas N-terminalen, eller aminoterminalen, och den andra änden har en fri karboxylgrupp, även kallad C- eller karboxylterminalen. Även om termerna polypeptid och protein ibland används omväxlande, är en polypeptid tekniskt sett en polymer av aminosyror, medan termen protein används för en polypeptid eller polypeptider som har kombinerats med varandra, ofta har bundna prostetiska grupper som inte är peptider, har en distinkt form och har en unik funktion. Efter proteinsyntesen (translation) modifieras de flesta proteiner. Dessa kallas posttranslationella modifieringar. De kan genomgå klyvning, fosforylering eller kräva att andra kemiska grupper läggs till. Först efter dessa modifieringar är proteinet helt funktionellt.
Cytokrom c:s evolutionära betydelse
Cytokrom c är en viktig komponent i elektrontransportkedjan, en del av den cellulära andningen, och det finns normalt i den cellulära organellen mitokondrien. Detta protein har en protesgrupp av hem, och den centrala jonen i hemmet blir omväxlande reducerad och oxiderad under elektronöverföringen. Eftersom detta viktiga proteins roll i produktionen av cellenergi är avgörande har det förändrats mycket lite under miljontals år. Proteinsekvensering har visat att det finns en avsevärd mängd homologi i aminosyrasekvensen för cytokrom c mellan olika arter; med andra ord kan evolutionärt släktskap bedömas genom att mäta likheterna eller skillnaderna mellan olika arters DNA- eller proteinsekvenser.
Vetenskapsmännen har fastställt att mänskligt cytokrom c innehåller 104 aminosyror. För varje cytokrom c-molekyl från olika organismer som hittills har sekvenserats förekommer 37 av dessa aminosyror i samma position i alla prover av cytokrom c. Detta tyder på att det kan ha funnits en gemensam förfader. Vid en jämförelse mellan människans och schimpansens proteinsekvenser hittades ingen sekvensskillnad. När sekvenser från människa och rhesusapa jämfördes var den enda skillnad som hittades en aminosyra. Vid en annan jämförelse, mellan sekvenser från människa och jäst, visar en skillnad i den 44:e positionen.
Proteinstruktur
Som tidigare diskuterats är formen på ett protein avgörande för dess funktion. Ett enzym kan till exempel binda till ett specifikt substrat på en plats som kallas den aktiva platsen. Om denna aktiva plats ändras på grund av lokala förändringar eller förändringar i den övergripande proteinstrukturen kan enzymet inte kunna binda till substratet. För att förstå hur proteinet får sin slutliga form eller konformation måste vi förstå de fyra nivåerna av proteinstruktur: primär, sekundär, tertiär och kvartär.
Primärstruktur
Den unika sekvensen av aminosyror i en polypeptidkedja är dess primärstruktur. Till exempel har bukspottkörtelhormonet insulin två polypeptidkedjor, A och B, och de är sammanlänkade med disulfidbindningar. Den N-terminala aminosyran i A-kedjan är glycin, medan den C-terminala aminosyran är asparagin (figur 4). Sekvenserna av aminosyror i A- och B-kedjorna är unika för insulin.
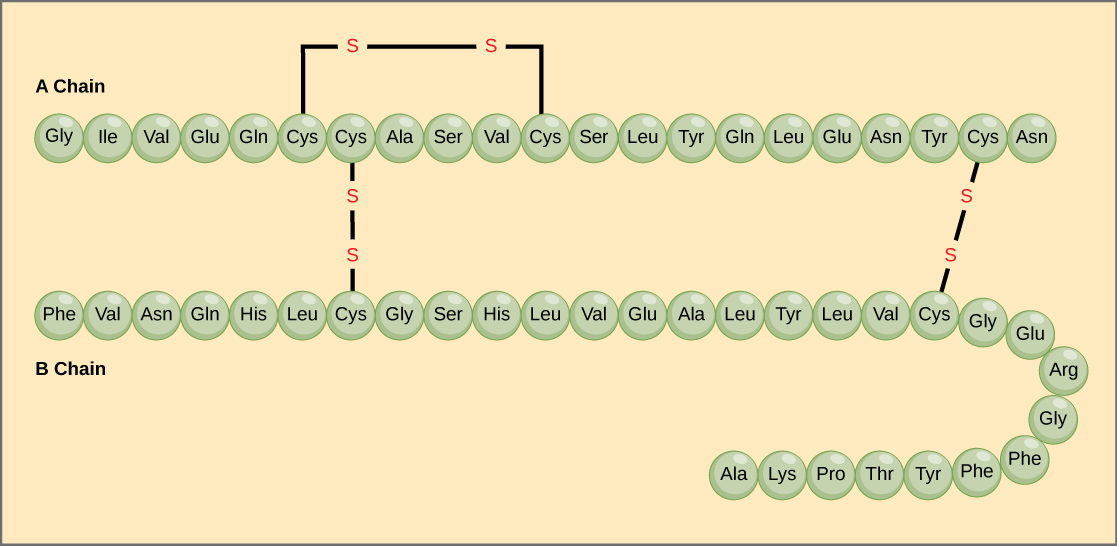
Figur 4. Bovint seruminsulin är ett proteinhormon som består av två peptidkedjor, A (21 aminosyror långa) och B (30 aminosyror långa). I varje kedja anges primärstrukturen med förkortningar på tre bokstäver som representerar namnen på aminosyrorna i den ordning de förekommer. Aminosyran cystein (cys) har en sulfhydrylgrupp (SH) som sidokedja. Två sulfhydrylgrupper kan reagera i närvaro av syre för att bilda en disulfidbindning (S-S). Två disulfidbindningar förbinder A- och B-kedjorna med varandra, och en tredje hjälper A-kedjan att vika sig i rätt form. Observera att alla disulfidbindningar är lika långa, men är ritade i olika storlekar för tydlighetens skull.
Den unika sekvensen för varje protein bestäms i slutändan av den gen som kodar för proteinet. En förändring av nukleotidsekvensen i genens kodande region kan leda till att en annan aminosyra läggs till i den växande polypeptidkedjan, vilket orsakar en förändring av proteinets struktur och funktion. Vid sicklecellanemi har hemoglobin β-kedjan (varav en liten del visas i figur 5) ett enda aminosyrabyte, vilket orsakar en förändring i proteinets struktur och funktion.
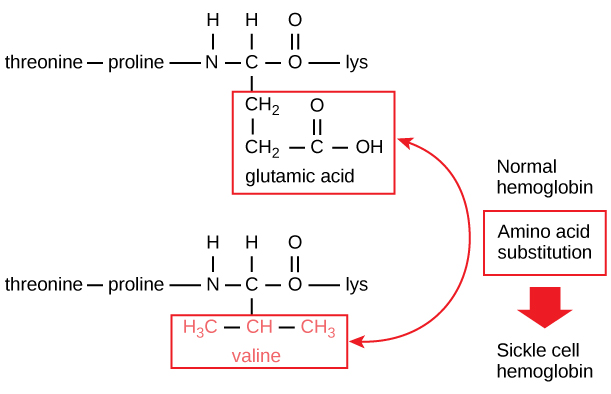
Figur 5. Betakedjan i hemoglobin är 147 rester lång, men en enda aminosyrasubstitution leder till sicklecellanemi. I normalt hemoglobin är aminosyran i position sju glutamat. I sicklecellshämoglobin ersätts denna glutamat av en valin.
Specifikt är aminosyran glutaminsyra utbytt mot valin i β-kedjan. Det mest anmärkningsvärda att tänka på är att en hemoglobinmolekyl består av två alfakedjor och två betakedjor som var och en består av cirka 150 aminosyror. Molekylen har därför omkring 600 aminosyror. Den strukturella skillnaden mellan en normal hemoglobinmolekyl och en sicklecellmolekyl – som dramatiskt minskar den förväntade livslängden – är en enda aminosyra av de 600. Vad som är ännu mer anmärkningsvärt är att dessa 600 aminosyror kodas av tre nukleotider vardera och att mutationen orsakas av en enda basförändring (punktmutation), 1 på 1800 baser.
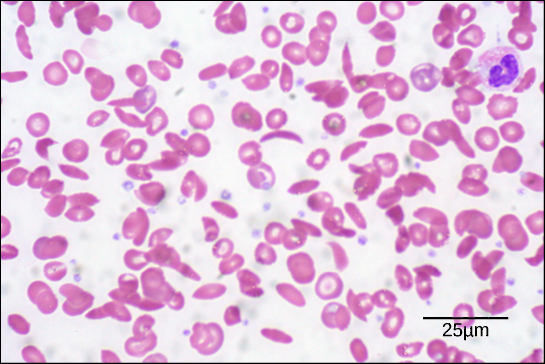
Figur 6. I detta blodutstryk, visualiserat vid 535x förstoring med hjälp av ljusfältsmikroskopi, är sicklecellerna halvmåneformade, medan normala celler är skivformade. (kredit: modifiering av arbete av Ed Uthman; data från Matt Russell)
På grund av denna förändring av en aminosyra i kedjan bildar hemoglobinmolekylerna långa fibrer som förvränger de bikonkava eller skivformade röda blodkropparna och antar en halvmåne- eller ”sickle”-form, vilket täpper till artärerna (figur 6). Detta kan leda till otaliga allvarliga hälsoproblem som andfåddhet, yrsel, huvudvärk och buksmärtor för dem som drabbas av denna sjukdom.
Sekundärstruktur
Den lokala veckningen av polypeptiden i vissa regioner ger upphov till proteinets sekundärstruktur. De vanligaste är strukturerna α-helix och β-plisserat ark (figur 7). Båda strukturerna är α-helixstrukturen – helixen hålls i form av vätebindningar. Vätgasbindningarna bildas mellan syreatomen i karbonylgruppen i en aminosyra och en annan aminosyra som befinner sig fyra aminosyror längre bort i kedjan.
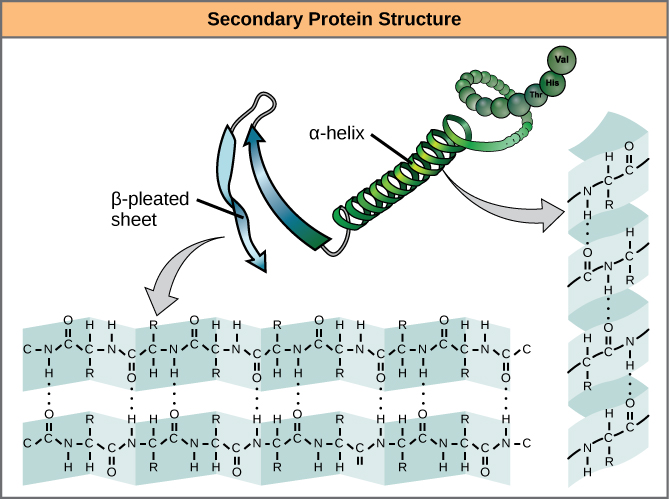
Figur 7. α-helixen och β-plissé är sekundärstrukturer hos proteiner som bildas på grund av vätebindning mellan karbonyl- och aminogrupper i peptidryggen. Vissa aminosyror har en benägenhet att bilda en α-helix, medan andra har en benägenhet att bilda ett β-plisserat ark.
Varje spiralsväng i en alfahelix har 3,6 aminosyrarester. R-grupperna (variantgrupperna) i polypeptiden sticker ut från α-helixkedjan. I β-helixen bildas ”veck” genom vätebindning mellan atomer på polypeptidkedjans ryggrad. R-grupperna är knutna till kolvätena och sträcker sig över och under veckets veck. De veckade segmenten är parallella eller antiparallella till varandra, och vätebindningar bildas mellan den delvis positiva kväveatomen i aminogruppen och den delvis negativa syreatomen i karbonylgruppen i peptidstommen. α-helix- och β-plisserade arkstrukturer finns i de flesta globulära och fibrösa proteiner och de spelar en viktig strukturell roll.
Tertiärstruktur
Den unika tredimensionella strukturen hos en polypeptid är dess tertiärstruktur (figur 8). Denna struktur beror delvis på kemiska interaktioner som verkar på polypeptidkedjan. Främst är det interaktionerna mellan R-grupperna som skapar den komplexa tredimensionella tertiärstrukturen hos ett protein. Karaktären på de R-grupper som finns i de berörda aminosyrorna kan motverka bildandet av de vätebindningar som beskrivs för standardsekundärstrukturer. Exempelvis stöts R-grupper med likadana laddningar bort från varandra och R-grupper med olikartade laddningar dras till varandra (joniska bindningar). När proteinveckningen äger rum ligger de hydrofoba R-grupperna hos opolära aminosyror i proteinets inre, medan de hydrofila R-grupperna ligger på utsidan. De förstnämnda typerna av interaktioner kallas också hydrofoba interaktioner. Interaktion mellan cysteinsidekedjor bildar disulfidlänkar i närvaro av syre, den enda kovalenta bindning som bildas under proteinveckningen.
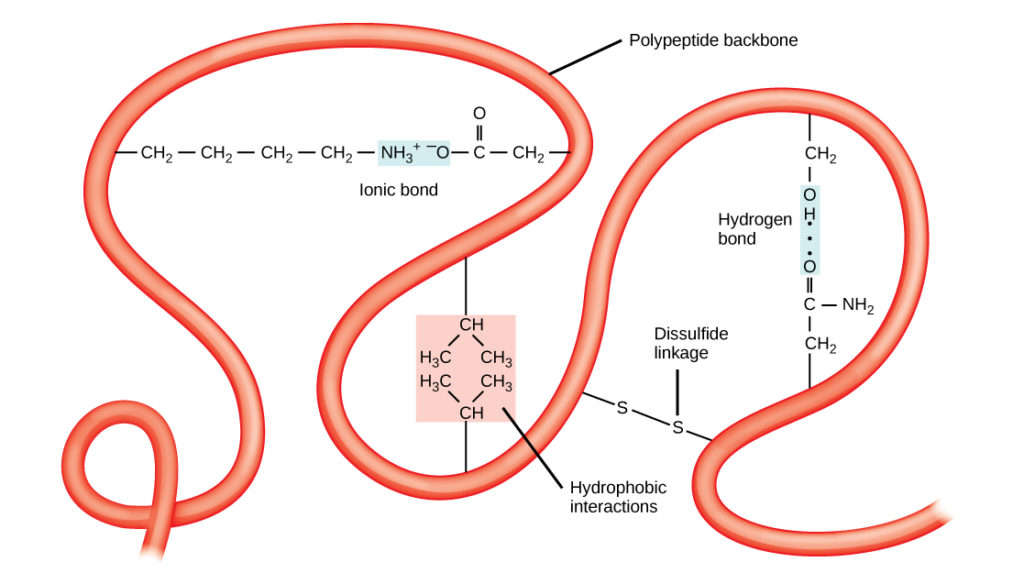
Figur 8. Proteinernas tertiärstruktur bestäms av en rad olika kemiska interaktioner. Dessa inkluderar hydrofoba interaktioner, joniska bindningar, vätebindningar och disulfidlänkar.
Alla dessa interaktioner, svaga och starka, bestämmer proteinets slutliga tredimensionella form. När ett protein förlorar sin tredimensionella form kan det vara funktionellt.
Kvartärstruktur
I naturen bildas vissa proteiner av flera polypeptider, även kallade subenheter, och interaktionen mellan dessa subenheter bildar den kvartära strukturen. Svaga interaktioner mellan underenheterna bidrar till att stabilisera den övergripande strukturen. Till exempel har insulin (ett globulärt protein) en kombination av vätebindningar och disulfidbindningar som gör att det mestadels klumpas ihop till en bollform. Insulin börjar som en enda polypeptid och förlorar vissa interna sekvenser i närvaro av posttranslationell modifiering efter bildandet av de disulfidbindningar som håller ihop de återstående kedjorna. Silke (ett fibröst protein) har däremot en β-plisserad bladstruktur som är resultatet av vätebindning mellan olika kedjor.
De fyra nivåerna av proteinstruktur (primär, sekundär, tertiär och kvartär) illustreras i figur 9.
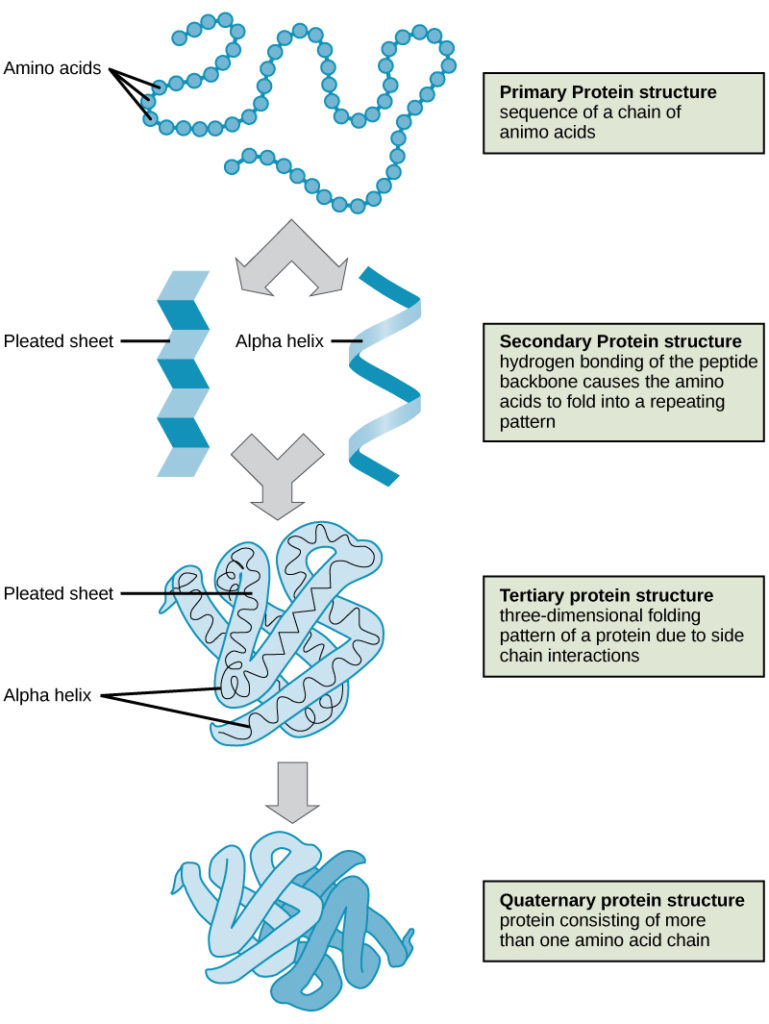
Figur 9. De fyra nivåerna av proteinstruktur kan observeras i dessa illustrationer. (kredit: modifiering av arbete av National Human Genome Research Institute)
Denaturering och proteinveckning
Varje protein har sin egen unika sekvens och form som hålls samman av kemiska interaktioner. Om proteinet utsätts för förändringar i temperatur, pH eller exponering för kemikalier kan proteinstrukturen förändras och förlora sin form utan att förlora sin primära sekvens i det som kallas denaturering. Denaturering är ofta reversibel eftersom polypeptidens primära struktur bevaras i processen om denatureringsmedlet avlägsnas, vilket gör att proteinet kan återuppta sin funktion. Ibland är denatureringen irreversibel, vilket leder till förlust av funktion. Ett exempel på irreversibel proteindenaturering är när ett ägg steks. Albuminproteinet i den flytande äggvitan denatureras när det placeras i en het panna. Alla proteiner denatureras inte vid höga temperaturer; till exempel har bakterier som överlever i varma källor proteiner som fungerar vid temperaturer nära kokpunkten. Magsäcken är också mycket sur, har ett lågt pH och denaturerar proteiner som en del av matsmältningsprocessen; matsmältningsenzymerna i magsäcken behåller dock sin aktivitet under dessa förhållanden.
Proteinveckning är avgörande för dess funktion. Man trodde ursprungligen att proteinerna själva var ansvariga för veckningsprocessen. Först nyligen upptäckte man att de ofta får hjälp i vikningsprocessen av proteinhjälpare som kallas chaperoner (eller chaperoniner) som associerar sig med målproteinet under vikningsprocessen. De verkar genom att förhindra aggregering av polypeptider som utgör den kompletta proteinstrukturen, och de separerar från proteinet när målproteinet är veckat.
Proteinernas funktion
De primära typerna av proteiner och deras funktioner anges i tabell 1.
| Tabell 1. Proteintyper och funktioner | ||
|---|---|---|
| Typ | Exempel | Funktioner |
| Förtärande enzymer | Amylas, lipas, pepsin, trypsin | Hjälper till vid matsmältningen genom att katabolisera näringsämnen till monomera enheter |
| Transport | Hemoglobin, albumin | Transporterar ämnen i blodet eller lymfan genom hela kroppen |
| Strukturellt | Aktin, tubulin, keratin | Bygger upp olika strukturer, t.ex. cytoskelettet |
| Hormoner | Insulin, Thyroxin | Koordinera aktiviteten i olika kroppssystem |
| Försvar | Immunoglobuliner | Beskyddar kroppen från främmande patogener |
| Kontraktilt | Aktin, myosin | Förverkar muskelkontraktion |
| Lagring | Lagringsproteiner från lökar, äggvita (albumin) | Försörjer näring vid tidig utveckling av embryot och fröplantagen |
Två speciella och vanliga typer av proteiner är enzymer och hormoner. Enzymer, som produceras av levande celler, är katalysatorer i biokemiska reaktioner (som matsmältning) och är vanligtvis komplexa eller konjugerade proteiner. Varje enzym är specifikt för det substrat (en reaktant som binder till ett enzym) som det verkar på. Enzymet kan hjälpa till vid nedbrytnings-, omarrangemangs- eller syntesreaktioner. Enzymer som bryter ner sina substrat kallas katabola enzymer, enzymer som bygger upp mer komplexa molekyler från sina substrat kallas anabola enzymer och enzymer som påverkar reaktionshastigheten kallas katalytiska enzymer. Det bör noteras att alla enzymer ökar reaktionshastigheten och därför anses vara organiska katalysatorer. Ett exempel på ett enzym är salivamylas, som hydrolyserar sitt substrat amylos, en komponent i stärkelse.
Hormoner är kemiska signalmolekyler, vanligen små proteiner eller steroider, som utsöndras av endokrina celler och som verkar för att kontrollera eller reglera specifika fysiologiska processer, inklusive tillväxt, utveckling, metabolism och reproduktion. Insulin är till exempel ett proteinhormon som hjälper till att reglera blodglukosnivån.
Proteiner har olika former och molekylvikter; vissa proteiner är globulära till formen medan andra är fibrösa till sin natur. Till exempel är hemoglobin ett globulärt protein, men kollagen, som finns i vår hud, är ett fibröst protein. Proteinets form är avgörande för dess funktion, och denna form upprätthålls av många olika typer av kemiska bindningar. Förändringar i temperatur, pH-värde och exponering för kemikalier kan leda till permanenta förändringar i proteinets form, vilket leder till förlust av funktion, så kallad denaturering. Alla proteiner består av olika arrangemang av samma 20 typer av aminosyror.
I sammanfattning: Proteiner
Proteiner är en klass av makromolekyler som utför en mängd olika funktioner för cellen. De bidrar till ämnesomsättningen genom att ge strukturellt stöd och genom att fungera som enzymer, bärare eller hormoner. Proteinernas byggstenar (monomerer) är aminosyror. Varje aminosyra har ett centralt kol som är kopplat till en aminogrupp, en karboxylgrupp, en väteatom och en R-grupp eller sidokedja. Det finns 20 vanligt förekommande aminosyror som alla skiljer sig åt i R-gruppen. Varje aminosyra är kopplad till sina grannar genom en peptidbindning. En lång kedja av aminosyror kallas en polypeptid.
Proteiner är organiserade på fyra nivåer: primära, sekundära, tertiära och (valfritt) kvartära. Den primära strukturen är den unika sekvensen av aminosyror. Den lokala veckningen av polypeptiden för att bilda strukturer som α-helixen och β-plisserade ark utgör den sekundära strukturen. Den övergripande tredimensionella strukturen är den tertiära strukturen. När två eller flera polypeptider kombineras för att bilda den fullständiga proteinstrukturen kallas konfigurationen för ett proteins kvartära struktur. Proteinets form och funktion är intimt sammankopplade; varje formförändring som orsakas av förändringar i temperatur eller pH kan leda till denaturering av proteinet och förlust av funktion.
Kontrollera din förståelse
Svara på frågan/frågorna nedan för att se hur väl du har förstått de ämnen som behandlades i föregående avsnitt. Den här korta frågesporten räknas inte in i ditt betyg i kursen och du kan göra om den ett obegränsat antal gånger.
Använd den här frågesporten för att kontrollera din förståelse och besluta om du ska (1) studera det föregående avsnittet ytterligare eller (2) gå vidare till nästa avsnitt.