- Descrieți structura și funcția proteinelor
- Obiective de învățare
- Aminoacizi
- Întrebare practică
- Semnificația evolutivă a citocromului c
- Structura proteinei
- Structura primară
- Structura secundară
- Structura terțiară
- Structura cuaternară
- Denaturarea și plierea proteinelor
- Funcția proteinelor
- În rezumat: Proteinele
- Controlați-vă înțelegerea
Descrieți structura și funcția proteinelor
Proteinele sunt polimeri de aminoacizi. Fiecare aminoacid conține un carbon central, un hidrogen, o grupare carboxil, o grupare amino și o grupare R variabilă. Grupa R specifică din ce clasă de aminoacizi face parte: lanțuri laterale hidrofile încărcate electric, lanțuri laterale polare dar neîncărcate, lanțuri laterale hidrofobe nepolare și cazuri speciale.
Proteinele au diferite „straturi” de structură: primară, secundară, terțiară, cuaternară.
Proteinele au o varietate de funcții în celule. Funcțiile majore includ acționarea ca enzime, receptori, molecule de transport, proteine de reglare a expresiei genelor și așa mai departe. Enzimele sunt catalizatori biologici care accelerează o reacție chimică fără a fi alterate permanent. Ele au „situsuri active” unde se leagă substratul/reactivul și pot fi fie activate, fie inhibate (inhibitori competitivi și/sau necompetitivi).
Obiective de învățare
- Demonstrați că sunteți familiarizați cu unitățile monomerice ale proteinelor: aminoacizii
- Definiți diferitele straturi ale structurii proteice
- Identificați câteva funcții majore ale proteinelor
Aminoacizi
Proteinele sunt una dintre cele mai abundente molecule organice din sistemele vii și au cea mai diversă gamă de funcții dintre toate macromoleculele. Proteinele pot fi structurale, reglatoare, contractile sau protectoare; ele pot servi la transport, depozitare sau membrane; sau pot fi toxine sau enzime. Fiecare celulă dintr-un sistem viu poate conține mii de proteine, fiecare cu o funcție unică. Structurile acestora, ca și funcțiile lor, variază foarte mult. Cu toate acestea, toate sunt polimeri de aminoacizi, aranjați într-o secvență liniară.

Figura 1. Aminoacizii au un carbon asimetric central de care sunt atașate o grupare amino, o grupare carboxil, un atom de hidrogen și o catenă laterală (grupa R).
Aminoacizii sunt monomerii care alcătuiesc proteinele. Fiecare aminoacid are aceeași structură fundamentală, care constă dintr-un atom de carbon central, cunoscut și sub numele de carbon alfa (α), legat de o grupare amino (NH2), de o grupare carboxil (COOH) și de un atom de hidrogen. Fiecare aminoacid are, de asemenea, un alt atom sau grup de atomi legat de atomul central, cunoscut sub numele de grupa R (figura 1).
Numele de „aminoacid” provine de la faptul că acestea conțin în structura lor de bază atât grupa amino, cât și grupa carboxil-acid. După cum s-a menționat, există 20 de aminoacizi prezenți în proteine. Zece dintre aceștia sunt considerați aminoacizi esențiali la om, deoarece organismul uman nu îi poate produce și sunt obținuți din alimentație.
Pentru fiecare aminoacid, grupa R (sau lanțul lateral) este diferită (figura 2).
Întrebare practică

Figura 2. Există 20 de aminoacizi comuni care se găsesc în mod obișnuit în proteine, fiecare cu o grupă R (grupa variantă) diferită care îi determină natura chimică.
Ce categorii de aminoacizi v-ați aștepta să găsiți la suprafața unei proteine solubile și care v-ați aștepta să găsiți în interior? Ce distribuție a aminoacizilor v-ați aștepta să găsiți într-o proteină înglobată într-un strat biliar lipidic?
Natura chimică a lanțului lateral determină natura aminoacidului (adică dacă este acid, bazic, polar sau nepolar). De exemplu, aminoacidul glicină are ca grup R un atom de hidrogen. Aminoacizii precum valina, metionina și alanina sunt de natură nepolară sau hidrofobă, în timp ce aminoacizii precum serina, treonina și cisteina sunt polari și au lanțuri laterale hidrofile. Lanțurile laterale ale lizinei și argininei sunt încărcate pozitiv și, prin urmare, acești aminoacizi sunt, de asemenea, cunoscuți ca aminoacizi bazici. Prolina are o grupare R care este legată de grupa amino, formând o structură asemănătoare unui inel. Prolina este o excepție de la structura standard a unui aminoacid, deoarece grupul său amino nu este separat de lanțul lateral (figura 2).
Aminoacizii sunt reprezentați printr-o singură literă majusculă sau printr-o abreviere din trei litere. De exemplu, valina este cunoscută prin litera V sau prin simbolul din trei litere val. La fel cum unii acizi grași sunt esențiali pentru o dietă, unii aminoacizi sunt și ei necesari. Aceștia sunt cunoscuți sub numele de aminoacizi esențiali, iar la om aceștia includ izoleucina, leucina și cisteina. Aminoacizii esențiali se referă la cei necesari pentru construcția proteinelor în organism, deși nu sunt produși de organism; ce aminoacizi sunt esențiali variază de la un organism la altul.

Figura 3. Formarea legăturii peptidice este o reacție de sinteză prin deshidratare. Grupa carboxil a unui aminoacid este legată de grupa amino a aminoacidului care vine. În acest proces, se eliberează o moleculă de apă.
Succesiunea și numărul de aminoacizi determină în cele din urmă forma, dimensiunea și funcția proteinei. Fiecare aminoacid este atașat de un alt aminoacid printr-o legătură covalentă, cunoscută sub numele de legătură peptidică, care se formează printr-o reacție de deshidratare. Grupa carboxil a unui aminoacid și grupa amino a aminoacidului care intră se combină, eliberând o moleculă de apă. Legătura rezultată este legătura peptidică (figura 3).
Produsele formate prin astfel de legături se numesc peptide. Pe măsură ce mai mulți aminoacizi se alătură acestui lanț în creștere, lanțul rezultat este cunoscut sub numele de polipeptidă. Fiecare polipeptidă are o grupare amino liberă la un capăt. Acest capăt se numește terminal N, sau terminal amino, iar celălalt capăt are o grupare carboxil liberă, cunoscută și sub numele de terminal C sau terminal carboxil. Deși termenii „polipeptidă” și „proteină” sunt uneori utilizați în mod interschimbabil, o polipeptidă este, din punct de vedere tehnic, un polimer de aminoacizi, în timp ce termenul „proteină” este utilizat pentru o polipeptidă sau mai multe polipeptide care s-au combinat între ele, au adesea grupări proteice nepeptidice legate, au o formă distinctă și au o funcție unică. După sinteza proteinelor (traducere), majoritatea proteinelor sunt modificate. Acestea sunt cunoscute sub denumirea de modificări post-translaționale. Acestea pot suferi scindare, fosforilare sau pot necesita adăugarea de alte grupe chimice. Numai după aceste modificări proteina este complet funcțională.
Semnificația evolutivă a citocromului c
Citocromul c este o componentă importantă a lanțului de transport al electronilor, o parte a respirației celulare, și se găsește în mod normal în organita celulară, mitocondria. Această proteină are o grupare protetică heme, iar ionul central al hemei se reduce și se oxidează alternativ în timpul transferului de electroni. Deoarece rolul acestei proteine esențiale în producerea energiei celulare este crucial, ea s-a schimbat foarte puțin de-a lungul a milioane de ani. Secvențierea proteinelor a arătat că există o cantitate considerabilă de homologie a secvenței de aminoacizi a citocromului c între diferite specii; cu alte cuvinte, rudenia evolutivă poate fi evaluată prin măsurarea asemănărilor sau diferențelor dintre secvențele de ADN sau de proteine ale diferitelor specii.
Cercetătorii au stabilit că citocromul c uman conține 104 aminoacizi. Pentru fiecare moleculă de citocrom c de la diferite organisme care a fost secvențiată până în prezent, 37 dintre acești aminoacizi apar în aceeași poziție în toate probele de citocrom c. Acest lucru indică faptul că este posibil să fi existat un strămoș comun. La compararea secvențelor proteice umane și ale cimpanzeilor, nu s-a constatat nicio diferență de secvență. Când au fost comparate secvențele umane și cele ale maimuțelor rhesus, singura diferență găsită a fost într-un singur aminoacid. Într-o altă comparație, secvențierea omului cu cea a drojdiei arată o diferență în poziția 44.
Structura proteinei
După cum s-a discutat anterior, forma unei proteine este esențială pentru funcția sa. De exemplu, o enzimă se poate lega de un substrat specific la un loc cunoscut sub numele de situs activ. Dacă acest situs activ este alterat din cauza unor modificări locale sau a unor modificări în structura generală a proteinei, enzima poate fi incapabilă să se lege de substrat. Pentru a înțelege modul în care proteina capătă forma sau conformația finală, trebuie să înțelegem cele patru niveluri ale structurii proteice: primară, secundară, terțiară și cuaternară.
Structura primară
Succesiunea unică de aminoacizi dintr-un lanț polipeptidic este structura sa primară. De exemplu, insulina, hormonul pancreatic, are două lanțuri polipeptidice, A și B, iar acestea sunt legate între ele prin legături disulfidice. Aminoacidul terminal N al lanțului A este glicina, în timp ce aminoacidul terminal C este asparagina (figura 4). Secvențele de aminoacizi din lanțurile A și B sunt unice pentru insulină.
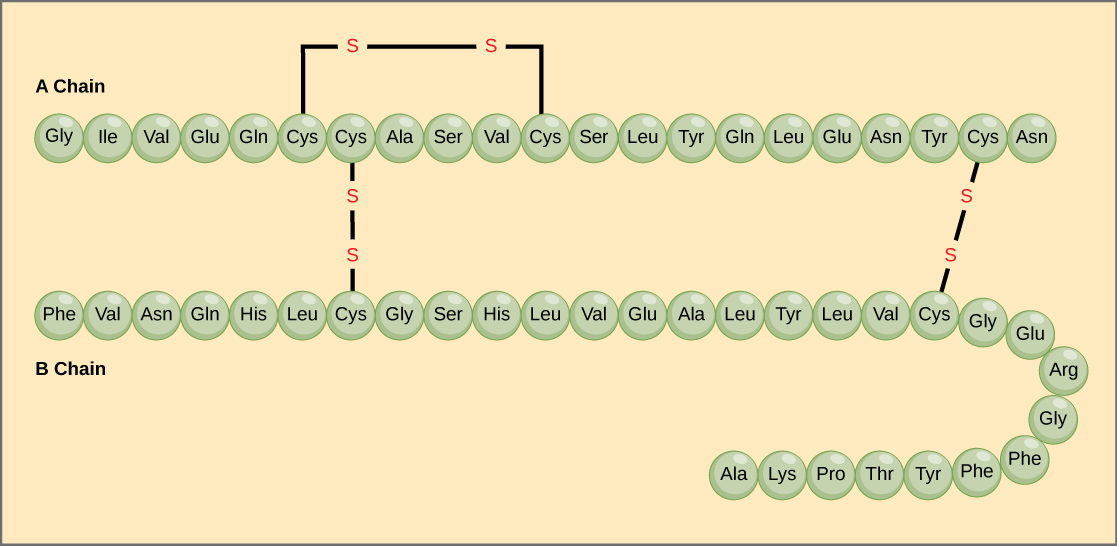
Figura 4. Insulina din serul bovin este un hormon proteic alcătuit din două lanțuri peptidice, A (cu o lungime de 21 aminoacizi) și B (cu o lungime de 30 aminoacizi). În fiecare lanț, structura primară este indicată prin abrevieri de trei litere care reprezintă numele aminoacizilor în ordinea în care sunt prezenți. Aminoacidul cisteină (cys) are o grupare sulfhidrilă (SH) ca lanț lateral. Două grupări sulfhidrilice pot reacționa în prezența oxigenului pentru a forma o legătură disulfură (S-S). Două legături disulfidice leagă lanțurile A și B între ele, iar o a treia ajută lanțul A să se plieze în forma corectă. Rețineți că toate legăturile disulfură au aceeași lungime, dar sunt desenate cu dimensiuni diferite pentru claritate.
Secvența unică pentru fiecare proteină este determinată în cele din urmă de gena care codifică proteina. O modificare a secvenței de nucleotide din regiunea codificatoare a genei poate duce la adăugarea unui aminoacid diferit în lanțul polipeptidic în creștere, provocând o schimbare în structura și funcția proteinei. În cazul anemiei cu celule secerătoare, lanțul β al hemoglobinei (o mică porțiune din care este prezentată în figura 5) are o singură substituție de aminoacizi, ceea ce determină o modificare a structurii și funcției proteice.
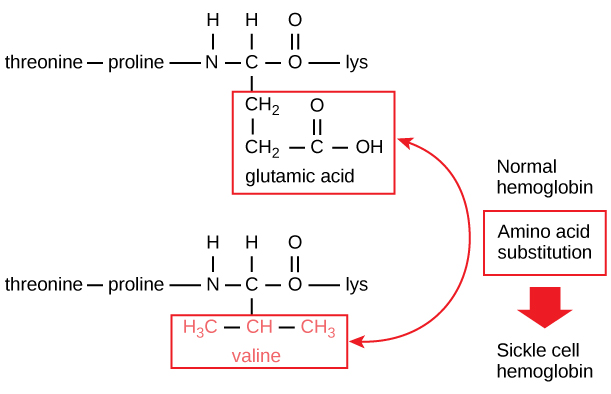
Figura 5. Lanțul beta al hemoglobinei are o lungime de 147 de reziduuri, dar o singură substituție de aminoacizi duce la anemia falciformă. În hemoglobina normală, aminoacidul din poziția șapte este glutamat. În hemoglobina cu celule falciforme, acest glutamat este înlocuit cu o valină.
În mod specific, aminoacidul acid glutamic este înlocuit cu valină în lanțul β. Ceea ce este cel mai remarcabil de luat în considerare este faptul că o moleculă de hemoglobină este alcătuită din două lanțuri alfa și două lanțuri beta care sunt formate fiecare din aproximativ 150 de aminoacizi. Prin urmare, molecula are aproximativ 600 de aminoacizi. Diferența structurală dintre o moleculă de hemoglobină normală și o moleculă de celule secerătoare – care scade dramatic speranța de viață – este un singur aminoacid din cei 600. Ceea ce este și mai remarcabil este faptul că acei 600 de aminoacizi sunt codificați de trei nucleotide fiecare, iar mutația este cauzată de o singură schimbare de bază (mutație punctiformă), 1 din 1800 de baze.
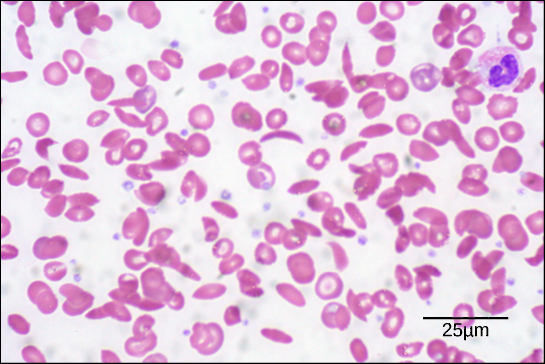
Figura 6. În acest frotiu de sânge, vizualizat la o mărire de 535x cu ajutorul microscopiei în câmp luminos, celulele secerătoare au formă de semilună, în timp ce celulele normale au formă de disc. (credit: modificare a lucrării lui Ed Uthman; date la scară de la Matt Russell)
Din cauza acestei modificări a unui aminoacid din lanț, moleculele de hemoglobină formează fibre lungi care distorsionează globulele roșii biconcave, sau în formă de disc, și iau o formă de semilună sau „seceră”, care înfundă arterele (figura 6). Acest lucru poate duce la o multitudine de probleme grave de sănătate, cum ar fi dificultăți de respirație, amețeli, dureri de cap și dureri abdominale pentru cei afectați de această boală.
Structura secundară
Plasarea locală a polipeptidei în unele regiuni dă naștere structurii secundare a proteinei. Cele mai frecvente sunt structurile de tip α-helix și foaie β-plecată (figura 7). Ambele structuri sunt structuri de tip α-helix – helixul menținut în formă prin legături de hidrogen. Legăturile de hidrogen se formează între atomul de oxigen din gruparea carbonil dintr-un aminoacid și un alt aminoacid care se află cu patru aminoacizi mai departe de-a lungul lanțului.
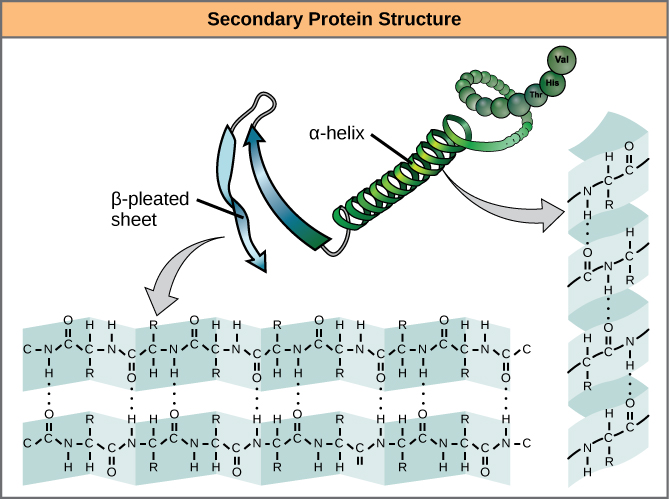
Figura 7. α-helixul și foaia β-plecată sunt structuri secundare ale proteinelor care se formează datorită legăturii de hidrogen între grupele carbonil și amino din coloana vertebrală peptidică. Anumiți aminoacizi au înclinația de a forma un α-helix, în timp ce alții au înclinația de a forma o foaie β-plecată.
Câte o spire elicoidală într-un alfa-helix are 3,6 resturi de aminoacizi. Grupele R (grupele variante) ale polipeptidei ies în afară din lanțul α-helix. În foaia β-plecată, „pliurile” sunt formate prin legături de hidrogen între atomii de pe coloana vertebrală a lanțului polipeptidic. Grupele R sunt atașate la carboni și se extind deasupra și dedesubtul pliurilor pliului. Segmentele plisate se aliniază paralel sau antiparalel unul față de celălalt, iar legăturile de hidrogen se formează între atomul de azot parțial pozitiv din gruparea amino și atomul de oxigen parțial negativ din gruparea carbonil din coloana vertebrală a peptidei. Structurile α-helix și foaie β-plecată se găsesc în majoritatea proteinelor globulare și fibroase și joacă un rol structural important.
Structura terțiară
Structura tridimensională unică a unei polipeptide este structura sa terțiară (figura 8). Această structură se datorează în parte interacțiunilor chimice care acționează la nivelul lanțului polipeptidic. În primul rând, interacțiunile dintre grupele R creează structura terțiară tridimensională complexă a unei proteine. Natura grupărilor R care se găsesc în aminoacizii implicați poate contracara formarea legăturilor de hidrogen descrise pentru structurile secundare standard. De exemplu, grupele R cu sarcini asemănătoare sunt respinse una de cealaltă, iar cele cu sarcini diferite sunt atrase una de cealaltă (legături ionice). Atunci când are loc plierea proteinelor, grupele R hidrofobe ale aminoacizilor nepolari se află în interiorul proteinei, în timp ce grupele R hidrofile se află în exterior. Primele tipuri de interacțiuni sunt cunoscute și sub denumirea de interacțiuni hidrofobe. Interacțiunea dintre lanțurile laterale ale cisteinei formează legături disulfidice în prezența oxigenului, singura legătură covalentă care se formează în timpul pliajului proteic.
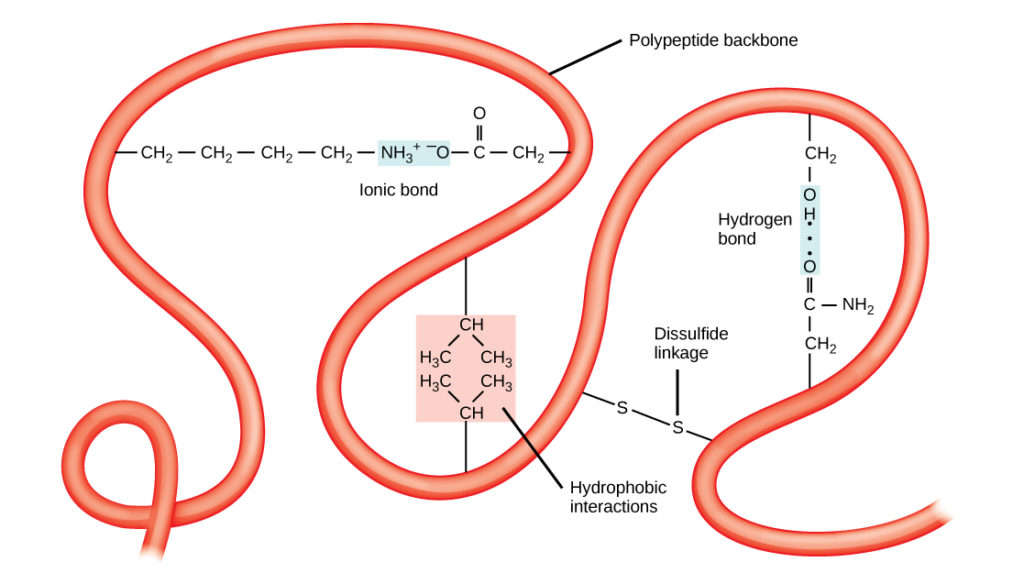
Figura 8. Structura terțiară a proteinelor este determinată de o varietate de interacțiuni chimice. Acestea includ interacțiuni hidrofobe, legături ionice, legături de hidrogen și legături disulfidice.
Toate aceste interacțiuni, slabe și puternice, determină forma tridimensională finală a proteinei. Atunci când o proteină își pierde forma tridimensională, este posibil ca aceasta să nu mai fie funcțională.
Structura cuaternară
În natură, unele proteine sunt formate din mai multe polipeptide, cunoscute și subunități, iar interacțiunea dintre aceste subunități formează structura cuaternară. Interacțiunile slabe dintre subunități contribuie la stabilizarea structurii globale. De exemplu, insulina (o proteină globulară) are o combinație de legături de hidrogen și legături disulfidice care o fac să fie în mare parte aglomerată în formă de bilă. Insulina pornește ca o singură polipeptidă și pierde unele secvențe interne în prezența modificării posttranslaționale după formarea legăturilor disulfidice care țin lanțurile rămase împreună. Mătasea (o proteină fibroasă), cu toate acestea, are o structură de foiță β-plecată care este rezultatul legăturii de hidrogen între diferite lanțuri.
Cele patru niveluri ale structurii proteice (primară, secundară, terțiară și cuaternară) sunt ilustrate în figura 9.
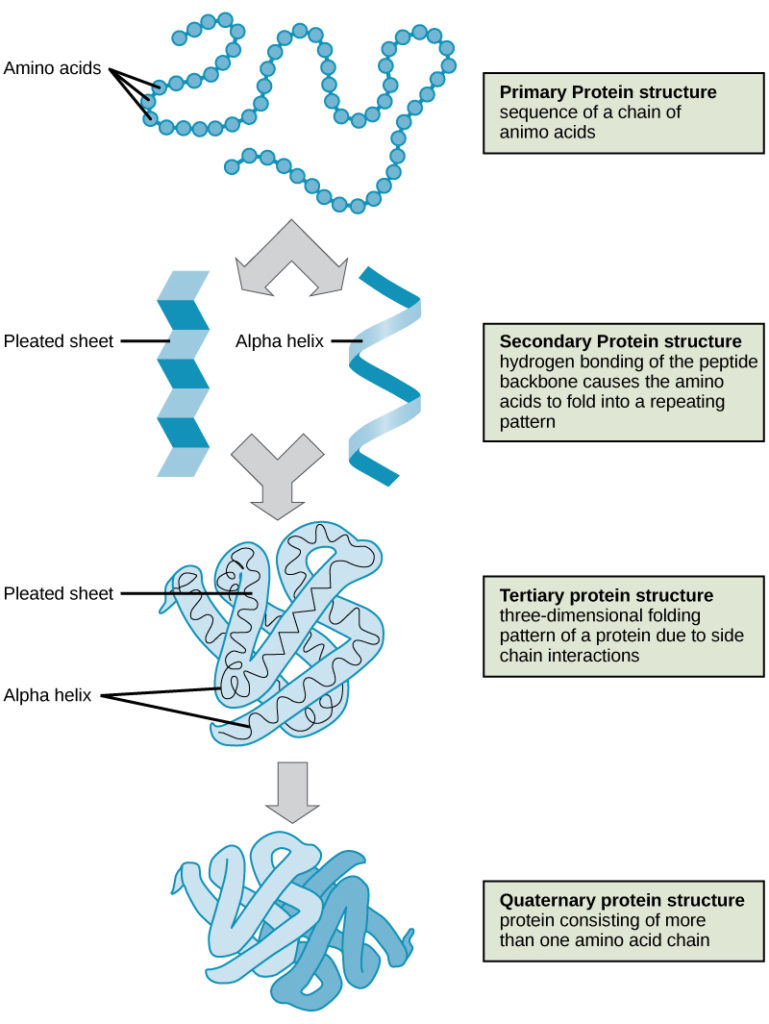
Figura 9. Structura proteinelor. Cele patru niveluri ale structurii proteice pot fi observate în aceste ilustrații. (credit: modificare a lucrării Institutului Național de Cercetare a Genomului Uman)
Denaturarea și plierea proteinelor
Care proteină are propria sa secvență și formă unică, care sunt ținute împreună prin interacțiuni chimice. Dacă proteina este supusă unor schimbări de temperatură, pH sau expunere la substanțe chimice, structura proteinei se poate schimba, pierzându-și forma fără a-și pierde secvența primară în ceea ce se numește denaturare. Denaturarea este adesea reversibilă, deoarece structura primară a polipeptidei se păstrează în acest proces dacă agentul denaturant este îndepărtat, permițând proteinei să își reia funcția. Uneori, denaturarea este ireversibilă, ceea ce duce la pierderea funcției. Un exemplu de denaturare ireversibilă a proteinelor este atunci când un ou este prăjit. Proteina albumină din albușul lichid al oului este denaturată atunci când este pusă într-o tigaie fierbinte. Nu toate proteinele sunt denaturate la temperaturi ridicate; de exemplu, bacteriile care supraviețuiesc în izvoarele fierbinți au proteine care funcționează la temperaturi apropiate de fierbere. De asemenea, stomacul este foarte acid, are un pH scăzut și denaturează proteinele ca parte a procesului de digestie; cu toate acestea, enzimele digestive ale stomacului își păstrează activitatea în aceste condiții.
Plasarea proteinelor este esențială pentru funcția lor. Inițial s-a crezut că proteinele însele sunt responsabile pentru procesul de pliere. Abia recent s-a constatat că adesea ele primesc asistență în procesul de pliere din partea unor ajutoare proteice cunoscute sub numele de chaperone (sau chaperonine) care se asociază cu proteina țintă în timpul procesului de pliere. Aceștia acționează prin prevenirea agregării polipeptidelor care alcătuiesc structura completă a proteinei și se disociază de proteină odată ce proteina țintă este pliată.
Funcția proteinelor
Tipurile și funcțiile principale ale proteinelor sunt enumerate în tabelul 1.
| Tabelul 1. Tipuri și funcții ale proteinelor | |||
|---|---|---|---|
| Tipul | Exemple | Funcții | |
| Enzimele digestive | Amilaza, lipază, pepsină, tripsină | Ajută la digestia alimentelor prin catabolizarea nutrienților în unități monomerice | |
| Transport | Hemoglobina, albumină | Transportul substanțelor din sânge sau limfă în tot corpul | |
| Structural | Actină, tubulină, cheratină | Construiesc diferite structuri, cum ar fi citoscheletul | |
| Hormoni | Insulină, tiroxina | Coordonează activitatea diferitelor sisteme ale organismului | |
| Defensivă | Imunoglobuline | Protejează organismul de agenții patogeni străini | |
| Contractilă | Actină, miozină | Efectuează contracția musculară | |
| Stocare | Proteinele de stocare a legumelor, albușul de ou (albumina) | Asigură hrana în dezvoltarea timpurie a embrionului și a răsadului | |
Două tipuri speciale și comune de proteine sunt enzimele și hormonii. Enzimele, care sunt produse de celulele vii, sunt catalizatori în reacțiile biochimice (cum ar fi digestia) și sunt, de obicei, proteine complexe sau conjugate. Fiecare enzimă este specifică pentru substratul (un reactant care se leagă de o enzimă) asupra căruia acționează. Enzima poate contribui la reacții de descompunere, rearanjare sau sinteză. Enzimele care își descompun substraturile se numesc enzime catabolice, enzimele care construiesc molecule mai complexe din substraturile lor se numesc enzime anabolice, iar enzimele care influențează viteza de reacție se numesc enzime catalitice. Trebuie remarcat faptul că toate enzimele măresc viteza de reacție și, prin urmare, sunt considerate catalizatori organici. Un exemplu de enzimă este amilaza salivară, care își hidrolizează substratul amiloză, o componentă a amidonului.
Hormonii sunt molecule de semnalizare chimică, de obicei proteine mici sau steroizi, secretate de celulele endocrine care acționează pentru a controla sau regla procese fiziologice specifice, inclusiv creșterea, dezvoltarea, metabolismul și reproducerea. De exemplu, insulina este un hormon proteic care ajută la reglarea nivelului de glucoză din sânge.
Proteinele au forme și greutăți moleculare diferite; unele proteine au formă globulară, în timp ce altele sunt de natură fibroasă. De exemplu, hemoglobina este o proteină globulară, dar colagenul, care se găsește în pielea noastră, este o proteină fibroasă. Forma proteinei este esențială pentru funcția sa, iar această formă este menținută de multe tipuri diferite de legături chimice. Modificările de temperatură, pH și expunerea la substanțe chimice pot duce la modificări permanente ale formei proteinei, ceea ce duce la pierderea funcției, cunoscută sub numele de denaturare. Toate proteinele sunt alcătuite din aranjamente diferite ale acelorași 20 de tipuri de aminoacizi.
În rezumat: Proteinele
Proteinele sunt o clasă de macromolecule care îndeplinesc o gamă diversă de funcții pentru celulă. Ele ajută la metabolism, oferind suport structural și acționând ca enzime, purtători sau hormoni. Elementele constitutive ale proteinelor (monomeri) sunt aminoacizii. Fiecare aminoacid are un carbon central care este legat de o grupare amino, o grupare carboxil, un atom de hidrogen și o grupare R sau un lanț lateral. Există 20 de aminoacizi care apar în mod obișnuit, fiecare dintre ei diferind prin grupul R. Fiecare aminoacid este legat de vecinii săi printr-o legătură peptidică. Un lanț lung de aminoacizi este cunoscut sub numele de polipeptidă.
Proteinele sunt organizate la patru niveluri: primar, secundar, terțiar și (opțional) cuaternar. Structura primară este reprezentată de secvența unică de aminoacizi. Plierea locală a polipeptidei pentru a forma structuri cum ar fi helixul α și foaia β-plecată constituie structura secundară. Structura tridimensională globală este structura terțiară. Atunci când două sau mai multe polipeptide se combină pentru a forma structura proteică completă, configurația este cunoscută sub numele de structura cuaternară a unei proteine. Forma și funcția proteinelor sunt strâns legate; orice modificare a formei cauzată de schimbările de temperatură sau de pH poate duce la denaturarea proteinelor și la pierderea funcției.
Controlați-vă înțelegerea
Răspundeți la întrebarea (întrebările) de mai jos pentru a vedea cât de bine ați înțeles subiectele abordate în secțiunea anterioară. Acest test scurt nu contează pentru nota dumneavoastră la curs și îl puteți relua de un număr nelimitat de ori.
Utilizați acest test pentru a vă verifica înțelegerea și pentru a decide dacă (1) să studiați în continuare secțiunea anterioară sau (2) să treceți la secțiunea următoare.
.