- Beschreiben Sie die Struktur und Funktion von Proteinen
- Lernziele
- Aminosäuren
- Praxisfrage
- Die evolutionäre Bedeutung von Cytochrom c
- Proteinstruktur
- Primärstruktur
- Sekundärstruktur
- Tertiärstruktur
- Quaternäre Struktur
- Denaturierung und Proteinfaltung
- Funktion von Proteinen
- Zusammenfassung: Proteine
- Prüfen Sie Ihr Verständnis
Beschreiben Sie die Struktur und Funktion von Proteinen
Proteine sind Polymere aus Aminosäuren. Jede Aminosäure enthält einen zentralen Kohlenstoff, einen Wasserstoff, eine Carboxylgruppe, eine Aminogruppe und eine variable R-Gruppe. Die R-Gruppe gibt an, zu welcher Klasse von Aminosäuren sie gehört: elektrisch geladene hydrophile Seitenketten, polare, aber ungeladene Seitenketten, unpolare hydrophobe Seitenketten und Sonderfälle.
Proteine haben verschiedene „Schichten“ der Struktur: primär, sekundär, tertiär, quaternär.
Proteine haben eine Vielzahl von Funktionen in Zellen. Zu den wichtigsten Funktionen gehören die als Enzyme, Rezeptoren, Transportmoleküle, Regulierungsproteine für die Genexpression usw. Enzyme sind biologische Katalysatoren, die eine chemische Reaktion beschleunigen, ohne dauerhaft verändert zu werden. Sie haben „aktive Stellen“, an die sich das Substrat/Reaktionspartner bindet, und können entweder aktiviert oder gehemmt werden (kompetitive und/oder nichtkompetitive Hemmstoffe).
Lernziele
- Demonstrieren Sie Vertrautheit mit monomeren Einheiten von Proteinen: Aminosäuren
- Bestimmen Sie die verschiedenen Schichten der Proteinstruktur
- Identifizieren Sie mehrere Hauptfunktionen von Proteinen
Aminosäuren
Proteine sind eines der am häufigsten vorkommenden organischen Moleküle in lebenden Systemen und haben von allen Makromolekülen das vielfältigste Funktionsspektrum. Proteine können strukturelle, regulatorische, kontraktile oder schützende Funktionen haben; sie können Transport-, Speicher- oder Membranfunktionen erfüllen; oder sie können Toxine oder Enzyme sein. Jede Zelle in einem lebenden System kann Tausende von Proteinen enthalten, von denen jedes eine einzigartige Funktion hat. Ihre Strukturen sind ebenso wie ihre Funktionen sehr unterschiedlich. Sie sind jedoch alle Polymere aus Aminosäuren, die in einer linearen Sequenz angeordnet sind.

Abbildung 1. Aminosäuren haben einen zentralen asymmetrischen Kohlenstoff, an den eine Aminogruppe, eine Carboxylgruppe, ein Wasserstoffatom und eine Seitenkette (R-Gruppe) gebunden sind.
Aminosäuren sind die Monomere, aus denen Proteine bestehen. Jede Aminosäure hat die gleiche Grundstruktur, die aus einem zentralen Kohlenstoffatom besteht, das auch als Alpha-Kohlenstoff (α) bezeichnet wird und an eine Aminogruppe (NH2), eine Carboxylgruppe (COOH) und ein Wasserstoffatom gebunden ist. Jede Aminosäure hat außerdem ein weiteres Atom oder eine weitere Atomgruppe, die an das Zentralatom gebunden ist und als R-Gruppe bezeichnet wird (Abbildung 1).
Der Name „Aminosäure“ leitet sich von der Tatsache ab, dass sie sowohl eine Aminogruppe als auch eine Carboxylsäuregruppe in ihrer Grundstruktur enthalten. Wie bereits erwähnt, gibt es 20 Aminosäuren, die in Proteinen vorkommen. Zehn davon gelten als essentielle Aminosäuren für den Menschen, da der menschliche Körper sie nicht selbst herstellen kann und sie über die Nahrung aufgenommen werden müssen.
Für jede Aminosäure ist die R-Gruppe (oder Seitenkette) unterschiedlich (Abbildung 2).
Praxisfrage

Abbildung 2. Es gibt 20 übliche Aminosäuren, die in Proteinen vorkommen, jede mit einer anderen R-Gruppe (Variantengruppe), die ihre chemische Natur bestimmt.
Welche Kategorien von Aminosäuren würden Sie auf der Oberfläche eines löslichen Proteins erwarten, und welche würden Sie im Inneren erwarten? Welche Verteilung der Aminosäuren würden Sie bei einem in eine Lipiddoppelschicht eingebetteten Protein erwarten?
Die chemische Beschaffenheit der Seitenkette bestimmt die Beschaffenheit der Aminosäure (d. h. ob sie sauer, basisch, polar oder unpolar ist). Die Aminosäure Glycin zum Beispiel hat ein Wasserstoffatom als R-Gruppe. Aminosäuren wie Valin, Methionin und Alanin sind von Natur aus unpolar oder hydrophob, während Aminosäuren wie Serin, Threonin und Cystein polar sind und hydrophile Seitenketten haben. Die Seitenketten von Lysin und Arginin sind positiv geladen, so dass diese Aminosäuren auch als basische Aminosäuren bezeichnet werden. Prolin hat eine R-Gruppe, die mit der Aminogruppe verbunden ist und eine ringförmige Struktur bildet. Prolin ist eine Ausnahme von der Standardstruktur einer Aminosäure, da seine Aminogruppe nicht von der Seitenkette getrennt ist (Abbildung 2).
Aminosäuren werden durch einen einzelnen Großbuchstaben oder eine Abkürzung mit drei Buchstaben dargestellt. Valin wird zum Beispiel mit dem Buchstaben V oder dem dreibuchstabigen Symbol val bezeichnet. So wie einige Fettsäuren für die Ernährung unentbehrlich sind, so sind auch einige Aminosäuren notwendig. Sie werden als essenzielle Aminosäuren bezeichnet, und beim Menschen gehören dazu Isoleucin, Leucin und Cystein. Essentielle Aminosäuren sind diejenigen, die für den Aufbau von Proteinen im Körper notwendig sind, obwohl sie vom Körper nicht selbst hergestellt werden; welche Aminosäuren essentiell sind, ist von Organismus zu Organismus unterschiedlich.

Abbildung 3. Die Bildung von Peptidbindungen ist eine Dehydratationssynthesereaktion. Die Carboxylgruppe einer Aminosäure wird mit der Aminogruppe der nachfolgenden Aminosäure verknüpft. Dabei wird ein Wassermolekül freigesetzt.
Die Reihenfolge und die Anzahl der Aminosäuren bestimmen letztendlich die Form, Größe und Funktion des Proteins. Jede Aminosäure ist mit einer anderen Aminosäure durch eine kovalente Bindung, die so genannte Peptidbindung, verbunden, die durch eine Dehydratisierungsreaktion entsteht. Die Carboxylgruppe der einen Aminosäure und die Aminogruppe der anderen Aminosäure verbinden sich und setzen ein Wassermolekül frei. Die daraus resultierende Bindung ist die Peptidbindung (Abbildung 3).
Die Produkte, die durch solche Bindungen entstehen, werden Peptide genannt. Wenn sich weitere Aminosäuren zu dieser wachsenden Kette gesellen, wird die entstehende Kette als Polypeptid bezeichnet. Jedes Polypeptid hat an einem Ende eine freie Aminogruppe. Dieses Ende wird als N-Ende oder Amino-Ende bezeichnet, während das andere Ende eine freie Carboxylgruppe aufweist, die auch als C-Ende oder Carboxyl-Ende bezeichnet wird. Obwohl die Begriffe Polypeptid und Protein manchmal austauschbar verwendet werden, ist ein Polypeptid technisch gesehen ein Polymer aus Aminosäuren, während der Begriff Protein für ein oder mehrere Polypeptide verwendet wird, die miteinander verbunden sind, oft prosthetische Nicht-Peptid-Gruppen gebunden haben, eine bestimmte Form aufweisen und eine einzigartige Funktion haben. Nach der Proteinsynthese (Translation) werden die meisten Proteine modifiziert. Diese werden als posttranslationale Modifikationen bezeichnet. Sie können gespalten oder phosphoryliert werden, oder es müssen andere chemische Gruppen hinzugefügt werden. Erst nach diesen Modifikationen ist das Protein vollständig funktionsfähig.
Die evolutionäre Bedeutung von Cytochrom c
Cytochrom c ist ein wichtiger Bestandteil der Elektronentransportkette, einem Teil der Zellatmung, und befindet sich normalerweise in der zellulären Organelle, dem Mitochondrium. Dieses Protein besitzt eine prosthetische Häm-Gruppe, und das zentrale Ion des Häm wird während des Elektronentransfers abwechselnd reduziert und oxidiert. Da dieses essenzielle Protein eine entscheidende Rolle bei der Energieerzeugung in der Zelle spielt, hat es sich im Laufe der Jahrmillionen kaum verändert. Die Sequenzierung von Proteinen hat gezeigt, dass die Aminosäuresequenz von Cytochrom c zwischen den verschiedenen Spezies in erheblichem Maße homolog ist; mit anderen Worten, die evolutionäre Verwandtschaft kann durch Messung der Ähnlichkeiten oder Unterschiede zwischen den DNA- oder Proteinsequenzen verschiedener Spezies beurteilt werden.
Wissenschaftler haben festgestellt, dass das menschliche Cytochrom c 104 Aminosäuren enthält. Bei jedem Cytochrom-c-Molekül aus verschiedenen Organismen, das bisher sequenziert wurde, erscheinen 37 dieser Aminosäuren in allen Cytochrom-c-Proben an der gleichen Stelle. Dies deutet darauf hin, dass es einen gemeinsamen Vorfahren gegeben haben könnte. Beim Vergleich der Proteinsequenzen von Mensch und Schimpanse wurde kein Sequenzunterschied festgestellt. Beim Vergleich der Sequenzen von Mensch und Rhesusaffe lag der einzige Unterschied in einer Aminosäure. Bei einem anderen Vergleich der Sequenzen von Mensch und Hefe wurde ein Unterschied in der 44. Position festgestellt.
Proteinstruktur
Wie bereits erwähnt, ist die Form eines Proteins entscheidend für seine Funktion. Zum Beispiel kann ein Enzym an ein bestimmtes Substrat an einer Stelle binden, die als aktive Stelle bezeichnet wird. Wenn diese aktive Stelle aufgrund lokaler Veränderungen oder Veränderungen in der Gesamtstruktur des Proteins verändert ist, kann das Enzym möglicherweise nicht mehr an das Substrat binden. Um zu verstehen, wie das Protein seine endgültige Form oder Konformation erhält, müssen wir die vier Ebenen der Proteinstruktur verstehen: Primär-, Sekundär-, Tertiär- und Quartärstruktur.
Primärstruktur
Die einzigartige Abfolge von Aminosäuren in einer Polypeptidkette ist ihre Primärstruktur. Das Bauchspeicheldrüsenhormon Insulin hat zum Beispiel zwei Polypeptidketten, A und B, die durch Disulfidbindungen miteinander verbunden sind. Die N-terminale Aminosäure der A-Kette ist Glycin, während die C-terminale Aminosäure Asparagin ist (Abbildung 4). Die Sequenzen der Aminosäuren in der A- und B-Kette sind einzigartig für Insulin.
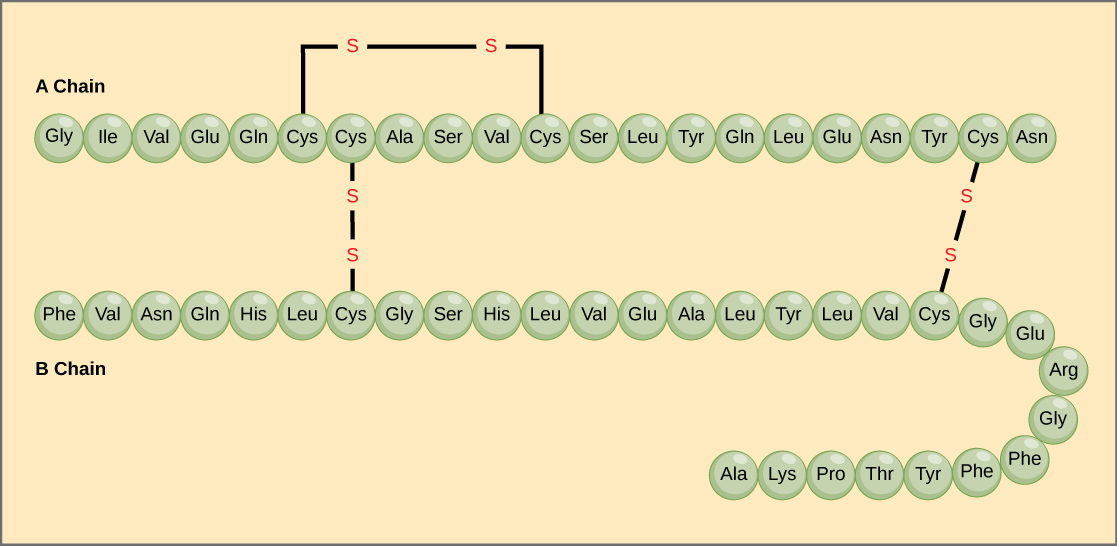
Abbildung 4. Rinderseruminsulin ist ein Proteinhormon, das aus zwei Peptidketten besteht, A (21 Aminosäuren lang) und B (30 Aminosäuren lang). In jeder Kette wird die Primärstruktur durch Abkürzungen mit drei Buchstaben angegeben, die die Namen der Aminosäuren in der Reihenfolge ihres Vorhandenseins darstellen. Die Aminosäure Cystein (cys) hat eine Sulfhydrylgruppe (SH) als Seitenkette. Zwei Sulfhydrylgruppen können in Gegenwart von Sauerstoff reagieren und eine Disulfidbindung (S-S) bilden. Zwei Disulfidbindungen verbinden die A- und B-Ketten miteinander, und eine dritte hilft der A-Kette, sich in die richtige Form zu falten. Beachten Sie, dass alle Disulfidbindungen die gleiche Länge haben, aber aus Gründen der Übersichtlichkeit unterschiedlich groß gezeichnet sind.
Die eindeutige Sequenz eines jeden Proteins wird letztlich durch das Gen bestimmt, das das Protein kodiert. Eine Veränderung der Nukleotidsequenz der kodierenden Region des Gens kann dazu führen, dass eine andere Aminosäure an die wachsende Polypeptidkette angefügt wird, was eine Veränderung der Proteinstruktur und -funktion zur Folge hat. Bei der Sichelzellanämie weist die β-Kette des Hämoglobins (ein kleiner Teil davon ist in Abbildung 5 dargestellt) eine einzige Aminosäuresubstitution auf, die eine Veränderung der Proteinstruktur und -funktion bewirkt.
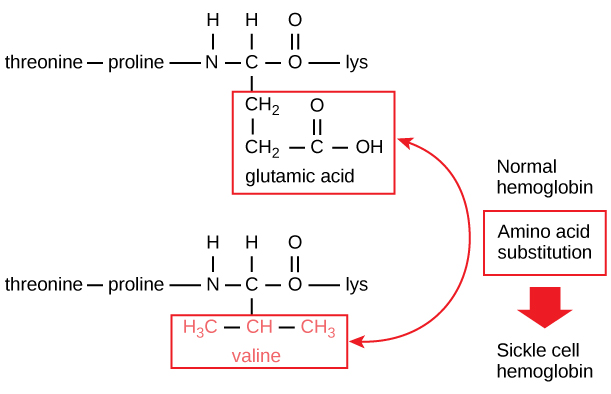
Abbildung 5. Die Beta-Kette des Hämoglobins ist 147 Reste lang, doch eine einzige Aminosäuresubstitution führt zur Sichelzellenanämie. In normalem Hämoglobin ist die Aminosäure an Position sieben Glutamat. Im Sichelzellenhämoglobin ist dieses Glutamat durch ein Valin ersetzt.
Die Aminosäure Glutaminsäure ist in der β-Kette durch Valin ersetzt. Bemerkenswert ist, dass ein Hämoglobinmolekül aus zwei Alphaketten und zwei Betaketten besteht, die jeweils aus etwa 150 Aminosäuren zusammengesetzt sind. Das Molekül hat also etwa 600 Aminosäuren. Der strukturelle Unterschied zwischen einem normalen Hämoglobinmolekül und einem Sichelzellmolekül – der die Lebenserwartung dramatisch verringert – besteht in einer einzigen Aminosäure der 600. Noch bemerkenswerter ist, dass diese 600 Aminosäuren von jeweils drei Nukleotiden kodiert werden und die Mutation durch eine einzige Basenveränderung (Punktmutation) verursacht wird, d.h. 1 von 1800 Basen.
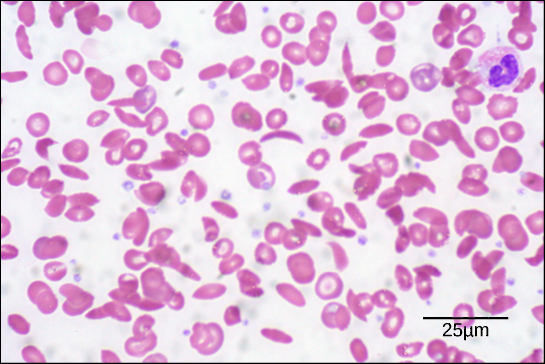
Abbildung 6. In diesem Blutausstrich, der bei 535-facher Vergrößerung mit Hilfe der Hellfeldmikroskopie sichtbar gemacht wurde, sind Sichelzellen halbmondförmig, während normale Zellen scheibenförmig sind. (Bildnachweis: Modifikation einer Arbeit von Ed Uthman; Daten für den Maßstabsbalken von Matt Russell)
Aufgrund dieser Veränderung einer Aminosäure in der Kette bilden die Hämoglobinmoleküle lange Fasern, die die bikonkaven oder scheibenförmigen roten Blutkörperchen verzerren und eine Halbmond- oder „Sichel“-Form annehmen, die die Arterien verstopft (Abbildung 6). Dies kann bei den Betroffenen zu einer Vielzahl schwerwiegender Gesundheitsprobleme wie Atemnot, Schwindel, Kopfschmerzen und Bauchschmerzen führen.
Sekundärstruktur
Die lokale Faltung des Polypeptids in einigen Regionen führt zur Sekundärstruktur des Proteins. Die häufigsten sind die α-Helix und die β-Faltblattstruktur (Abbildung 7). Bei beiden Strukturen handelt es sich um die α-Helix-Struktur – eine Helix, die durch Wasserstoffbrückenbindungen in Form gehalten wird. Die Wasserstoffbrückenbindungen entstehen zwischen dem Sauerstoffatom in der Carbonylgruppe einer Aminosäure und einer anderen Aminosäure, die vier Aminosäuren weiter in der Kette liegt.
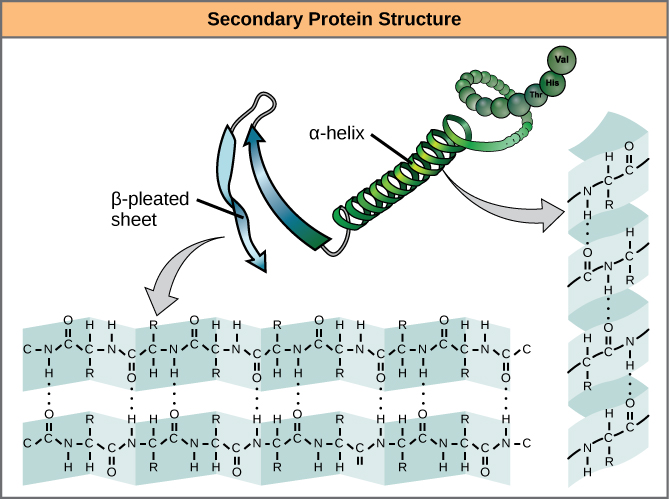
Abbildung 7. Die α-Helix und das β-Faltblatt sind Sekundärstrukturen von Proteinen, die sich aufgrund von Wasserstoffbrückenbindungen zwischen Carbonyl- und Aminogruppen im Peptidgerüst bilden. Bestimmte Aminosäuren neigen dazu, eine α-Helix zu bilden, während andere dazu neigen, ein β-Faltblatt zu bilden.
Jede helikale Windung in einer Alpha-Helix hat 3,6 Aminosäurereste. Die R-Gruppen (die Variantengruppen) des Polypeptids ragen aus der α-Helixkette heraus. Im β-Faltblatt werden die „Falten“ durch Wasserstoffbrückenbindungen zwischen den Atomen des Rückgrats der Polypeptidkette gebildet. Die R-Gruppen sind an die Kohlenstoffe gebunden und erstrecken sich über und unter den Falten des Faltenbogens. Die gefalteten Segmente richten sich parallel oder antiparallel zueinander aus, und es bilden sich Wasserstoffbrücken zwischen dem teilweise positiven Stickstoffatom in der Aminogruppe und dem teilweise negativen Sauerstoffatom in der Carbonylgruppe des Peptidrückgrats. Die α-Helix- und β-Faltblattstrukturen finden sich in den meisten globulären und faserigen Proteinen und spielen eine wichtige strukturelle Rolle.
Tertiärstruktur
Die einzigartige dreidimensionale Struktur eines Polypeptids ist seine Tertiärstruktur (Abbildung 8). Diese Struktur ist zum Teil auf die chemischen Wechselwirkungen in der Polypeptidkette zurückzuführen. In erster Linie sind es die Wechselwirkungen zwischen den R-Gruppen, die die komplexe dreidimensionale Tertiärstruktur eines Proteins erzeugen. Die Art der R-Gruppen in den beteiligten Aminosäuren kann der Bildung von Wasserstoffbrückenbindungen entgegenwirken, wie sie für Standard-Sekundärstrukturen beschrieben werden. So stoßen sich beispielsweise R-Gruppen mit gleichen Ladungen voneinander ab und solche mit ungleichen Ladungen ziehen sich gegenseitig an (Ionenbindungen). Bei der Proteinfaltung liegen die hydrophoben R-Gruppen unpolarer Aminosäuren im Inneren des Proteins, während die hydrophilen R-Gruppen an der Außenseite liegen. Die erstgenannten Arten von Wechselwirkungen werden auch als hydrophobe Wechselwirkungen bezeichnet. Die Wechselwirkung zwischen Cystein-Seitenketten bildet in Gegenwart von Sauerstoff Disulfidbindungen, die einzige kovalente Bindung, die während der Proteinfaltung entsteht.
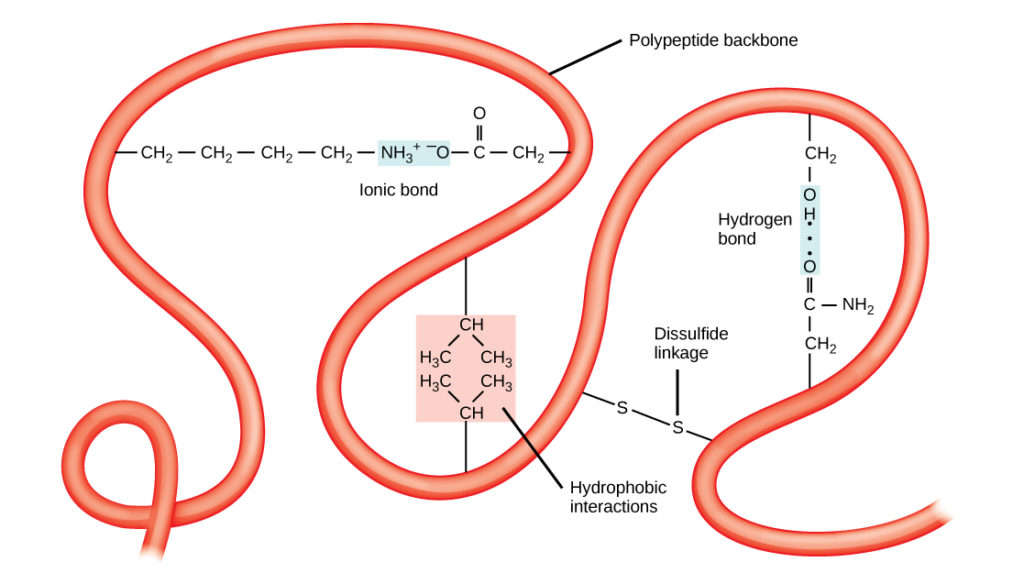
Abbildung 8. Die Tertiärstruktur von Proteinen wird durch eine Vielzahl von chemischen Wechselwirkungen bestimmt. Dazu gehören hydrophobe Wechselwirkungen, Ionenbindungen, Wasserstoffbrückenbindungen und Disulfidbindungen.
Alle diese Wechselwirkungen, ob schwach oder stark, bestimmen die endgültige dreidimensionale Form des Proteins. Wenn ein Protein seine dreidimensionale Form verliert, ist es möglicherweise nicht mehr funktionsfähig.
Quaternäre Struktur
In der Natur werden einige Proteine aus mehreren Polypeptiden gebildet, die auch als Untereinheiten bezeichnet werden, und das Zusammenspiel dieser Untereinheiten bildet die quaternäre Struktur. Schwache Wechselwirkungen zwischen den Untereinheiten tragen zur Stabilisierung der Gesamtstruktur bei. Insulin (ein kugelförmiges Protein) hat beispielsweise eine Kombination aus Wasserstoffbrücken und Disulfidbindungen, die dafür sorgen, dass es größtenteils zu einer Kugelform verklumpt ist. Insulin beginnt als einzelnes Polypeptid und verliert einige interne Sequenzen durch posttranslationale Modifikationen nach der Bildung der Disulfidbindungen, die die restlichen Ketten zusammenhalten. Seide (ein Faserprotein) hingegen hat eine β-faltige Blattstruktur, die das Ergebnis von Wasserstoffbrückenbindungen zwischen verschiedenen Ketten ist.
Die vier Ebenen der Proteinstruktur (primär, sekundär, tertiär und quaternär) sind in Abbildung 9 dargestellt.
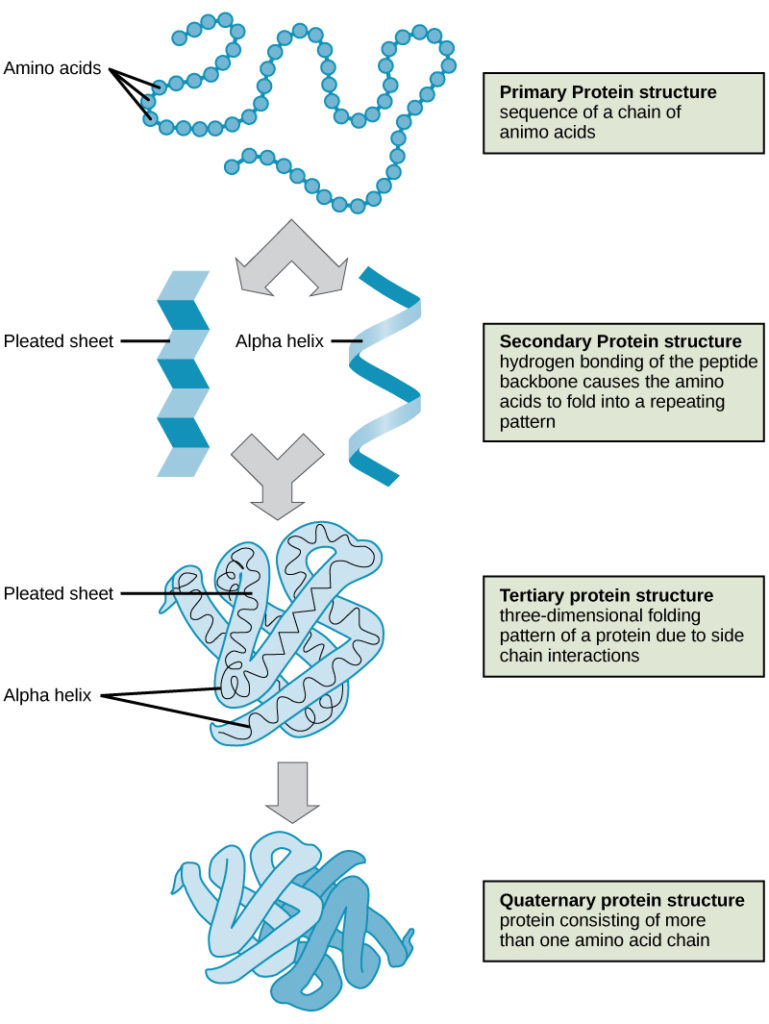
Abbildung 9. Die vier Ebenen der Proteinstruktur sind in diesen Abbildungen zu sehen. (credit: modification of work by National Human Genome Research Institute)
Denaturierung und Proteinfaltung
Jedes Protein hat seine eigene einzigartige Sequenz und Form, die durch chemische Wechselwirkungen zusammengehalten werden. Wenn das Protein Temperatur- oder pH-Änderungen unterliegt oder Chemikalien ausgesetzt ist, kann sich die Proteinstruktur ändern und ihre Form verlieren, ohne dass die Primärsequenz verloren geht (so genannte Denaturierung). Die Denaturierung ist häufig reversibel, da die Primärstruktur des Polypeptids bei diesem Prozess erhalten bleibt, wenn das Denaturierungsmittel entfernt wird, so dass das Protein seine Funktion wieder aufnehmen kann. Manchmal ist die Denaturierung irreversibel und führt zum Verlust der Funktion. Ein Beispiel für eine irreversible Proteindenaturierung ist das Braten eines Eies. Das Albuminprotein im flüssigen Eiweiß wird denaturiert, wenn es in eine heiße Pfanne gelegt wird. Nicht alle Proteine werden bei hohen Temperaturen denaturiert; Bakterien, die in heißen Quellen überleben, haben beispielsweise Proteine, die bei Temperaturen nahe dem Siedepunkt funktionieren. Der Magen ist ebenfalls sehr sauer, hat einen niedrigen pH-Wert und denaturiert Proteine als Teil des Verdauungsprozesses; die Verdauungsenzyme des Magens behalten jedoch unter diesen Bedingungen ihre Aktivität.
Die Faltung von Proteinen ist entscheidend für ihre Funktion. Ursprünglich dachte man, dass die Proteine selbst für den Faltungsprozess verantwortlich sind. Erst in jüngster Zeit hat man herausgefunden, dass sie beim Faltungsprozess häufig von Proteinhelfern, den so genannten Chaperonen (oder Chaperoninen), unterstützt werden, die sich während des Faltungsprozesses mit dem Zielprotein verbinden. Sie verhindern die Aggregation der Polypeptide, aus denen die vollständige Proteinstruktur besteht, und lösen sich vom Protein, sobald das Zielprotein gefaltet ist.
Funktion von Proteinen
Die wichtigsten Arten und Funktionen von Proteinen sind in Tabelle 1 aufgeführt.
| Tabelle 1. Proteintypen und Funktionen | ||
|---|---|---|
| Typ | Beispiele | Funktionen |
| Verdauungsenzyme | Amylase, Lipase, Pepsin, Trypsin | Hilfe bei der Verdauung der Nahrung durch Abbau der Nährstoffe in monomere Einheiten |
| Transport | Hämoglobin, Albumin | Transport von Substanzen im Blut oder in der Lymphe durch den Körper |
| Strukturaufbau | Actin, Tubulin, Keratin | Aufbau verschiedener Strukturen, wie das Zytoskelett |
| Hormone | Insulin, Thyroxin | Koordinieren die Aktivität verschiedener Körpersysteme |
| Abwehr | Immunoglobuline | Schützen den Körper vor fremden Krankheitserregern |
| Kontraktil | Actin, Myosin | Bewirken Muskelkontraktion |
| Speicherproteine | Speicherproteine von Hülsenfrüchten, Eiklar (Albumin) | Sorgen für die Ernährung in der frühen Entwicklung des Embryos und des Keimlings |
Zwei besondere und häufige Arten von Proteinen sind Enzyme und Hormone. Enzyme, die von lebenden Zellen produziert werden, sind Katalysatoren bei biochemischen Reaktionen (wie der Verdauung) und sind in der Regel komplexe oder konjugierte Proteine. Jedes Enzym ist spezifisch für das Substrat (ein Reaktionspartner, der sich an ein Enzym bindet), auf das es wirkt. Das Enzym kann bei Abbau-, Umlagerungs- oder Synthesereaktionen helfen. Enzyme, die ihre Substrate abbauen, werden als katabole Enzyme bezeichnet, Enzyme, die aus ihren Substraten komplexere Moleküle aufbauen, als anabole Enzyme, und Enzyme, die die Reaktionsgeschwindigkeit beeinflussen, als katalytische Enzyme. Es sei darauf hingewiesen, dass alle Enzyme die Reaktionsgeschwindigkeit erhöhen und daher als organische Katalysatoren betrachtet werden. Ein Beispiel für ein Enzym ist die Speichelamylase, die ihr Substrat Amylose, einen Bestandteil von Stärke, hydrolysiert.
Hormone sind chemische Signalmoleküle, in der Regel kleine Proteine oder Steroide, die von endokrinen Zellen ausgeschieden werden und bestimmte physiologische Prozesse, einschließlich Wachstum, Entwicklung, Stoffwechsel und Fortpflanzung, steuern oder regulieren. Insulin ist beispielsweise ein Proteinhormon, das zur Regulierung des Blutzuckerspiegels beiträgt.
Proteine haben unterschiedliche Formen und Molekulargewichte; einige Proteine haben eine kugelförmige Gestalt, während andere faserförmig sind. Zum Beispiel ist Hämoglobin ein kugelförmiges Protein, während Kollagen, das in unserer Haut vorkommt, ein faseriges Protein ist. Die Form eines Proteins ist entscheidend für seine Funktion, und diese Form wird durch viele verschiedene Arten von chemischen Bindungen aufrechterhalten. Temperatur- und pH-Änderungen sowie die Einwirkung von Chemikalien können zu dauerhaften Veränderungen der Proteinform führen, was einen Funktionsverlust zur Folge hat, der als Denaturierung bezeichnet wird. Alle Proteine bestehen aus unterschiedlichen Anordnungen der gleichen 20 Arten von Aminosäuren.
Zusammenfassung: Proteine
Proteine sind eine Klasse von Makromolekülen, die eine Vielzahl von Funktionen in der Zelle erfüllen. Sie helfen beim Stoffwechsel, indem sie die Struktur unterstützen und als Enzyme, Träger oder Hormone fungieren. Die Bausteine der Proteine (Monomere) sind Aminosäuren. Jede Aminosäure hat einen zentralen Kohlenstoff, der mit einer Aminogruppe, einer Carboxylgruppe, einem Wasserstoffatom und einer R-Gruppe oder Seitenkette verbunden ist. Es gibt 20 häufig vorkommende Aminosäuren, von denen sich jede in der R-Gruppe unterscheidet. Jede Aminosäure ist mit ihren Nachbarn durch eine Peptidbindung verbunden. Eine lange Kette von Aminosäuren wird als Polypeptid bezeichnet.
Proteine sind auf vier Ebenen organisiert: primär, sekundär, tertiär und (optional) quaternär. Die Primärstruktur ist die einzigartige Sequenz von Aminosäuren. Die lokale Faltung des Polypeptids zur Bildung von Strukturen wie der α-Helix und dem β-Faltblatt bildet die Sekundärstruktur. Die dreidimensionale Gesamtstruktur ist die Tertiärstruktur. Wenn sich zwei oder mehr Polypeptide zu einer vollständigen Proteinstruktur verbinden, wird diese Konfiguration als quaternäre Struktur eines Proteins bezeichnet. Proteinform und -funktion sind eng miteinander verknüpft; jede Veränderung der Form, die durch Temperatur- oder pH-Änderungen verursacht wird, kann zu einer Denaturierung des Proteins und einem Funktionsverlust führen.
Prüfen Sie Ihr Verständnis
Beantworten Sie die folgende(n) Frage(n), um zu sehen, wie gut Sie die im vorherigen Abschnitt behandelten Themen verstehen. Dieses kurze Quiz zählt nicht zu Ihrer Note in der Klasse, und Sie können es beliebig oft wiederholen.
Nutzen Sie dieses Quiz, um Ihr Verständnis zu überprüfen und zu entscheiden, ob Sie (1) den vorherigen Abschnitt weiter studieren oder (2) zum nächsten Abschnitt übergehen wollen.