- Opisać strukturę i funkcję białek
- Cele nauczania
- Aminokwasy
- Practice Question
- Ewolucyjne znaczenie cytochromu c
- Struktura białka
- Struktura pierwszorzędowa
- Struktura drugorzędowa
- Struktura trzeciorzędowa
- Struktura czwartorzędowa
- Denaturacja i składanie białek
- Funkcje białek
- W skrócie: Białka
- Sprawdź swoje zrozumienie
Opisać strukturę i funkcję białek
Białka są polimerami aminokwasów. Każdy aminokwas zawiera węgiel centralny, wodór, grupę karboksylową, grupę aminową i zmienną grupę R. Grupa R określa klasę aminokwasów, do której należy: elektrycznie naładowane hydrofilowe łańcuchy boczne, polarne, ale nienaładowane łańcuchy boczne, niepolarne hydrofobowe łańcuchy boczne i przypadki szczególne.
Białka mają różne „warstwy” struktury: pierwszorzędową, drugorzędową, trzeciorzędową, czwartorzędową.
Białka pełnią różne funkcje w komórkach. Główne funkcje obejmują działanie jako enzymy, receptory, cząsteczki transportowe, białka regulacyjne dla ekspresji genów, i tak dalej. Enzymy są katalizatorami biologicznymi, które przyspieszają reakcję chemiczną, nie ulegając trwałym zmianom. Mają „miejsca aktywne”, w których wiążą substrat/reagent, i mogą być aktywowane lub hamowane (inhibitory kompetycyjne i/lub niekompetycyjne).
Cele nauczania
- Zademonstrować znajomość monomerycznych jednostek białek: aminokwasów
- Zdefiniuj różne warstwy struktury białek
- Zidentyfikuj kilka głównych funkcji białek
Aminokwasy
Białka są jednymi z najbardziej obfitych cząsteczek organicznych w żywych systemach i mają najbardziej zróżnicowany zakres funkcji spośród wszystkich makromolekuł. Białka mogą być strukturalne, regulacyjne, kurczliwe, lub ochronne; mogą służyć w transporcie, przechowywaniu, lub membran; lub mogą być toksynami lub enzymami. Każda komórka w systemie żywym może zawierać tysiące białek, z których każde pełni unikalną funkcję. Ich struktury, podobnie jak ich funkcje, są bardzo zróżnicowane. Wszystkie są jednak polimerami aminokwasów, ułożonymi w sekwencję liniową.

Rysunek 1. Aminokwasy mają centralny asymetryczny węgiel, do którego przyłączona jest grupa aminowa, grupa karboksylowa, atom wodoru i łańcuch boczny (grupa R).
Aminokwasy są monomerami tworzącymi białka. Każdy aminokwas ma tę samą podstawową strukturę, która składa się z centralnego atomu węgla, znany również jako alfa (α) węgla, związany z grupy aminowej (NH2), grupy karboksylowej (COOH), i do atomu wodoru. Każdy aminokwas ma również inny atom lub grupę atomów związanych z centralnym atomem, znany jako grupa R (rysunek 1).
Nazwa „aminokwas” pochodzi od faktu, że zawierają one zarówno grupę aminową, jak i grupę karboksylową w swojej podstawowej strukturze. Jak wspomniano, istnieje 20 aminokwasów obecnych w białkach. Dziesięć z nich jest uważanych za niezbędne aminokwasy u ludzi, ponieważ organizm ludzki nie może ich wytworzyć i są one pozyskiwane z diety.
Dla każdego aminokwasu grupa R (lub łańcuch boczny) jest inna (rysunek 2).
Practice Question

Figure 2. Istnieje 20 aminokwasów powszechnie występujących w białkach, każdy z inną grupą R (grupą wariantową), która określa jego charakter chemiczny.
Których kategorii aminokwasów spodziewałbyś się znaleźć na powierzchni rozpuszczalnego białka, a których spodziewałbyś się znaleźć we wnętrzu? Jakiego rozkładu aminokwasów można by się spodziewać w białku osadzonym w warstwie lipidowej?
Charakter chemiczny łańcucha bocznego określa charakter aminokwasu (to znaczy, czy jest kwaśny, zasadowy, polarny, czy niepolarny). Na przykład, aminokwas glicyna ma atom wodoru jako grupę R. Aminokwasy takie jak walina, metionina i alanina są z natury niepolarne lub hydrofobowe, podczas gdy aminokwasy takie jak seryna, treonina i cysteina są polarne i mają hydrofilowe łańcuchy boczne. Łańcuchy boczne lizyny i argininy są dodatnio naładowane, dlatego aminokwasy te są również znane jako aminokwasy zasadowe. Prolina posiada grupę R, która jest połączona z grupą aminową, tworząc strukturę przypominającą pierścień. Prolina jest wyjątkiem od standardowej struktury animokwasu, ponieważ jej grupa aminowa nie jest oddzielona od łańcucha bocznego (rysunek 2).
Aminokwasy są reprezentowane przez pojedynczą wielką literę lub trzyliterowy skrót. Na przykład, walina jest znany przez literę V lub trzyliterowy symbol val. Podobnie jak niektóre kwasy tłuszczowe są niezbędne w diecie, niektóre aminokwasy są niezbędne, jak również. Są one znane jako niezbędne aminokwasy, a u ludzi obejmują izoleucynę, leucynę i cysteinę. Aminokwasy niezbędne odnoszą się do tych, które są niezbędne do budowy białek w organizmie, choć nie są przez niego produkowane; które aminokwasy są niezbędne różni się od organizmu do organizmu.

Rysunek 3. Tworzenie wiązania peptydowego jest reakcją syntezy dehydratacyjnej. Grupa karboksylowa jednego aminokwasu zostaje połączona z grupą aminową aminokwasu wchodzącego. W procesie tym uwalniana jest cząsteczka wody.
Sekwencja i liczba aminokwasów ostatecznie określa kształt, rozmiar i funkcję białka. Każdy aminokwas jest połączony z innym aminokwasem wiązaniem kowalencyjnym, zwanym wiązaniem peptydowym, które powstaje w wyniku reakcji dehydratacji. Grupa karboksylowa jednego aminokwasu i grupa aminowa aminokwasu wchodzącego łączą się, uwalniając cząsteczkę wody. Powstałe w ten sposób wiązanie to wiązanie peptydowe (rysunek 3).
Produkty powstałe w wyniku takich powiązań nazywamy peptydami. W miarę przyłączania się kolejnych aminokwasów do tego rosnącego łańcucha, powstający łańcuch nazywany jest polipeptydem. Każdy polipeptyd ma wolną grupę aminową na jednym końcu. Ten koniec nazywany jest terminalem N lub terminalem aminowym, a drugi koniec ma wolną grupę karboksylową, znaną również jako terminal C lub terminal karboksylowy. Chociaż terminy polipeptyd i białko są czasami używane zamiennie, polipeptyd jest technicznie polimerem aminokwasów, podczas gdy termin białko jest używany w odniesieniu do polipeptydu lub polipeptydów, które połączyły się razem, często mają związane niepeptydowe grupy prostetyczne, mają wyraźny kształt i mają unikalną funkcję. Po syntezie białka (translacji), większość białek ulega modyfikacjom. Są to tzw. modyfikacje potranslacyjne. Mogą one ulegać rozszczepieniu, fosforylacji lub mogą wymagać dodania innych grup chemicznych. Tylko po tych modyfikacji jest białko całkowicie functional.
Ewolucyjne znaczenie cytochromu c
Cytochrom c jest ważnym składnikiem łańcucha transportu elektronów, część oddychania komórkowego, a to jest normalnie znaleźć w organelle komórkowej, mitochondrium. Białko to posiada grupę prostetyczną hemu, a centralny jon hemu ulega naprzemiennej redukcji i utlenieniu podczas przenoszenia elektronów. Ponieważ rola tego niezbędnego białka w produkcji energii komórkowej jest kluczowa, przez miliony lat uległo ono bardzo niewielkim zmianom. Sekwencjonowanie białek wykazało, że istnieje znaczna ilość homologii sekwencji aminokwasów cytochromu c wśród różnych gatunków; innymi słowy, pokrewieństwo ewolucyjne może być oceniane poprzez pomiar podobieństw lub różnic między sekwencjami DNA lub białek różnych gatunków.
Naukowcy ustalili, że ludzki cytochrom c zawiera 104 aminokwasy. Dla każdej cząsteczki cytochromu c z różnych organizmów, które zostały zsekwencjonowane do tej pory, 37 z tych aminokwasów pojawiają się w tej samej pozycji we wszystkich próbkach cytochromu c. To wskazuje, że nie może być wspólny przodek. Porównując sekwencje białek człowieka i szympansa, nie stwierdzono różnic w sekwencji. Kiedy sekwencje ludzkie i małpy rhesus zostały porównane, pojedyncza różnica znaleziona była w jednym aminokwasie. W innym porównaniu, sekwencjonowanie człowieka do drożdży wykazuje różnicę w 44. pozycji.
Struktura białka
Jak omówiono wcześniej, kształt białka jest krytyczny dla jego funkcji. Na przykład, enzym może wiązać się z określonym substratem w miejscu znanym jako miejsce aktywne. Jeśli to miejsce aktywne jest zmienione z powodu lokalnych zmian lub zmian w ogólnej strukturze białka, enzym może nie być w stanie związać się z substratem. Aby zrozumieć, w jaki sposób białko uzyskuje swój ostateczny kształt lub konformację, musimy zrozumieć cztery poziomy struktury białka: pierwszorzędowy, drugorzędowy, trzeciorzędowy i czwartorzędowy.
Struktura pierwszorzędowa
Unikalna sekwencja aminokwasów w łańcuchu polipeptydowym jest jego strukturą pierwszorzędową. Na przykład, hormon trzustkowy insulina ma dwa łańcuchy polipeptydowe, A i B, i są one połączone ze sobą wiązaniami disiarczkowymi. Aminokwasem końcowym N łańcucha A jest glicyna, natomiast aminokwasem końcowym C jest asparagina (rys. 4). Sekwencje aminokwasów w łańcuchach A i B są unikalne dla insuliny.
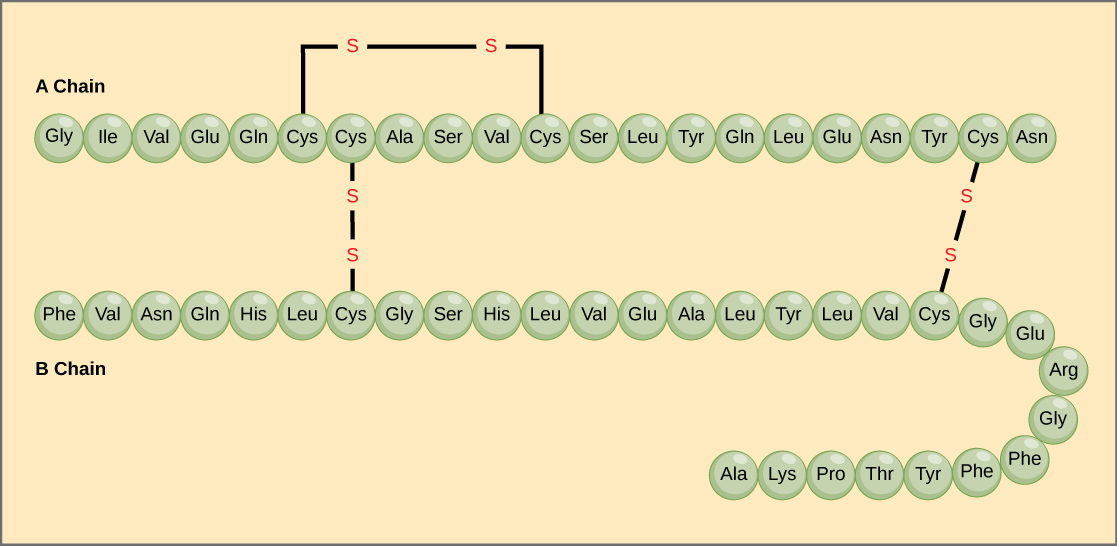
Ryc. 4. Insulina z surowicy bydlęcej jest hormonem białkowym zbudowanym z dwóch łańcuchów peptydowych, A (o długości 21 aminokwasów) i B (o długości 30 aminokwasów). W każdym łańcuchu struktura pierwszorzędowa jest oznaczona trzyliterowymi skrótami, które przedstawiają nazwy aminokwasów w kolejności ich występowania. Aminokwas cysteina (cys) posiada grupę sulfhydrylową (SH) jako łańcuch boczny. Dwie grupy sulfhydrylowe mogą reagować w obecności tlenu, tworząc wiązanie disulfidowe (S-S). Dwa wiązania disulfidowe łączą ze sobą łańcuchy A i B, a trzecie pomaga łańcuchowi A ułożyć się w odpowiedni kształt. Zauważ, że wszystkie wiązania disulfidowe mają tę samą długość, ale są narysowane w różnych rozmiarach dla jasności.
Unikalna sekwencja dla każdego białka jest ostatecznie określona przez gen kodujący białko. Zmiana w sekwencji nukleotydów regionu kodującego genu może prowadzić do dodania innego aminokwasu do rosnącego łańcucha polipeptydowego, powodując zmianę w strukturze i funkcji białka. W anemii sierpowatej łańcuch β hemoglobiny (którego niewielką część przedstawiono na rycinie 5) ma pojedynczą substytucję aminokwasową, powodującą zmianę struktury i funkcji białka.
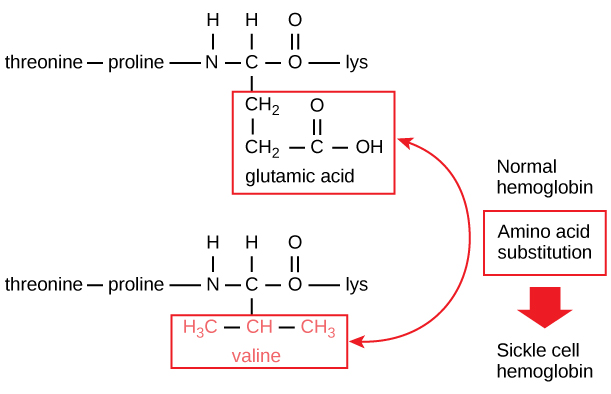
Rysunek 5. Łańcuch beta hemoglobiny ma długość 147 reszt, a mimo to pojedyncza substytucja aminokwasowa prowadzi do anemii sierpowatej. W normalnej hemoglobinie aminokwasem na pozycji siódmej jest glutaminian. W hemoglobinie sierpowatej, ten glutaminian jest zastąpiony waliną.
W szczególności, aminokwas glutaminowy jest zastąpiony waliną w łańcuchu β. Co jest najbardziej niezwykłe do rozważenia jest to, że cząsteczka hemoglobiny składa się z dwóch łańcuchów alfa i dwóch łańcuchów beta, z których każdy składa się z około 150 aminokwasów. Cząsteczka ta ma więc około 600 aminokwasów. Różnica strukturalna pomiędzy normalną cząsteczką hemoglobiny a cząsteczką sierpowatą – która dramatycznie obniża oczekiwaną długość życia – to jeden aminokwas z tych 600. Co jest jeszcze bardziej niezwykłe, to fakt, że te 600 aminokwasów jest kodowanych przez trzy nukleotydy każdy, a mutacja jest spowodowana przez pojedynczą zmianę bazy (mutacja punktowa), 1 na 1800 baz.
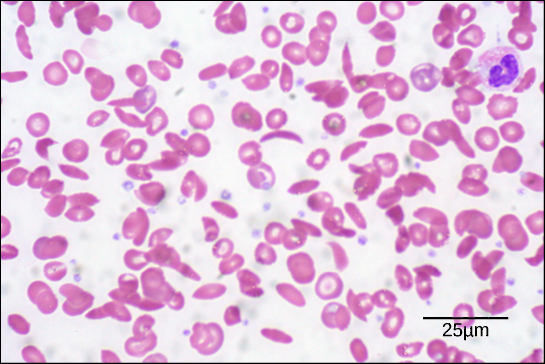
Rysunek 6. W tym rozmazie krwi, wizualizowanym w powiększeniu 535x przy użyciu mikroskopu jasnego pola, komórki sierpowate mają kształt półksiężyca, podczas gdy normalne komórki mają kształt dysku. (kredyt: modyfikacja pracy Eda Uthmana; dane paska skali od Matta Russella)
Z powodu tej zmiany jednego aminokwasu w łańcuchu, cząsteczki hemoglobiny tworzą długie włókna, które zniekształcają dwuwklęsłe, lub w kształcie dysku, czerwone krwinki i przyjmują kształt półksiężyca lub „sierpa”, który zatyka tętnice (rysunek 6). Może to prowadzić do niezliczonych poważnych problemów zdrowotnych, takich jak duszność, zawroty głowy, bóle głowy i bóle brzucha dla osób dotkniętych tą chorobą.
Struktura drugorzędowa
Lokalne składanie polipeptydu w niektórych regionach powoduje powstanie struktury drugorzędowej białka. Najczęściej spotykane są struktury α-helisy i β-plecionego arkusza (Rysunek 7). Obie struktury są strukturami helisy α – helisy utrzymywanej w kształcie przez wiązania wodorowe. Wiązania wodorowe tworzą się między atomem tlenu w grupie karbonylowej w jednym aminokwasie a innym aminokwasem, który znajduje się cztery aminokwasy dalej wzdłuż łańcucha.
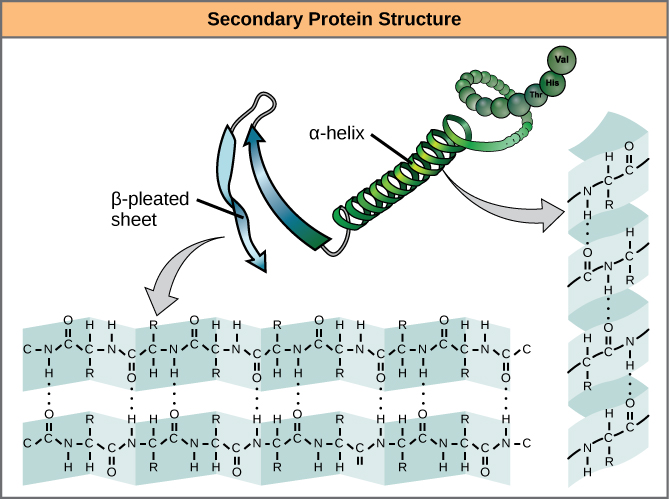
Rysunek 7. α-helisa i β-pleciona blaszka są strukturami drugorzędowymi białek, które tworzą się z powodu wiązania wodorowego między grupami karbonylowymi i aminowymi w szkielecie peptydowym. Niektóre aminokwasy mają skłonność do tworzenia α-helisy, podczas gdy inne mają skłonność do tworzenia β-plecionego arkusza.
Każdy skręt spiralny w helisie alfa ma 3,6 reszt aminokwasowych. Grupy R (grupy wariantowe) polipeptydu wystają z łańcucha α-helisy. W arkuszu β-plecionym „plisy” są tworzone przez wiązanie wodorowe pomiędzy atomami na szkielecie łańcucha polipeptydowego. Grupy R są przyłączone do węgli i rozciągają się powyżej i poniżej fałdów plisy. Fałdowane segmenty ustawiają się równolegle lub antyrównolegle do siebie, a pomiędzy częściowo dodatnim atomem azotu w grupie aminowej i częściowo ujemnym atomem tlenu w grupie karbonylowej szkieletu peptydowego tworzą się wiązania wodorowe. Struktury α-helisy i β-plecionego arkusza występują w większości białek globularnych i włóknistych i odgrywają ważną rolę strukturalną.
Struktura trzeciorzędowa
Unikalną trójwymiarową strukturą polipeptydu jest jego struktura trzeciorzędowa (rysunek 8). Struktura ta jest w części spowodowana interakcjami chemicznymi w pracy na łańcuchu polipeptydowym. Przede wszystkim, oddziaływania pomiędzy grupami R tworzą złożoną, trójwymiarową strukturę trzeciorzędową białka. Charakter grup R występujących w zaangażowanych aminokwasach może przeciwdziałać tworzeniu się wiązań wodorowych opisanych dla standardowych struktur drugorzędowych. Na przykład, grupy R o podobnych ładunkach odpychają się wzajemnie, a te o ładunkach różnych przyciągają się (wiązania jonowe). Podczas fałdowania białka hydrofobowe grupy R niepolarnych aminokwasów leżą we wnętrzu białka, podczas gdy hydrofilowe grupy R leżą na zewnątrz. Te pierwsze rodzaje oddziaływań nazywane są również oddziaływaniami hydrofobowymi. Oddziaływania między łańcuchami bocznymi cysteiny tworzą w obecności tlenu wiązania disulfidowe, jedyne wiązanie kowalencyjne tworzące się podczas fałdowania białek.
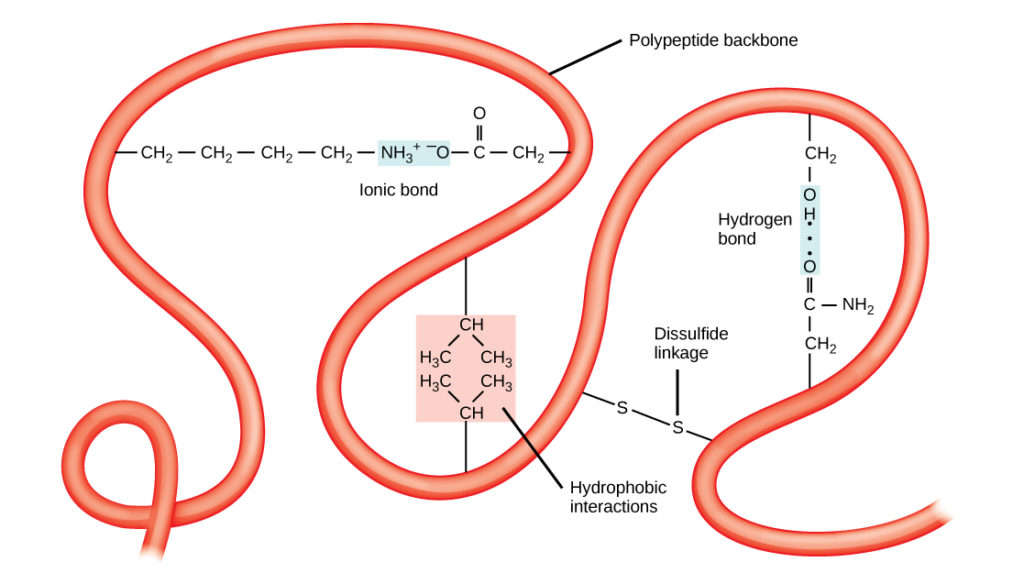
Rysunek 8. Struktura trzeciorzędowa białek jest określona przez szereg oddziaływań chemicznych. Należą do nich oddziaływania hydrofobowe, wiązania jonowe, wiązania wodorowe i wiązania disulfidowe.
Wszystkie te oddziaływania, słabe i silne, określają ostateczny trójwymiarowy kształt białka. Kiedy białko traci swój trójwymiarowy kształt, może już nie być funkcjonalne.
Struktura czwartorzędowa
W naturze, niektóre białka są tworzone z kilku polipeptydów, znanych również jako podjednostki, a interakcje tych podjednostek tworzą strukturę czwartorzędową. Słabe interakcje między podjednostkami pomagają ustabilizować ogólną strukturę. Na przykład insulina (białko globularne) posiada kombinację wiązań wodorowych i disulfidowych, które powodują, że jest ona w większości zbita w kształt kuli. Insulina zaczyna się jako pojedynczy polipeptyd i traci niektóre sekwencje wewnętrzne w obecności modyfikacji potranslacyjnych po utworzeniu wiązań disulfidowych, które utrzymują pozostałe łańcuchy razem. Jedwab (białko włókniste) ma natomiast strukturę β-plecionej wstęgi, która jest wynikiem wiązań wodorowych pomiędzy różnymi łańcuchami.
Cztery poziomy struktury białek (pierwszorzędowy, drugorzędowy, trzeciorzędowy i czwartorzędowy) zilustrowano na rysunku 9.
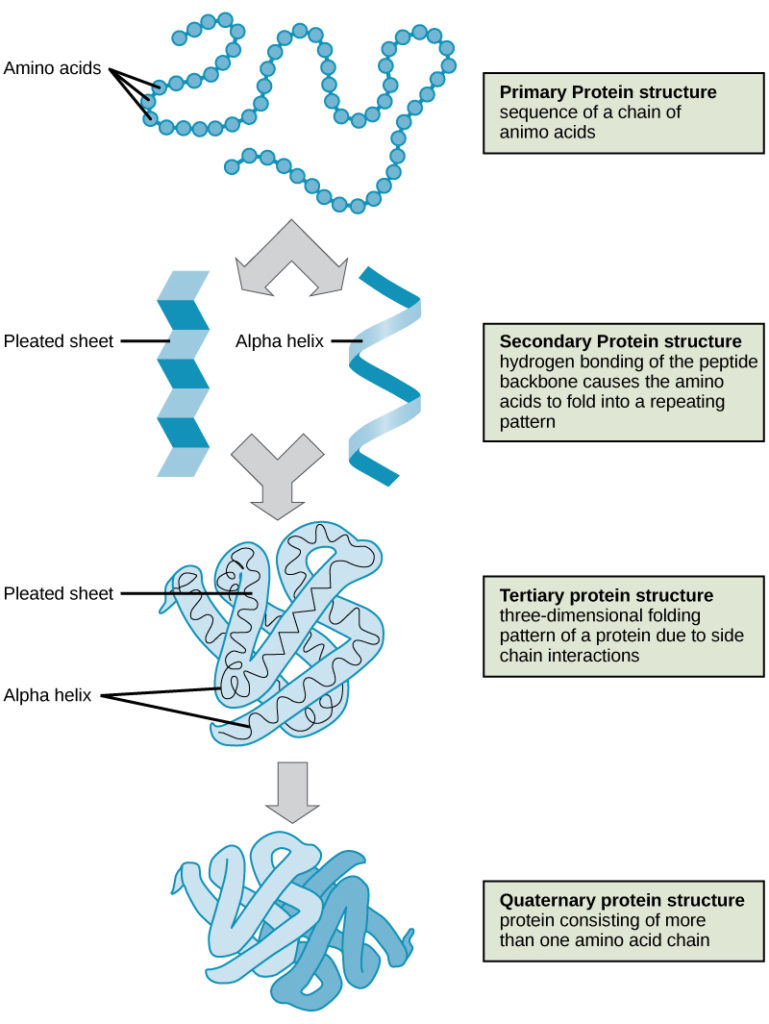
Rysunek 9. Cztery poziomy struktury białka można zaobserwować na tych ilustracjach. (kredyt: modyfikacja pracy National Human Genome Research Institute)
Denaturacja i składanie białek
Każde białko ma swoją unikalną sekwencję i kształt, które są utrzymywane razem przez interakcje chemiczne. Jeśli białko podlega zmianom temperatury, pH, lub ekspozycji na chemikalia, struktura białka może się zmienić, tracąc swój kształt bez utraty jego pierwotnej sekwencji w tym, co jest znane jako denaturacja. Denaturacja jest często odwracalna, ponieważ pierwotna struktura polipeptydu jest zachowana w tym procesie, jeżeli czynnik denaturujący zostanie usunięty, białko może wznowić swoją funkcję. Czasami denaturacja jest nieodwracalna i prowadzi do utraty funkcji. Jednym z przykładów nieodwracalnej denaturacji białka jest smażenie jajka. Białko albuminy znajdujące się w płynnym białku jaja ulega denaturacji po umieszczeniu go na gorącej patelni. Nie wszystkie białka ulegają denaturacji w wysokich temperaturach; na przykład bakterie, które przeżywają w gorących źródłach mają białka, które funkcjonują w temperaturach bliskich wrzenia. Żołądek jest również bardzo kwaśny, ma niskie pH i denaturuje białka w ramach procesu trawienia, jednak enzymy trawienne żołądka zachowują swoją aktywność w tych warunkach.
Fałdowanie białek jest krytyczne dla jego funkcji. Początkowo sądzono, że same białka są odpowiedzialne za proces fałdowania. Dopiero niedawno odkryto, że często otrzymują one pomoc w procesie składania od pomocników białkowych znanych jako chaperony (lub chaperoniny), które wiążą się z białkiem docelowym podczas procesu składania. Działają one poprzez zapobieganie agregacji polipeptydów, które tworzą kompletną strukturę białka, i odłączają się od białka, gdy białko docelowe jest folded.
Funkcje białek
Podstawowe typy i funkcje białek wymieniono w tabeli 1.
| Tabela 1. Protein Types and Functions | ||
|---|---|---|
| Typ | Przykłady | Funkcje |
| Egzymy trawienne | Amylaza, lipaza, pepsyna, trypsyna | Pomagają w trawieniu pokarmu poprzez katabolizację składników pokarmowych do jednostek monomerycznych |
| Transport | Hemoglobina, albumina | Przewożą substancje we krwi lub limfie po całym organizmie |
| Strukturalne | Aktyna, tubulina, keratyna | Budują różne struktury, jak cytoszkielet |
| Hormony | Insulina, tyroksyna | Koordynują aktywność różnych układów ciała |
| Obrona | Immunoglobuliny | Chronią ciało przed obcymi patogenami |
| Kontraktolity | Aktyna, miozyna | Wpływają na skurcz mięśni |
| Zapasowe | Białka magazynowe roślin strączkowych, białko jaja (albumina) | Zapewniają odżywianie we wczesnym rozwoju zarodka i siewki |
Dwa specjalne i wspólne rodzaje białek to enzymy i hormony. Enzymy, które są produkowane przez żywe komórki, są katalizatorami w reakcjach biochemicznych (jak trawienie) i są zazwyczaj białkami złożonymi lub sprzężonymi. Każdy enzym jest specyficzny dla substratu (reagent, który wiąże się z enzymem), na który działa. Enzym może pomagać w reakcjach rozpadu, rearanżacji lub syntezy. Enzymy, które rozkładają swoje substraty nazywane są enzymami katabolicznymi, enzymy, które budują bardziej złożone cząsteczki ze swoich substratów nazywane są enzymami anabolicznymi, a enzymy, które wpływają na szybkość reakcji nazywane są enzymami katalitycznymi. Należy zaznaczyć, że wszystkie enzymy zwiększają szybkość reakcji i dlatego są uważane za katalizatory organiczne. Przykładem enzymu jest amylaza ślinowa, która hydrolizuje swój substrat amylozę, składnik skrobi.
Hormony są cząsteczkami chemiczno-sygnałowymi, zwykle małymi białkami lub steroidami, wydzielanymi przez komórki endokrynne, które działają w celu kontroli lub regulacji określonych procesów fizjologicznych, w tym wzrostu, rozwoju, metabolizmu i reprodukcji. Na przykład insulina jest hormonem białkowym, który pomaga regulować poziom glukozy we krwi.
Białka mają różne kształty i masy cząsteczkowe; niektóre białka mają kształt globularny, podczas gdy inne mają charakter włóknisty. Na przykład, hemoglobina jest białkiem kulistym, ale kolagen, znaleziony w naszej skórze, jest białkiem włóknistym. Kształt białka jest krytyczny dla jego funkcji, a kształt ten jest utrzymywany przez wiele różnych typów wiązań chemicznych. Zmiany temperatury, pH i narażenie na działanie substancji chemicznych mogą prowadzić do trwałych zmian w kształcie białka, co prowadzi do utraty jego funkcji, zwanej denaturacją. Wszystkie białka składają się z różnych układów tych samych 20 rodzajów aminokwasów.
W skrócie: Białka
Białka są klasą makrocząsteczek, które wykonują różnorodne funkcje dla komórki. Pomagają one w metabolizmie, zapewniając wsparcie strukturalne i działając jako enzymy, nośniki lub hormony. Podstawą budowy białek (monomerów) są aminokwasy. Każdy aminokwas ma centralny węgiel, który jest połączony z grupą aminową, grupą karboksylową, atomem wodoru i grupą R lub łańcuchem bocznym. Istnieje 20 powszechnie występujących aminokwasów, z których każdy różni się grupą R. Każdy aminokwas jest połączony z sąsiednimi wiązaniem peptydowym. Długi łańcuch aminokwasów jest znany jako polipeptyd.
Białka są zorganizowane na czterech poziomach: pierwszorzędowym, drugorzędowym, trzeciorzędowym i (opcjonalnie) czwartorzędowym. Struktura pierwszorzędowa to unikalna sekwencja aminokwasów. Lokalne fałdowanie polipeptydu w celu utworzenia struktur takich jak helisa α i arkusz β-pleciony stanowi strukturę drugorzędową. Ogólna struktura trójwymiarowa jest strukturą trzeciorzędową. Kiedy dwa lub więcej polipeptydów łączy się w celu utworzenia kompletnej struktury białka, konfiguracja ta jest znana jako struktura czwartorzędowa białka. Kształt i funkcja białka są ze sobą ściśle powiązane; każda zmiana kształtu spowodowana zmianami temperatury lub pH może prowadzić do denaturacji białka i utraty jego funkcji.
Sprawdź swoje zrozumienie
Odpowiedz na poniższe pytanie(a), aby sprawdzić, jak dobrze rozumiesz tematy poruszone w poprzedniej części. Ten krótki quiz nie wlicza się do oceny z zajęć i można go powtórzyć nieograniczoną liczbę razy.
Użyj tego quizu, aby sprawdzić swoje zrozumienie i zdecydować, czy (1) studiować dalej poprzednią sekcję, czy (2) przejść do następnej sekcji.
.