- A fehérjék szerkezetének és működésének leírása
- Tanulási célok
- Aminosavak
- gyakorlati kérdés
- A citokróm c evolúciós jelentősége
- Fehérje szerkezete
- Primer szerkezet
- Szekunder szerkezet
- Tercier szerkezet
- Kvaterner szerkezet
- Denaturáció és a fehérjék hajtogatása
- A fehérjék funkciója
- Összefoglalva: Fehérjék
- Check Your Understanding
A fehérjék szerkezetének és működésének leírása
A fehérjék aminosavak polimerjei. Minden egyes aminosav tartalmaz egy központi szenet, egy hidrogént, egy karboxilcsoportot, egy aminocsoportot és egy változó R-csoportot. Az R-csoport határozza meg, hogy az aminosavak melyik osztályába tartozik: elektromosan töltött hidrofil oldalláncok, poláros, de töltés nélküli oldalláncok, nem poláros hidrofób oldalláncok és speciális esetek.
A fehérjéknek különböző “szerkezeti rétegei” vannak: elsődleges, másodlagos, harmadlagos, negyedlagos.
A fehérjéknek sokféle funkciójuk van a sejtekben. A főbb funkciók közé tartozik, hogy enzimként, receptorként, transzportmolekulaként, a génexpressziót szabályozó fehérjékként stb. működnek. Az enzimek olyan biológiai katalizátorok, amelyek felgyorsítanak egy kémiai reakciót anélkül, hogy tartósan megváltoznának. Vannak “aktív helyeik”, ahol a szubsztrát/reaktáns kötődik, és aktiválhatók vagy gátolhatók (kompetitív és/vagy nem kompetitív inhibitorok).
Tanulási célok
- Mutassa be a fehérjék monomer egységeinek ismeretét: Aminosavak
- A fehérjék szerkezetének különböző rétegeinek meghatározása
- A fehérjék több fő funkciójának azonosítása
Aminosavak
A fehérjék az élő rendszerekben az egyik legnagyobb mennyiségben előforduló szerves molekula, és az összes makromolekula közül a legváltozatosabb funkcióval rendelkeznek. A fehérjék lehetnek szerkezeti, szabályozó, összehúzó vagy védő fehérjék; szolgálhatnak a szállításban, a tárolásban vagy a membránokban; vagy lehetnek toxinok vagy enzimek. Egy élő rendszer minden egyes sejtje több ezer fehérjét tartalmazhat, amelyek mindegyike egyedi funkcióval rendelkezik. Szerkezetük, akárcsak funkciójuk, nagymértékben különbözik. Mindegyikük azonban aminosavak polimerjei, amelyek lineáris sorrendben helyezkednek el.

1. ábra. Az aminosavaknak van egy központi aszimmetrikus szénatomjuk, amelyhez egy aminocsoport, egy karboxilcsoport, egy hidrogénatom és egy oldallánc (R-csoport) kapcsolódik.
A fehérjéket alkotó monomerek az aminosavak. Minden aminosavnak ugyanaz az alapszerkezete, amely egy központi szénatomból, más néven alfa (α) szénatomból áll, amely egy aminocsoporthoz (NH2), egy karboxilcsoporthoz (COOH) és egy hidrogénatomhoz kapcsolódik. Minden aminosavnak van egy másik atomja vagy atomcsoportja is a központi atomhoz kötődve, amelyet R-csoportnak nevezünk (1. ábra).
Az “aminosav” elnevezés onnan ered, hogy alapszerkezetükben aminocsoportot és karboxil-savcsoportot is tartalmaznak. Mint említettük, a fehérjékben 20 aminosav van jelen. Ezek közül tíz az ember számára esszenciális aminosavnak számít, mivel az emberi szervezet nem képes előállítani őket, ezért a táplálékból kell őket beszerezni.
Az egyes aminosavak esetében az R-csoport (vagy oldallánc) eltérő (2. ábra).
gyakorlati kérdés

2. ábra. A fehérjékben általában 20 gyakori aminosav található, amelyek mindegyikének más-más R-csoportja (variánscsoportja) határozza meg a kémiai jellegét.
Melyik aminosav-kategóriát várná egy oldható fehérje felszínén, és melyiket várná a belsejében? Az aminosavak milyen eloszlását várná egy lipid kettősrétegbe ágyazott fehérjében?
Az oldallánc kémiai jellege határozza meg az aminosav jellegét (azaz, hogy savas, bázikus, poláris vagy nem poláris). Például a glicin aminosav R-csoportja egy hidrogénatom. Az olyan aminosavak, mint a valin, metionin és alanin nem poláros vagy hidrofób jellegűek, míg az olyan aminosavak, mint a szerin, treonin és cisztein polárosak és hidrofil oldalláncokkal rendelkeznek. A lizin és az arginin oldalláncai pozitív töltésűek, ezért ezeket az aminosavakat bázikus aminosavaknak is nevezik. A prolin egy R-csoporttal rendelkezik, amely az aminocsoporthoz kapcsolódik, gyűrűszerű szerkezetet alkotva. A prolin kivételt képez az animósavak standard szerkezete alól, mivel az aminocsoportja nem különül el az oldallánctól (2. ábra).
Az aminosavakat egyetlen nagybetűvel vagy hárombetűs rövidítéssel jelölik. Például a valin a V betűvel vagy a hárombetűs val szimbólummal ismert. Ahogyan egyes zsírsavak nélkülözhetetlenek az étrendben, úgy egyes aminosavak is szükségesek. Ezeket esszenciális aminosavaknak nevezik, és az emberben ezek közé tartozik az izoleucin, a leucin és a cisztein. Az esszenciális aminosavak alatt azokat értjük, amelyek a szervezetben a fehérjék felépítéséhez szükségesek, bár a szervezet nem termeli őket; az, hogy mely aminosavak esszenciálisak, szervezetenként változik.

3. ábra. A peptidkötés kialakulása egy dehidratációs szintézisreakció. Az egyik aminosav karboxilcsoportja a beérkező aminosav aminocsoportjához kapcsolódik. A folyamat során egy molekula víz szabadul fel.
Az aminosavak sorrendje és száma végső soron meghatározza a fehérje alakját, méretét és funkcióját. Minden egyes aminosav egy másik aminosavhoz kovalens kötéssel, úgynevezett peptidkötéssel kapcsolódik, amely egy dehidratációs reakció során jön létre. Az egyik aminosav karboxilcsoportja és a beérkező aminosav aminocsoportja egyesül, felszabadítva egy vízmolekulát. Az így létrejövő kötés a peptidkötés (3. ábra).
Az ilyen kötések által létrehozott termékeket peptideknek nevezzük. Ahogy egyre több aminosav csatlakozik ehhez a növekvő lánchoz, a keletkező láncot polipeptidnek nevezzük. Minden polipeptid egyik végén egy szabad aminocsoport található. Ezt a véget N-terminálisnak vagy aminoterminálisnak nevezzük, a másik végén pedig egy szabad karboxilcsoport található, amelyet C- vagy karboxilterminálisnak is nevezünk. Bár a polipeptid és a fehérje kifejezéseket néha felcserélhetően használják, a polipeptid technikailag aminosavak polimerje, míg a fehérje kifejezést olyan polipeptidre vagy polipeptidekre használják, amelyek összekapcsolódtak, gyakran nem peptid protetikus csoportokat kötöttek, határozott alakkal rendelkeznek, és egyedi funkcióval rendelkeznek. A fehérjeszintézist (transzlációt) követően a legtöbb fehérje módosul. Ezeket poszttranszlációs módosításoknak nevezzük. Áteshetnek hasításon, foszforiláción, vagy más kémiai csoportok hozzáadására is szükség lehet. Csak e módosítások után válik a fehérje teljesen működőképessé.
A citokróm c evolúciós jelentősége
A citokróm c a sejtlégzés részét képező elektrontranszportlánc fontos összetevője, és általában a sejtorganellában, a mitokondriumban található. Ez a fehérje egy hem-protetikus csoporttal rendelkezik, és a hem központi ionja az elektronátvitel során felváltva redukálódik és oxidálódik. Mivel ennek az alapvető fehérjének a sejtek energiatermelésében betöltött szerepe kulcsfontosságú, az évmilliók során nagyon keveset változott. A fehérje szekvenálás kimutatta, hogy a különböző fajok között jelentős mennyiségű citokróm c aminosav szekvencia-homológia van; más szóval az evolúciós rokonság felmérhető a különböző fajok DNS- vagy fehérjeszekvenciái közötti hasonlóságok vagy különbségek mérésével.
A tudósok megállapították, hogy az emberi citokróm c 104 aminosavat tartalmaz. A különböző szervezetekből származó minden egyes citokróm c molekula esetében, amelyet eddig szekvenáltak, ezen aminosavak közül 37 azonos pozícióban jelenik meg a citokróm c minden mintájában. Ez azt jelzi, hogy létezhetett egy közös ős. Az emberi és a csimpánz fehérje szekvenciáinak összehasonlításakor nem találtak szekvencia-különbséget. Az emberi és a rhesusmajom szekvenciák összehasonlításakor egyetlen aminosavban találtak különbséget. Egy másik összehasonlítás során az ember és az élesztő szekvenciája a 44. pozícióban mutatott különbséget.
Fehérje szerkezete
Amint azt korábban tárgyaltuk, egy fehérje alakja döntő fontosságú a funkciója szempontjából. Egy enzim például az aktív helynek nevezett helyen képes egy adott szubsztráthoz kötődni. Ha ez az aktív hely helyi változások vagy a fehérje általános szerkezetében bekövetkező változások miatt megváltozik, akkor az enzim nem tud kötődni a szubsztráthoz. Ahhoz, hogy megértsük, hogyan kapja a fehérje a végső alakját vagy konformációját, meg kell értenünk a fehérjeszerkezet négy szintjét: az elsődleges, a másodlagos, a harmadlagos és a negyedlagos szerkezetet.
Primer szerkezet
A polipeptidláncban lévő aminosavak egyedi sorrendje az elsődleges szerkezet. Például a hasnyálmirigyhormon inzulin két polipeptidláncból áll, A és B, és ezek diszulfidkötésekkel kapcsolódnak egymáshoz. Az A lánc N-terminális aminosava a glicin, míg a C-terminális aminosav az aszparagin (4. ábra). Az A- és B-lánc aminosavainak szekvenciája az inzulinra jellemző.
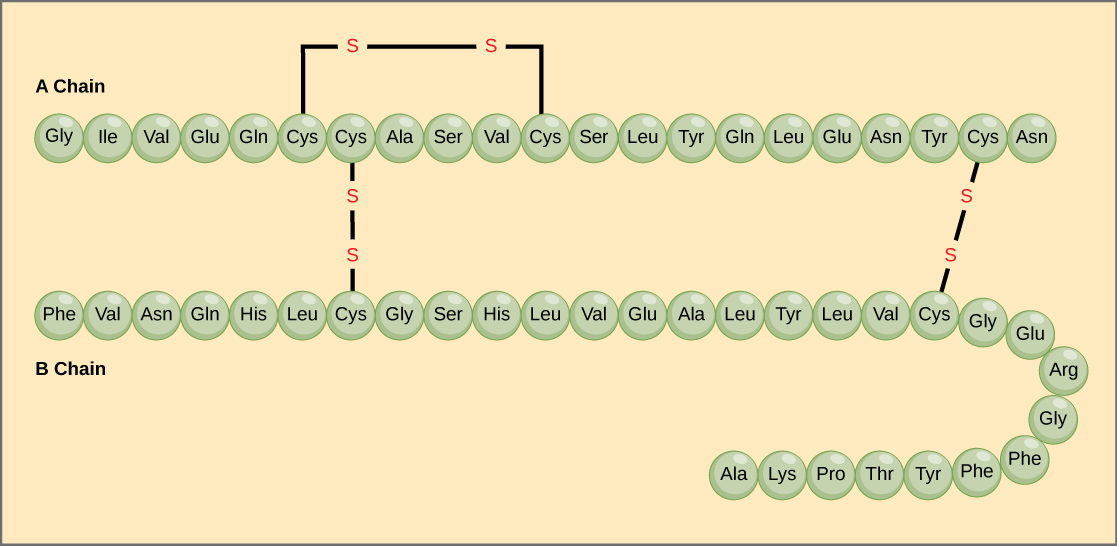
4. ábra. A szarvasmarha szérum inzulin egy fehérjehormon, amely két peptidláncból, az A (21 aminosav hosszú) és a B (30 aminosav hosszú) láncból áll. Mindkét láncban az elsődleges szerkezetet hárombetűs rövidítések jelölik, amelyek az aminosavak nevét jelentik a jelenlétük sorrendjében. Az aminosav cisztein (cys) oldalláncaként szulfhidril (SH) csoportot tartalmaz. Két szulfhidrilcsoport oxigén jelenlétében reakcióba léphet, és diszulfid (S-S) kötést képezhet. Két diszulfidkötés köti össze az A- és a B-láncot, egy harmadik pedig segít az A-lánc megfelelő alakba hajtogatásában. Figyeljük meg, hogy minden diszulfidkötés azonos hosszúságú, de az áttekinthetőség kedvéért különböző méretűek.
Az egyes fehérjék egyedi szekvenciáját végső soron a fehérjét kódoló gén határozza meg. A gén kódoló régiójának nukleotidszekvenciájában bekövetkező változás azt eredményezheti, hogy a növekvő polipeptidláncba más aminosav kerül, ami a fehérje szerkezetében és funkciójában változást okoz. A sarlósejtes vérszegénységben a hemoglobin β-láncában (amelynek egy kis része az 5. ábrán látható) egyetlen aminosav kicserélődött, ami a fehérje szerkezetében és funkciójában változást okoz.
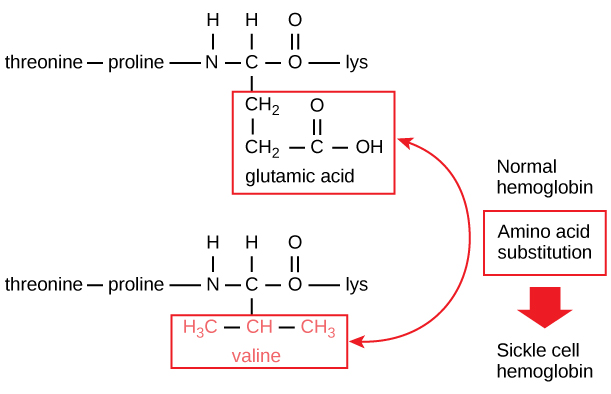
5. ábra. A hemoglobin béta-láncának hossza 147 maradék, mégis egyetlen aminosav szubsztitúció sarlósejtes vérszegénységhez vezet. A normál hemoglobinban a hetes pozícióban lévő aminosav glutamát. A sarlósejtes hemoglobinban ezt a glutamátot egy valin helyettesíti.
Konkrétan a β-láncban a glutaminsav aminosavat valin helyettesíti. Ami a leginkább figyelemre méltó, hogy egy hemoglobinmolekula két alfa- és két béta-láncból áll, amelyek mindegyike körülbelül 150 aminosavból áll. A molekula tehát körülbelül 600 aminosavból áll. A normál hemoglobinmolekula és a sarlósejtes molekula közötti szerkezeti különbség – amely drámaian csökkenti a várható élettartamot – egyetlen aminosav a 600-ból. Ami még figyelemre méltóbb, hogy ezt a 600 aminosavat egyenként három nukleotid kódolja, és a mutációt egyetlen bázisváltás (pontmutáció) okozza, 1800 bázisból 1.
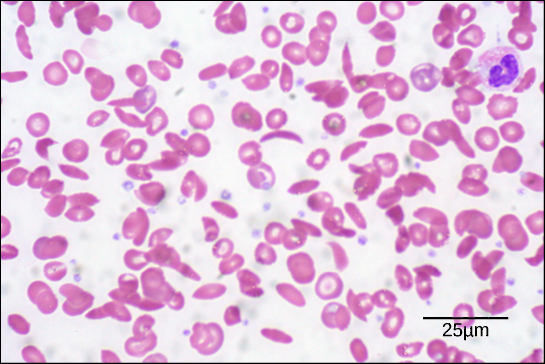
6. ábra. Ezen a vérkenetben, amelyet 535x nagyítással, fényes térmikroszkópiával vizualizáltak, a sarlósejtek félhold alakúak, míg a normál sejtek korong alakúak. (hitel: Ed Uthman munkájának módosítása; a méretarányos adatok Matt Russelltől származnak)
A lánc egy aminosavának e változása miatt a hemoglobin molekulák hosszú rostokat alkotnak, amelyek eltorzítják a bikonkáv vagy korong alakú vörösvértesteket, és félhold vagy “sarló” alakot vesznek fel, ami eltömíti az artériákat (6. ábra). Ez számtalan súlyos egészségügyi problémához, például légszomjhoz, szédüléshez, fejfájáshoz és hasi fájdalomhoz vezethet a betegségben szenvedőknél.
Szekunder szerkezet
A polipeptid egyes régiókban történő helyi hajtogatása adja a fehérje másodlagos szerkezetét. A leggyakoribbak az α-hélix és a β-lapos szerkezetek (7. ábra). Mindkét szerkezet az α-hélix szerkezet – a hidrogénkötések által alakban tartott hélix. A hidrogénkötések az egyik aminosav karbonilcsoportjában lévő oxigénatom és egy másik, a láncban négy aminosavval arrébb lévő aminosav között alakulnak ki.
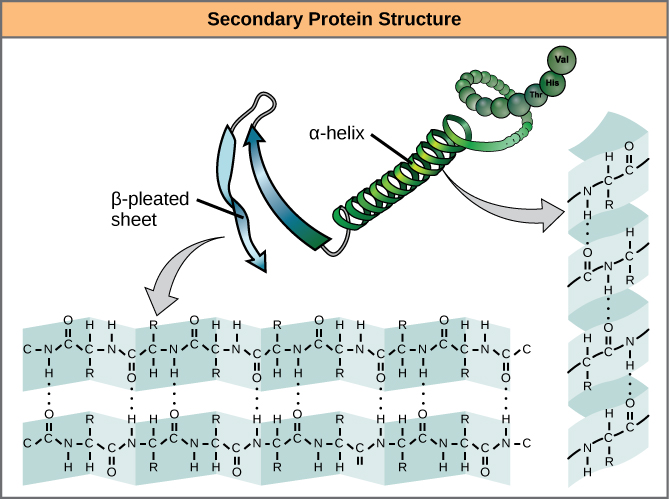
7. ábra. Az α-hélix és a β-pleated sheet a fehérjék másodlagos szerkezetei, amelyek a peptidgerincben lévő karbonil- és aminocsoportok közötti hidrogénkötés miatt alakulnak ki. Bizonyos aminosavak hajlamosak α-hélixet, míg mások β-pleated sheetet képezni.
Az alfa-hélix minden spirális fordulója 3,6 aminosavmaradványból áll. A polipeptid R-csoportjai (a variánscsoportok) kiállnak az α-hélixláncból. A β-hélixben a “redőket” a polipeptidlánc gerincén lévő atomok közötti hidrogénkötés alakítja ki. Az R-csoportok a szénatomokhoz kapcsolódnak, és a redők felett és alatt húzódnak. A pliszírozott szegmensek párhuzamosan vagy antipárhuzamosan igazodnak egymáshoz, és hidrogénkötések alakulnak ki az aminocsoport részben pozitív nitrogénatomja és a peptidgerinc karbonilcsoportjának részben negatív oxigénatomja között. Az α-hélix és a β-plezett lapszerkezet a legtöbb globuláris és rostos fehérjében megtalálható, és fontos szerkezeti szerepet játszik.
Tercier szerkezet
A polipeptid egyedi háromdimenziós szerkezete a tercier szerkezet (8. ábra). Ez a szerkezet részben a polipeptidláncon működő kémiai kölcsönhatásoknak köszönhető. Elsősorban az R-csoportok közötti kölcsönhatások hozzák létre a fehérje összetett háromdimenziós tercier szerkezetét. Az érintett aminosavakban található R-csoportok jellege ellensúlyozhatja a standard másodlagos szerkezeteknél leírt hidrogénkötések kialakulását. Például a hasonló töltésű R-csoportok taszítják egymást, a nem hasonló töltésűek pedig vonzzák egymást (ionos kötések). A fehérje hajtogatásakor a nem poláros aminosavak hidrofób R-csoportjai a fehérje belsejében, míg a hidrofil R-csoportok kívül helyezkednek el. Az előbbi típusú kölcsönhatásokat hidrofób kölcsönhatásoknak is nevezik. A cisztein oldalláncok közötti kölcsönhatás oxigén jelenlétében diszulfidkötéseket képez, ez az egyetlen kovalens kötés, amely a fehérje hajtogatása során kialakul.
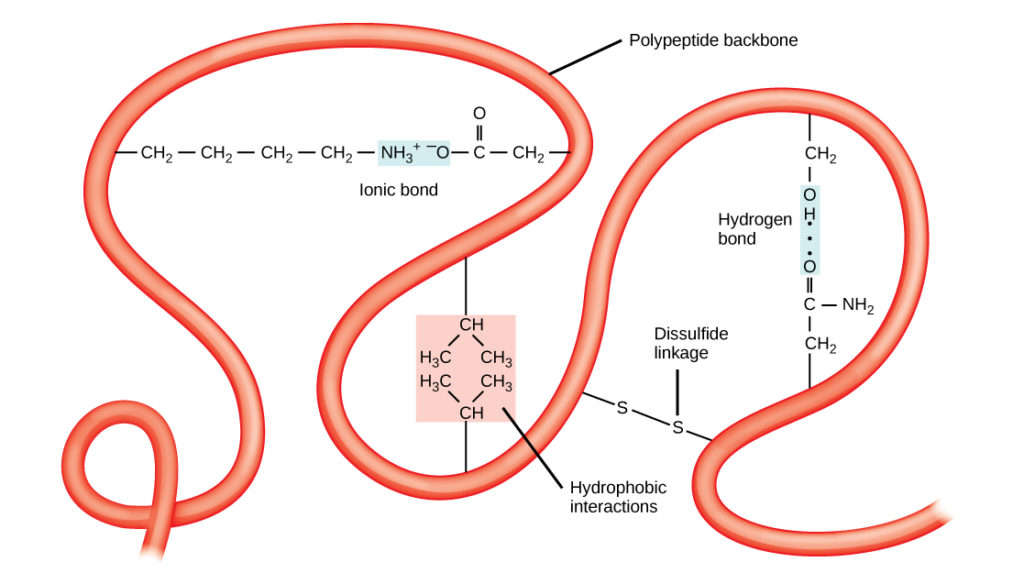
8. ábra. A fehérjék tercier szerkezetét számos kémiai kölcsönhatás határozza meg. Ezek közé tartoznak a hidrofób kölcsönhatások, az ionos kötések, a hidrogénkötések és a diszulfidkötések.
Az összes ilyen kölcsönhatás, gyenge és erős, meghatározza a fehérje végső háromdimenziós alakját. Ha egy fehérje elveszíti háromdimenziós alakját, akkor már nem lehet működőképes.
Kvaterner szerkezet
A természetben egyes fehérjék több polipeptidből, más néven alegységből állnak, és ezen alegységek kölcsönhatásai alkotják a kvaterner szerkezetet. Az alegységek közötti gyenge kölcsönhatások segítenek az általános szerkezet stabilizálásában. Például az inzulin (egy globuláris fehérje) hidrogénkötések és diszulfidkötések kombinációjának köszönhetően többnyire gömb alakúvá csomósodik. Az inzulin egyetlen polipeptidként indul, és a megmaradó láncokat összetartó diszulfidkötések kialakulása után a poszttranszlációs módosítások hatására elveszít néhány belső szekvenciát. A selyem (egy szálas fehérje) viszont β-lapszerkezetű, amely a különböző láncok közötti hidrogénkötések eredménye.
A fehérjeszerkezet négy szintjét (elsődleges, másodlagos, harmadlagos és negyedleges) a 9. ábra szemlélteti.
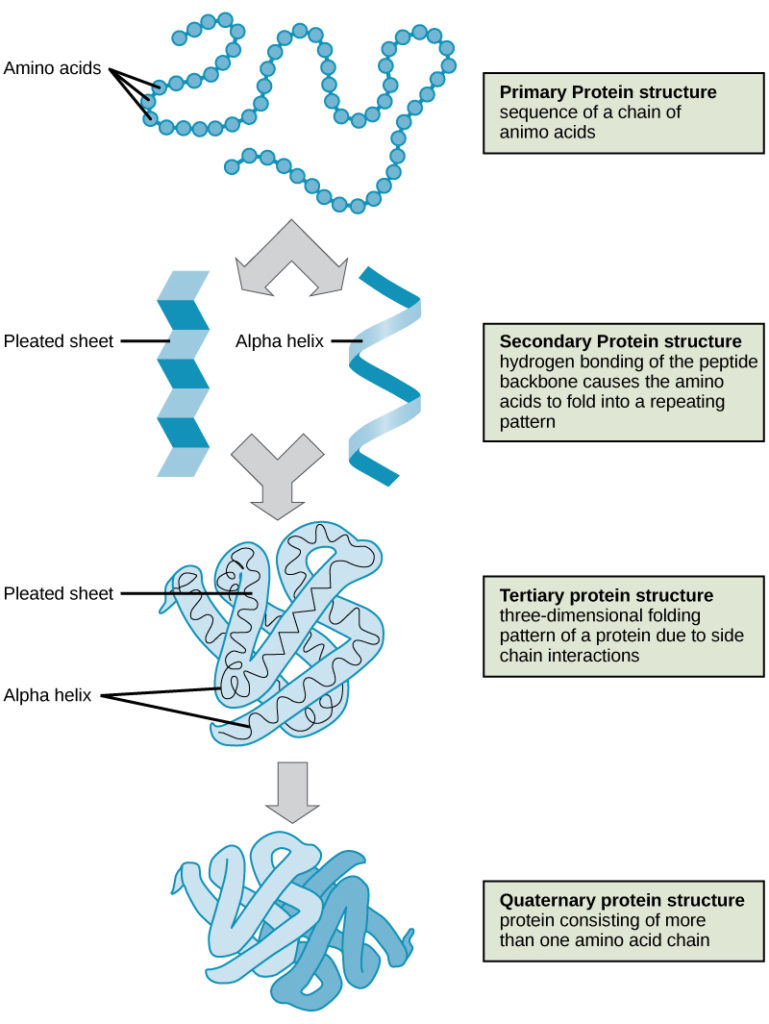
9. ábra. A fehérjeszerkezet négy szintjét figyelhetjük meg ezeken az ábrákon. (kredit: a National Human Genome Research Institute munkájának módosítása)
Denaturáció és a fehérjék hajtogatása
Minden fehérjének megvan a maga egyedi szekvenciája és alakja, amelyeket kémiai kölcsönhatások tartanak össze. Ha a fehérje hőmérséklet- vagy pH-változásnak, illetve vegyi anyagoknak való kitettségnek van kitéve, a fehérje szerkezete megváltozhat, elveszítheti alakját anélkül, hogy elveszítené elsődleges szekvenciáját, amit denaturációnak nevezünk. A denaturáció gyakran reverzibilis, mivel a folyamat során a polipeptid elsődleges szerkezete megmarad, ha a denaturáló ágens eltávolításra kerül, lehetővé téve a fehérje funkciójának folytatását. Néha a denaturáció irreverzibilis, ami a funkció elvesztéséhez vezet. Az irreverzibilis fehérje denaturáció egyik példája a tojás sütése. A folyékony tojásfehérjében lévő albuminfehérje denaturálódik, amikor forró serpenyőbe kerül. Nem minden fehérje denaturálódik magas hőmérsékleten; például a forró forrásokban túlélő baktériumok olyan fehérjékkel rendelkeznek, amelyek a forráshoz közeli hőmérsékleten működnek. A gyomor is nagyon savas, alacsony a pH-értéke, és az emésztési folyamat részeként denaturálja a fehérjéket; a gyomor emésztőenzimei azonban ilyen körülmények között is megőrzik aktivitásukat.
A fehérjék hajtogatása kritikus a működésük szempontjából. Eredetileg úgy gondolták, hogy maguk a fehérjék felelősek a hajtogatási folyamatért. Csak a közelmúltban derült ki, hogy gyakran kapnak segítséget a hajtogatási folyamatban a chaperonok (vagy chaperoninok) néven ismert fehérje-segítőktől, amelyek a célfehérjéhez társulnak a hajtogatási folyamat során. Ezek úgy működnek, hogy megakadályozzák a teljes fehérjeszerkezetet alkotó polipeptidek aggregációját, és a célfehérje hajtogatása után leválnak a fehérjéről.
A fehérjék funkciója
A fehérjék elsődleges típusait és funkcióit az 1. táblázat tartalmazza.
| 1. táblázat. Fehérje típusok és funkciók | ||
|---|---|---|
| Típus | Példák | Funkciók |
| Edagasztó enzimek | Amiláz, lipáz, pepszin, tripszin | Segítenek a táplálék emésztésében a tápanyagok monomer egységekre történő katabolizálásával |
| Transzport | Hemoglobin, Albumin | Az anyagok szállítása a vérben vagy a nyirokban az egész szervezetben |
| Szerkezeti | Aktin, tubulin, keratin | A különböző struktúrákat, mint a citoszkeleton |
| Hormonok | Inzulin, tiroxin | Koordinálják a különböző testrendszerek tevékenységét |
| Védelem | Immungoglobulinok | Védik a szervezetet az idegen kórokozóktól |
| Kontraktilis | Actin, miozin | Hatással vannak az izomösszehúzódásra |
| Raktározó | Levélraktározó fehérjék, tojásfehérje (albumin) | Táplálékot biztosítanak az embrió és a csemete korai fejlődésében |
A fehérjék két speciális és gyakori típusa az enzimek és a hormonok. Az élő sejtek által termelt enzimek a biokémiai reakciók (például az emésztés) katalizátorai, és általában összetett vagy konjugált fehérjék. Minden enzim specifikus a szubsztrátra (az enzimhez kötődő reaktáns), amelyre hat. Az enzim segíthet lebontási, átrendeződési vagy szintézisreakciókban. A szubsztrátjukat lebontó enzimeket katabolikus enzimeknek, a szubsztrátjukból összetettebb molekulákat felépítő enzimeket anabolikus enzimeknek, a reakció sebességét befolyásoló enzimeket pedig katalitikus enzimeknek nevezzük. Meg kell jegyezni, hogy minden enzim növeli a reakció sebességét, és ezért szerves katalizátoroknak tekinthetők. Ilyen enzim például a nyál amiláz, amely hidrolizálja szubsztrátját, az amilózt, a keményítő egyik összetevőjét.
A hormonok olyan kémiai jelzőmolekulák, általában kis fehérjék vagy szteroidok, amelyeket az endokrin sejtek választanak ki, és amelyek bizonyos élettani folyamatok, többek között a növekedés, a fejlődés, az anyagcsere és a szaporodás irányítására vagy szabályozására szolgálnak. Az inzulin például egy fehérjehormon, amely segít szabályozni a vércukorszintet.
A fehérjék különböző alakúak és molekulatömegűek; egyes fehérjék gömb alakúak, míg mások rostos jellegűek. Például a hemoglobin gömb alakú fehérje, a bőrünkben található kollagén viszont rostos fehérje. A fehérjék alakja döntő fontosságú a működésük szempontjából, és ezt az alakot sokféle kémiai kötés tartja fenn. A hőmérséklet és a pH változása, valamint a vegyi anyagoknak való kitettség a fehérje alakjának tartós változásához vezethet, ami a funkció elvesztéséhez, az úgynevezett denaturációhoz vezet. Minden fehérje ugyanannak a húszféle aminosavnak a különböző elrendezéseiből áll.
Összefoglalva: Fehérjék
A fehérjék a makromolekulák egy osztályát alkotják, amelyek a sejt számára sokféle funkciót látnak el. Segítik az anyagcserét azáltal, hogy szerkezeti támogatást nyújtanak, illetve enzimként, hordozóként vagy hormonként működnek. A fehérjék építőkövei (monomerek) az aminosavak. Minden egyes aminosavnak van egy központi szénatomja, amelyhez egy aminocsoport, egy karboxilcsoport, egy hidrogénatom és egy R-csoport vagy oldallánc kapcsolódik. 20 általánosan előforduló aminosav létezik, amelyek mindegyike az R-csoportban különbözik. Minden egyes aminosav peptidkötéssel kapcsolódik szomszédjaihoz. Az aminosavak hosszú láncát polipeptidnek nevezzük.
A fehérjék négy szinten szerveződnek: primer, szekunder, tercier és (opcionálisan) kvaterner szinten. Az elsődleges szerkezet az aminosavak egyedi szekvenciája. A polipeptid helyi hajtogatása olyan szerkezetek kialakítására, mint az α-helix és a β-plezett lap, alkotja a másodlagos szerkezetet. Az átfogó háromdimenziós szerkezet a tercier szerkezet. Amikor két vagy több polipeptid egyesül a teljes fehérjeszerkezet kialakításához, a konfigurációt a fehérje kvaterner szerkezetének nevezzük. A fehérjék alakja és funkciója szorosan összefügg; a hőmérséklet vagy a pH változása által okozott bármilyen alakváltozás a fehérje denaturációjához és funkcióvesztéshez vezethet.
Check Your Understanding
Válaszoljon az alábbi kérdés(ek)re, hogy lássa, mennyire érti az előző fejezetben tárgyalt témákat. Ez a rövid kvíz nem számít bele az órai jegybe, és korlátlan számú alkalommal ismételheti meg.
Ezzel a kvízzel ellenőrizheti a megértését, és eldöntheti, hogy (1) tovább tanulmányozza-e az előző részt, vagy (2) áttérjen a következő részre.