- Kuvaus proteiinien rakenteesta ja toiminnasta
- Oppimistavoitteet
- Aminohapot
- Harjoituskysymys
- Sytokromi c:n evolutiivinen merkitys
- Proteiinien rakenne
- Primäärinen rakenne
- Sekundäärirakenne
- Tertiäärirakenne
- Kvaternäärirakenne
- Denaturoituminen ja proteiinien taittuminen
- Proteiinien tehtävät
- Yhteenveto: Proteiinit
- Tarkista ymmärryksesi
Kuvaus proteiinien rakenteesta ja toiminnasta
Proteiinit ovat aminohappojen polymeerejä. Jokainen aminohappo sisältää keskushiilen, vedyn, karboksyyliryhmän, aminoryhmän ja muuttuvan R-ryhmän. R-ryhmä määrittää, mihin aminohappojen luokkaan se kuuluu: sähköisesti varautuneet hydrofiiliset sivuketjut, polaariset mutta varauksettomat sivuketjut, poolittomat hydrofobiset sivuketjut ja erikoistapaukset.
Proteiineilla on erilaisia rakenteen ”kerroksia”: primaarinen, sekundaarinen, tertiäärinen, kvaternaarinen.
Proteiineilla on erilaisia tehtäviä soluissa. Tärkeimpiä toimintoja ovat mm. toimiminen entsyymeinä, reseptoreina, kuljetusmolekyyleinä, geeniekspression säätelijäproteiineina ja niin edelleen. Entsyymit ovat biologisia katalyyttejä, jotka nopeuttavat kemiallista reaktiota muuttumatta pysyvästi. Niillä on ”aktiivisia kohtia”, joihin substraatti/reaktantti sitoutuu, ja niitä voidaan joko aktivoida tai inhiboida (kilpailevat ja/tai ei-kilpailevat inhibiittorit).
Oppimistavoitteet
- Tutustu proteiinien monomeerisiin yksiköihin: aminohapot
- Määrittele proteiinien rakenteen eri kerrokset
- Tunnista useita proteiinien tärkeimpiä toimintoja
Aminohapot
Proteiinit ovat yksi elävien systeemien runsaslukuisimmista orgaanisista molekyyleistä, ja niillä on kaikista makromolekyyleistä moninaisimmat tehtävät. Proteiinit voivat olla rakenteellisia, sääteleviä, supistuvia tai suojaavia; ne voivat toimia kuljetuksessa, varastoinnissa tai kalvoissa; tai ne voivat olla myrkkyjä tai entsyymejä. Jokaisessa elävän järjestelmän solussa voi olla tuhansia proteiineja, joilla kullakin on ainutlaatuinen tehtävä. Niiden rakenteet, kuten niiden tehtävätkin, vaihtelevat suuresti. Ne ovat kuitenkin kaikki aminohappojen polymeerejä, jotka on järjestetty lineaariseen järjestykseen.

Kuva 1. Aminohapoilla on keskeinen epäsymmetrinen hiili, johon on kiinnittynyt aminoryhmä, karboksyyliryhmä, vetyatomi ja sivuketju (R-ryhmä).
Aminohapot ovat monomeerejä, joista proteiinit koostuvat. Jokaisella aminohapolla on sama perusrakenne, joka koostuu keskeisestä hiiliatomista, joka tunnetaan myös nimellä alfa-hiili (α-hiili), joka on sitoutunut aminoryhmään (NH2), karboksyyliryhmään (COOH) ja vetyatomiin. Jokaisella aminohapolla on myös toinen atomi tai atomiryhmä, joka on sitoutunut keskusatomiin ja jota kutsutaan R-ryhmäksi (kuva 1).
Nimi ”aminohappo” johtuu siitä, että niiden perusrakenteessa on sekä aminoryhmä että karboksyylihapporyhmä. Kuten mainittu, proteiineissa on 20 aminohappoa. Näistä kymmentä pidetään ihmiselle välttämättöminä aminohappoina, koska elimistö ei pysty tuottamaan niitä, vaan ne saadaan ravinnosta.
Kunkin aminohapon R-ryhmä (tai sivuketju) on erilainen (kuva 2).
Harjoituskysymys

Kuva 2. Aminohappojen R-ryhmät ovat erilaisia. Proteiineissa esiintyy yleisesti 20 yleistä aminohappoa, joista jokaisella on erilainen R-ryhmä (muunnosryhmä), joka määrittää sen kemiallisen luonteen.
Mitä aminohappoluokkia odottaisit löytäväsi liukoisen proteiinin pinnalta ja mitä sisäosasta? Minkä aminohappojen jakauman odottaisit löytyvän lipidikaksoiskerrokseen upotetusta proteiinista?
Sivuketjun kemiallinen luonne määrää aminohapon luonteen (eli onko se hapan, emäksinen, poolinen vai pooliton). Esimerkiksi aminohappo glysiinin R-ryhmänä on vetyatomi. Aminohapot, kuten valiini, metioniini ja alaniini, ovat luonteeltaan poolittomia tai hydrofobisia, kun taas aminohapot, kuten seriini, treoniini ja kysteiini, ovat poolisia ja niillä on hydrofiiliset sivuketjut. Lysiinin ja arginiinin sivuketjut ovat positiivisesti varautuneita, ja siksi näitä aminohappoja kutsutaan myös emäksisiksi aminohapoiksi. Proliinissa on R-ryhmä, joka liittyy aminoryhmään muodostaen rengasmaisen rakenteen. Proliini on poikkeus animohapon vakiorakenteesta, koska sen aminoryhmä ei ole erillään sivuketjusta (kuva 2).
Aminohapot esitetään yhdellä isolla kirjaimella tai kolmikirjaimisella lyhenteellä. Esimerkiksi valiini tunnetaan kirjaimella V tai kolmikirjaimisella tunnuksella val. Aivan kuten jotkut rasvahapot ovat välttämättömiä ruokavaliossa, myös jotkut aminohapot ovat välttämättömiä. Niitä kutsutaan välttämättömiksi aminohapoiksi, ja ihmisillä niihin kuuluvat isoleusiini, leusiini ja kysteiini. Välttämättömillä aminohapoilla tarkoitetaan niitä aminohappoja, jotka ovat välttämättömiä elimistön proteiinien rakentamiseen, vaikka elimistö ei tuotakaan niitä; se, mitkä aminohapot ovat välttämättömiä, vaihtelee elimistöstä toiseen.

Kuvio 3. Välttämättömät aminohapot. Peptidisidoksen muodostuminen on dehydraatiosynteesireaktio. Yhden aminohapon karboksyyliryhmä liittyy tulevan aminohapon aminoryhmään. Prosessissa vapautuu molekyyli vettä.
Aminohappojen järjestys ja lukumäärä määräävät lopulta proteiinin muodon, koon ja toiminnan. Jokainen aminohappo on kiinnittynyt toiseen aminohappoon kovalenttisella sidoksella, niin sanotulla peptidisidoksella, joka muodostuu dehydraatioreaktiossa. Yhden aminohapon karboksyyliryhmä ja tulevan aminohapon aminoryhmä yhdistyvät, jolloin vapautuu vesimolekyyli. Syntyvä sidos on peptidisidos (kuva 3).
Tällaisten sidosten muodostamia tuotteita kutsutaan peptideiksi. Kun tähän kasvavaan ketjuun liittyy lisää aminohappoja, syntyvää ketjua kutsutaan polypeptidiksi. Jokaisen polypeptidin toisessa päässä on vapaa aminoryhmä. Tätä päätä kutsutaan N-terminaaliksi eli aminoterminaaliksi, ja toisessa päässä on vapaa karboksyyliryhmä, jota kutsutaan myös C- eli karboksyyliterminaaliksi. Vaikka termejä polypeptidi ja proteiini käytetään joskus vaihtelevasti, polypeptidi on teknisesti ottaen aminohappojen polymeeri, kun taas termiä proteiini käytetään polypeptidistä tai polypeptideistä, jotka ovat yhdistyneet toisiinsa, joihin on usein sidottu muita kuin proteiiniproteettisia ryhmiä, joilla on selkeä muoto ja joilla on yksilöllinen tehtävä. Proteiinisynteesin (translaation) jälkeen useimmat proteiinit muunnetaan. Näitä kutsutaan posttranslationaalisiksi modifikaatioiksi. Niitä voidaan pilkkoa, fosforyloida tai niihin voidaan lisätä muita kemiallisia ryhmiä. Vasta näiden modifikaatioiden jälkeen proteiini on täysin toimintakykyinen.
Sytokromi c:n evolutiivinen merkitys
Sytokromi c on tärkeä komponentti elektroninsiirtoketjussa, joka on osa soluhengitystä, ja se sijaitsee normaalisti solun organellissa, mitokondriossa. Tässä proteiinissa on hemin proteettiryhmä, ja hemin keskusioni pelkistyy ja hapettuu vuorotellen elektroninsiirron aikana. Koska tämän välttämättömän proteiinin rooli soluenergian tuottamisessa on ratkaiseva, se on muuttunut hyvin vähän miljoonien vuosien aikana. Proteiinien sekvensointi on osoittanut, että sytokromi c:n aminohapposekvenssihomologiaa on huomattavan paljon eri lajien välillä; toisin sanoen evolutiivista sukulaisuutta voidaan arvioida mittaamalla eri lajien DNA- tai proteiinisekvenssien yhtäläisyyksiä tai eroavaisuuksia.
Tutkijat ovat määritelleet, että ihmisen sytokromi c sisältää 104 aminohappoa. Jokaisesta eri eliöistä peräisin olevasta sytokromi c -molekyylistä, joka on tähän mennessä sekvensoitu, 37 näistä aminohapoista esiintyy samassa paikassa kaikissa sytokromi c -näytteissä. Tämä viittaa siihen, että on saattanut olla yhteinen esi-isä. Verrattaessa ihmisen ja simpanssin proteiinisekvenssejä ei havaittu sekvenssieroja. Kun ihmisen ja rhesusapinan sekvenssejä verrattiin, ainoa löydetty ero oli yhdessä aminohapossa. Toisessa vertailussa ihmisen ja hiivan sekvensseissä havaittiin ero 44. kohdassa.
Proteiinien rakenne
Kuten aiemmin käsiteltiin, proteiinin muoto on kriittinen sen toiminnan kannalta. Esimerkiksi entsyymi voi sitoutua tiettyyn substraattiin paikassa, jota kutsutaan aktiiviseksi kohdaksi. Jos tämä aktiivinen kohta muuttuu paikallisten muutosten tai proteiinin kokonaisrakenteen muutosten vuoksi, entsyymi ei välttämättä pysty sitoutumaan substraattiin. Ymmärtääksemme, miten proteiini saa lopullisen muotonsa tai konformaationsa, meidän on ymmärrettävä proteiinirakenteen neljä tasoa: primaarinen, sekundaarinen, tertiäärinen ja kvaternaarinen rakenne.
Primäärinen rakenne
Polypeptidiketjun aminohappojen ainutkertainen järjestys on sen primaarinen rakenne. Esimerkiksi haimahormoni insuliinissa on kaksi polypeptidiketjua, A ja B, ja ne liittyvät toisiinsa disulfidisidoksilla. A-ketjun N-terminaalinen aminohappo on glysiini, kun taas C-terminaalinen aminohappo on asparagiini (kuva 4). A- ja B-ketjujen aminohappojen sekvenssit ovat ainutlaatuisia insuliinille.
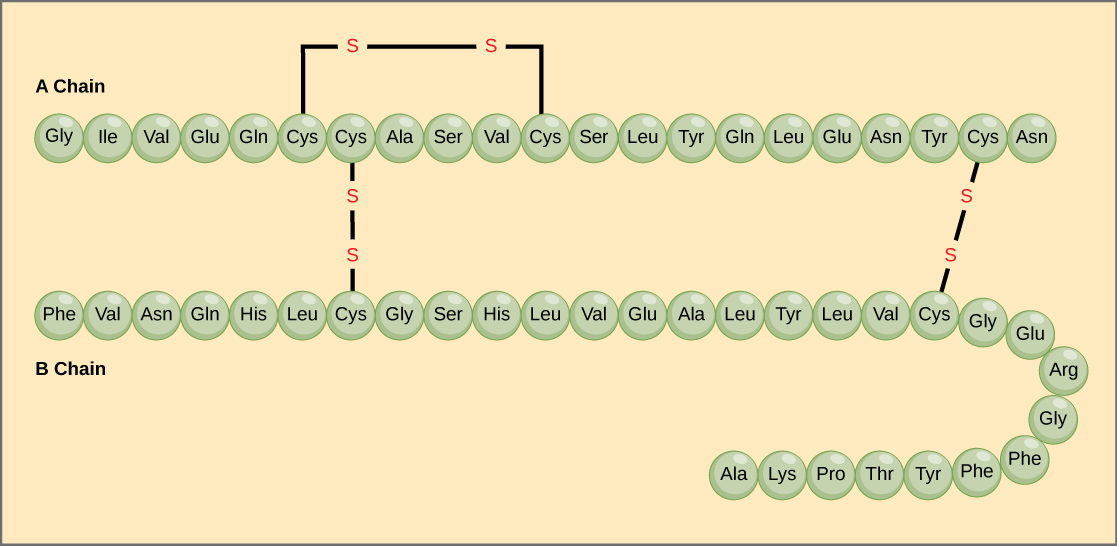
Kuva 4. Naudan seerumin insuliini on proteiinihormoni, joka koostuu kahdesta peptidiketjusta, A:sta (pituus 21 aminohappoa) ja B:stä (pituus 30 aminohappoa). Kummassakin ketjussa primaarirakenne on merkitty kolmikirjaimisilla lyhenteillä, jotka edustavat aminohappojen nimiä niiden esiintymisjärjestyksessä. Aminohappo kysteiinillä (cys) on sivuketjuna sulfhydryyliryhmä (SH). Kaksi sulfhydryyliryhmää voi hapen läsnä ollessa reagoida muodostaen disulfidisidoksen (S-S). Kaksi disulfidisidosta yhdistää A- ja B-ketjut toisiinsa, ja kolmas auttaa A-ketjua taittumaan oikeaan muotoon. Huomaa, että kaikki disulfidisidokset ovat samanpituisia, mutta ne on piirretty erikokoisiksi selkeyden vuoksi.
Kunkin proteiinin yksilöllinen sekvenssi määräytyy viime kädessä proteiinia koodaavan geenin mukaan. Muutos geenin koodaavan alueen nukleotidisekvenssissä voi johtaa siihen, että kasvavaan polypeptidiketjuun lisätään eri aminohappo, mikä aiheuttaa muutoksen proteiinin rakenteessa ja toiminnassa. Sirppisoluanemiassa hemoglobiinin β-ketjussa (josta pieni osa näkyy kuvassa 5) on yksi aminohapon substituutio, mikä aiheuttaa muutoksen proteiinin rakenteessa ja toiminnassa.
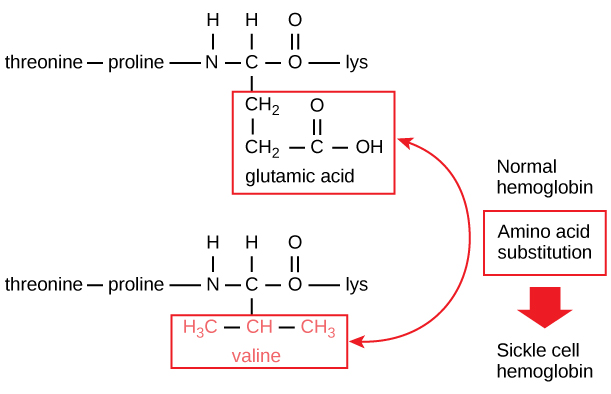
Kuva 5. Hemoglobiinin beetaketju on 147 jäännöstä pitkä, mutta yksi aminohapon substituutio johtaa sirppisoluanemiaan. Normaalissa hemoglobiinissa asemassa seitsemän oleva aminohappo on glutamaatti. Sirppisoluhemoglobiinissa tämä glutamaatti on korvattu valiinilla.
Kohtaisesti β-ketjussa aminohappo glutamiinihappo on korvattu valiinilla. Huomionarvoista on se, että hemoglobiinimolekyyli koostuu kahdesta alfaketjusta ja kahdesta beetaketjusta, jotka kumpikin koostuvat noin 150 aminohaposta. Molekyylissä on siis noin 600 aminohappoa. Rakenteellinen ero normaalin hemoglobiinimolekyylin ja sirppisolumolekyylin välillä – joka vähentää dramaattisesti elinajanodotetta – on yksi aminohappo näistä 600:sta. Vielä huomattavampaa on se, että näitä 600 aminohappoa koodataan kolmella nukleotidilla kutakin, ja mutaatio aiheutuu yhden emäksen muutoksesta (pistemutaatio), joka on yksi 1800:sta emäksestä.
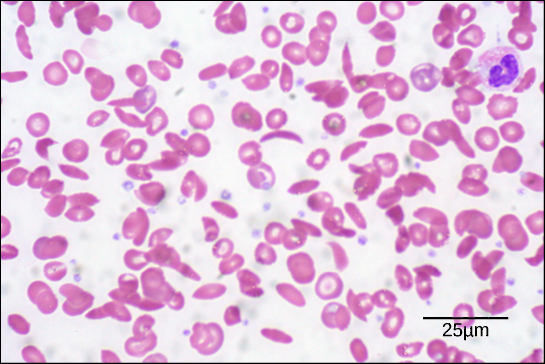
Kuvaus 6. Tässä 535-kertaisella suurennoksella kirkkaalla kenttämikroskoopilla visualisoidussa verinäytteessä sirppisolut ovat puolikuun muotoisia, kun taas normaalit solut ovat kiekon muotoisia. (luotto: Ed Uthmanin työn muokkaus; mittakaavapalkkiaineisto Matt Russellilta)
Tämän ketjun yhden aminohapon muutoksen vuoksi hemoglobiinimolekyylit muodostavat pitkiä kuituja, jotka vääristävät kaksoiskuperia eli levynmuotoisia punasoluja ja omaksuvat puolikuun eli ”sirpin” muodon, joka tukkii valtimoita (kuva 6). Tämä voi johtaa lukemattomiin vakaviin terveysongelmiin, kuten hengenahdistukseen, huimaukseen, päänsärkyyn ja vatsakipuihin sairaudesta kärsiville.
Sekundäärirakenne
Polypeptidin paikallinen taittuminen joillakin alueilla synnyttää proteiinin sekundäärirakenteen. Yleisimpiä ovat α-helix- ja β-pleated sheet -rakenteet (kuva 7). Molemmat rakenteet ovat α-helix-rakennetta – kierteitä, joita vetysidokset pitävät muodossaan. Vetysidokset muodostuvat yhden aminohapon karbonyyliryhmän happiatomin ja neljä aminohappoa kauempana ketjussa olevan toisen aminohapon välille.
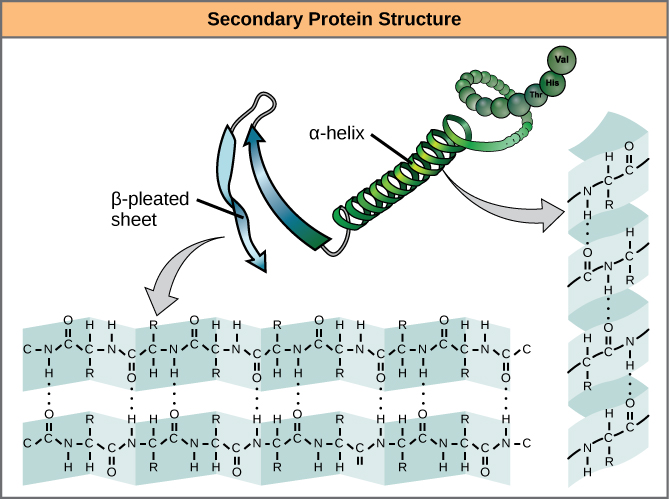
Kuva 7. α-helix ja β-pleated sheet ovat proteiinien sekundäärirakenteita, jotka muodostuvat peptidirungon karbonyyli- ja aminoryhmien välisen vetysidoksen vuoksi. Tietyillä aminohapoilla on taipumus muodostaa α-kierre, kun taas toisilla on taipumus muodostaa β-pleated sheet.
Jokaiseen kierteiseen kierteeseen alfa-kierteessä on 3,6 aminohappojäännöstä. Polypeptidin R-ryhmät (muunnosryhmät) työntyvät ulos α-kierteestä. β-eliakselissa ”laskokset” muodostuvat polypeptidiketjun selkärangan atomien välisistä vetysidoksista. R-ryhmät ovat kiinnittyneet hiileihin ja ulottuvat laskoksen poimujen ylä- ja alapuolelle. Laskostetut segmentit asettuvat rinnakkain tai vastakkain toisiinsa nähden, ja vetysidokset muodostuvat aminoryhmän osittain positiivisen typpiatomin ja peptidin selkärangan karbonyyliryhmän osittain negatiivisen happiatomin välille. α-helix- ja β-pleated sheet -rakenteita esiintyy useimmissa globulaarisissa ja kuituproteiineissa, ja niillä on tärkeä rakenteellinen merkitys.
Tertiäärirakenne
Polypeptidin ainutlaatuinen kolmiulotteinen rakenne on sen tertiäärirakenne (kuva 8). Tämä rakenne johtuu osittain polypeptidiketjussa vaikuttavista kemiallisista vuorovaikutuksista. Ensisijaisesti R-ryhmien väliset vuorovaikutukset luovat proteiinin monimutkaisen kolmiulotteisen tertiäärirakenteen. Aminohapoissa esiintyvien R-ryhmien luonne voi olla vastakkainen tavanomaisille sekundäärirakenteille kuvattujen vetysidosten muodostumiselle. Esimerkiksi R-ryhmät, joilla on samanlainen varaus, hylkivät toisiaan ja R-ryhmät, joilla on erilainen varaus, vetävät toisiaan puoleensa (ionisidokset). Kun proteiini taittuu, poolittomien aminohappojen hydrofobiset R-ryhmät sijaitsevat proteiinin sisällä, kun taas hydrofiiliset R-ryhmät sijaitsevat sen ulkopuolella. Edellisiä vuorovaikutustyyppejä kutsutaan myös hydrofobisiksi vuorovaikutuksiksi. Kysteiinisivuketjujen välinen vuorovaikutus muodostaa hapen läsnäollessa disulfidisidoksia, jotka ovat ainoat kovalenttiset sidokset, jotka muodostuvat proteiinien taittumisen aikana.
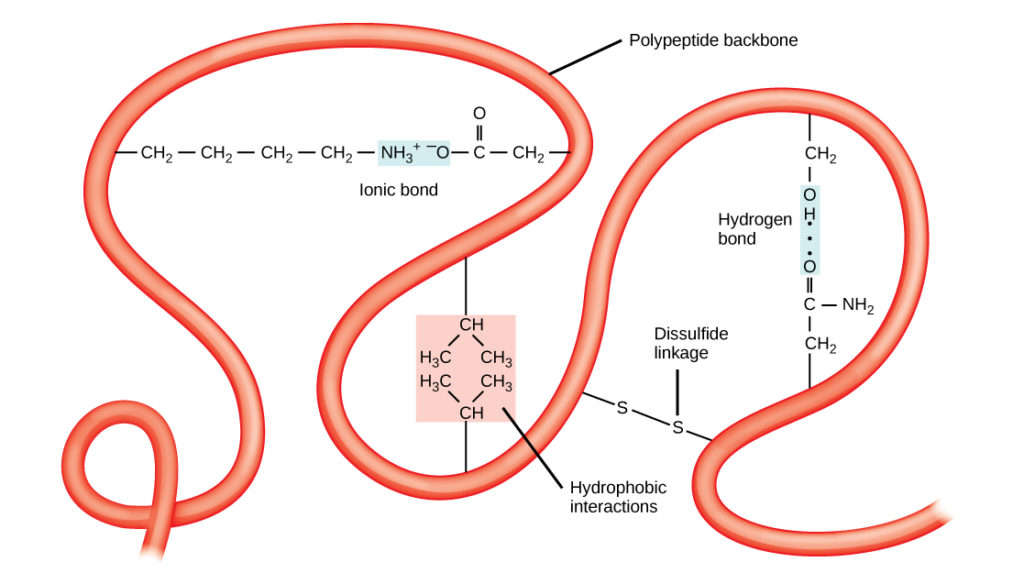
Kuva 8. Kysteiinisivuketjujen välinen vuorovaikutus. Proteiinien tertiäärirakenne määräytyy erilaisten kemiallisten vuorovaikutusten perusteella. Näihin kuuluvat hydrofobiset vuorovaikutukset, ionisidokset, vetysidokset ja disulfidisidokset.
Kaikki nämä vuorovaikutukset, heikot ja vahvat, määrittävät proteiinin lopullisen kolmiulotteisen muodon. Kun proteiini menettää kolmiulotteisen muotonsa, se ei välttämättä ole enää toimiva.
Kvaternäärirakenne
Luonnossa jotkin proteiinit muodostuvat useista polypeptideistä, joita kutsutaan myös alayksiköiksi, ja näiden alayksiköiden vuorovaikutus muodostaa kvaternäärirakenteen. Alayksiköiden väliset heikot vuorovaikutukset auttavat vakauttamaan kokonaisrakennetta. Esimerkiksi insuliinissa (pallomaisessa proteiinissa) on vetysidosten ja disulfidisidosten yhdistelmä, jonka ansiosta se on suurimmaksi osaksi kasaantunut pallon muotoon. Insuliini alkaa yksittäisenä polypeptidinä ja menettää joitakin sisäisiä sekvenssejä translaationjälkeisen modifikaation seurauksena sen jälkeen, kun jäljellä olevat ketjut koossa pitävien disulfidisidosten muodostumisen jälkeen. Silkillä (kuituproteiinilla) sen sijaan on β-viirullinen levyrakenne, joka on seurausta eri ketjujen välisistä vetysidoksista.
Kuvassa 9 on havainnollistettu proteiinien rakenteen neljä tasoa (primaarinen, sekundaarinen, tertiäärinen ja kvaternaarinen).
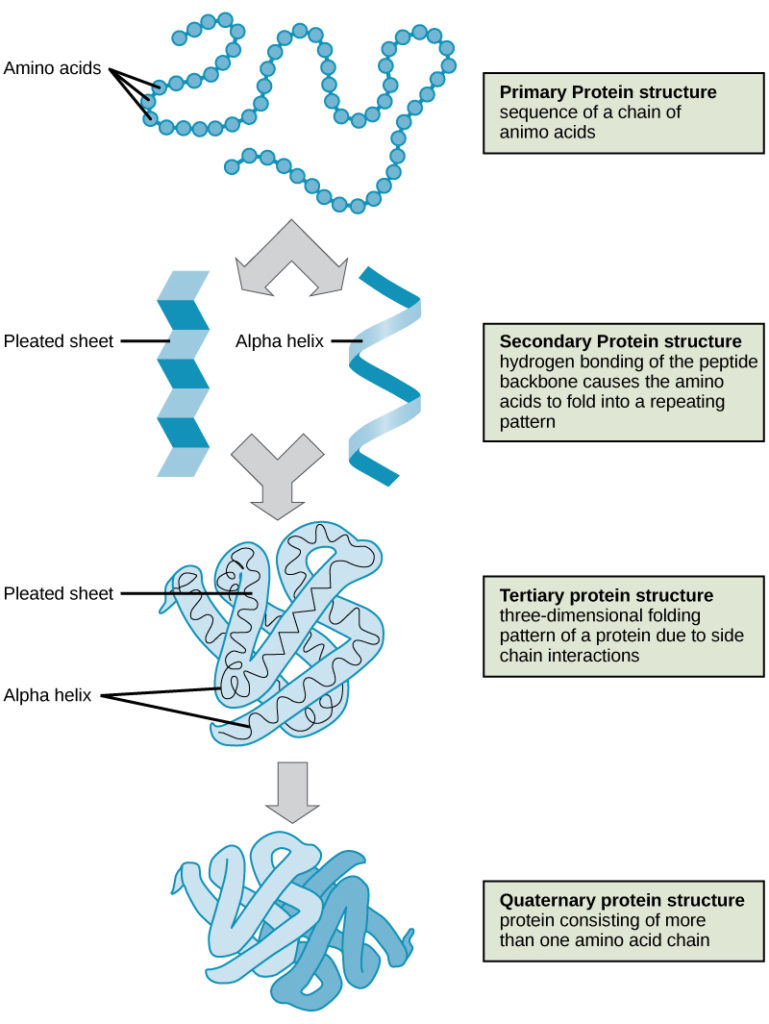
Kuva 9. Proteiinien rakenne. Proteiinirakenteen neljä tasoa voidaan havaita näissä kuvissa. (luotto: National Human Genome Research Institute:n työn muokkaus)
Denaturoituminen ja proteiinien taittuminen
Kullakin proteiinilla on oma ainutlaatuinen sekvenssi ja muoto, joita kemialliset vuorovaikutukset pitävät yhdessä. Jos proteiini altistuu lämpötilan tai pH:n muutoksille tai altistuu kemikaaleille, proteiinin rakenne voi muuttua ja menettää muotonsa menettämättä ensisijaista sekvenssiään niin sanotussa denaturaatiossa. Denaturoituminen on usein palautuvaa, koska polypeptidin primaarirakenne säilyy prosessissa, jos denaturoiva aine poistetaan, jolloin proteiini voi jatkaa toimintaansa. Joskus denaturaatio on peruuttamatonta, jolloin proteiini menettää toimintansa. Yksi esimerkki peruuttamattomasta proteiinin denaturoitumisesta on kananmunan paistaminen. Nestemäisessä kananmunan valkuaisessa oleva albumiiniproteiini denaturoituu, kun se pannaan kuumalle pannulle. Kaikki proteiinit eivät denaturoidu korkeissa lämpötiloissa; esimerkiksi kuumissa lähteissä elävillä bakteereilla on proteiineja, jotka toimivat lähes kiehuvissa lämpötiloissa. Mahalaukku on myös hyvin hapan, sen pH on alhainen ja se denaturoi proteiineja osana ruoansulatusprosessia; mahalaukun ruoansulatusentsyymit säilyttävät kuitenkin aktiivisuutensa näissä olosuhteissa.
Proteiinien taittuminen on kriittistä niiden toiminnan kannalta. Alun perin ajateltiin, että proteiinit itse ovat vastuussa taittumisprosessista. Vasta hiljattain havaittiin, että usein ne saavat taittumisprosessissa apua proteiinien avustajilta, joita kutsutaan chaperoneiksi (tai chaperonineiksi) ja jotka liittyvät kohdeproteiiniin taittumisprosessin aikana. Ne toimivat estämällä täydellisen proteiinirakenteen muodostavien polypeptidien aggregoitumisen, ja ne irrottautuvat proteiinista, kun kohdeproteiini on taittunut.
Proteiinien tehtävät
Taulukossa 1 on lueteltu proteiinien päätyypit ja tehtävät.
| Taulukko 1. Proteiinien tehtävät. Proteiinien tyypit ja toiminnot | ||
|---|---|---|
| Tyyppi | Esimerkkejä | Toiminnot |
| Ruuansulatusentsyymit | Amylaasi, lipaasi, pepsiini, trypsiini | Hyötyvät ruoan sulatuksessa katabolisoimalla ravintoaineet monomeerisiksi yksiköiksi |
| Kuljetus | Hemoglobiini, albumiini | Kuljettavat veressä tai imusolmukkeessa olevia aineita koko elimistössä |
| Rakenteet | Actin, tubuliini, keratiini | Rakentavat erilaisia rakenteita, kuten sytoskelettiä |
| Hormonit | Insuliini, tyroksiini | Koordinoivat elimistön eri järjestelmien toimintaa |
| Puolustus | Immunoglobuliinit | Suojaavat elimistöä vierasperäisiltä taudinaiheuttajilta |
| Kontraktiili | Actin, myosiini | Tehostavat lihassupistusta |
| Varastointi | Lihan varastoproteiinit, kananmunan valkuainen (albumiini) | Tarjoavat ravintoa alkion ja taimen varhaiskehityksessä |
Kahta erityyppistä ja tavallista valkuaista ovat entsyymit ja hormonit. Elävien solujen tuottamat entsyymit ovat katalyyttejä biokemiallisissa reaktioissa (kuten ruoansulatuksessa), ja ne ovat yleensä monimutkaisia tai konjugoituneita proteiineja. Kukin entsyymi on spesifinen sille substraatille (reaktantti, joka sitoutuu entsyymiin), johon se vaikuttaa. Entsyymi voi auttaa hajotus-, uudelleenjärjestely- tai synteesireaktioissa. Entsyymejä, jotka hajottavat substraattejaan, kutsutaan katabolisiksi entsyymeiksi, entsyymejä, jotka rakentavat substraateistaan monimutkaisempia molekyylejä, kutsutaan anabolisiksi entsyymeiksi, ja entsyymejä, jotka vaikuttavat reaktionopeuteen, kutsutaan katalyyttisiksi entsyymeiksi. On huomattava, että kaikki entsyymit lisäävät reaktionopeutta, ja siksi niitä pidetään orgaanisina katalyytteinä. Esimerkki entsyymistä on syljen amylaasi, joka hydrolysoi substraattinsa amyloosin, joka on tärkkelyksen komponentti.
Hormonit ovat hormonaalisten solujen erittämiä kemiallisia signaalimolekyylejä, yleensä pieniä proteiineja tai steroideja, jotka ohjaavat tai säätelevät tiettyjä fysiologisia prosesseja, kuten kasvua, kehitystä, aineenvaihduntaa ja lisääntymistä. Esimerkiksi insuliini on proteiinihormoni, joka auttaa säätelemään veren glukoosipitoisuutta.
Proteiineilla on erilaiset muodot ja molekyylipainot; jotkut proteiinit ovat muodoltaan pallomaisia, kun taas toiset ovat luonteeltaan kuitumaisia. Esimerkiksi hemoglobiini on pallomainen proteiini, mutta ihossamme esiintyvä kollageeni on kuitumainen proteiini. Proteiinien muoto on kriittinen sen toiminnan kannalta, ja tätä muotoa ylläpitävät monet erityyppiset kemialliset sidokset. Lämpötilan ja pH:n muutokset sekä altistuminen kemikaaleille voivat johtaa proteiinin muodon pysyviin muutoksiin, jolloin proteiini menettää toimintakykynsä eli denaturoituu. Kaikki proteiinit koostuvat samantyyppisten 20 aminohapon erilaisista järjestelyistä.
Yhteenveto: Proteiinit
Proteiinit ovat makromolekyylien luokka, jotka suorittavat solulle monenlaisia tehtäviä. Ne auttavat aineenvaihdunnassa tarjoamalla rakenteellista tukea ja toimimalla entsyymeinä, kantajina tai hormoneina. Proteiinien rakennuspalikat (monomeerit) ovat aminohappoja. Jokaisessa aminohapossa on keskeinen hiili, johon liittyy aminoryhmä, karboksyyliryhmä, vetyatomi ja R-ryhmä tai sivuketju. Yleisesti esiintyviä aminohappoja on 20, joista jokainen eroaa R-ryhmän osalta. Kukin aminohappo liittyy naapureihinsa peptidisidoksella. Pitkä aminohappoketju tunnetaan nimellä polypeptidi.
Proteiinit ovat järjestäytyneet neljällä tasolla: primaarinen, sekundaarinen, tertiäärinen ja (valinnainen) kvaternaarinen. Primaarirakenne on aminohappojen yksilöllinen sekvenssi. Toissijaisen rakenteen muodostaa polypeptidin paikallinen taittuminen α-kierteen ja β-levyn kaltaisten rakenteiden muodostamiseksi. Kolmiulotteinen kokonaisrakenne on tertiäärirakenne. Kun kaksi tai useampi polypeptidi yhdistyy muodostaen täydellisen proteiinirakenteen, konfiguraatiota kutsutaan proteiinin kvaternäärirakenteeksi. Proteiinien muoto ja toiminta liittyvät läheisesti toisiinsa; lämpötilan tai pH:n muutosten aiheuttama muodon muutos voi johtaa proteiinin denaturoitumiseen ja toiminnan heikkenemiseen.
Tarkista ymmärryksesi
Vastaamalla alla olevaan kysymykseen (kysymyksiin) näet, kuinka hyvin ymmärrät edellisessä jaksossa käsitellyt aiheet. Tätä lyhyttä tietovisaa ei lasketa kurssin arvosanaan, ja voit suorittaa sen uudelleen rajoittamattoman määrän kertoja.
Käytä tätä tietovisaa tarkistaaksesi ymmärryksesi ja päättäessäsi, (1) opiskeletko edellistä jaksoa tarkemmin vai (2) siirrytkö seuraavaan jaksoon.