- Describir la estructura y función de las proteínas
- Objetivos de aprendizaje
- Aminoácidos
- Pregunta práctica
- El significado evolutivo del citocromo c
- Estructura de la proteína
- Estructura primaria
- Estructura secundaria
- Estructura terciaria
- Estructura cuaternaria
- Denaturación y plegado de proteínas
- Función de las proteínas
- En Resumen: Proteínas
- Compruebe su comprensión
Describir la estructura y función de las proteínas
Las proteínas son polímeros de aminoácidos. Cada aminoácido contiene un carbono central, un hidrógeno, un grupo carboxilo, un grupo amino y un grupo R variable. El grupo R especifica a qué clase de aminoácidos pertenece: cadenas laterales hidrofílicas con carga eléctrica, cadenas laterales polares pero sin carga, cadenas laterales hidrofóbicas no polares y casos especiales.
Las proteínas tienen diferentes «capas» de estructura: primaria, secundaria, terciaria y cuaternaria.
Las proteínas tienen una variedad de funciones en las células. Las principales funciones incluyen actuar como enzimas, receptores, moléculas de transporte, proteínas reguladoras de la expresión génica, etc. Las enzimas son catalizadores biológicos que aceleran una reacción química sin alterarse permanentemente. Tienen «sitios activos» donde se une el sustrato/reaccionante, y pueden ser activadas o inhibidas (inhibidores competitivos y/o no competitivos).
Objetivos de aprendizaje
- Demostrar familiaridad con las unidades monoméricas de las proteínas: los aminoácidos
- Definir las diferentes capas de la estructura de las proteínas
- Identificar varias funciones principales de las proteínas
Aminoácidos
Las proteínas son una de las moléculas orgánicas más abundantes en los sistemas vivos y tienen la gama de funciones más diversa de todas las macromoléculas. Las proteínas pueden ser estructurales, reguladoras, contráctiles o protectoras; pueden servir para el transporte, el almacenamiento o las membranas; o pueden ser toxinas o enzimas. Cada célula de un sistema vivo puede contener miles de proteínas, cada una con una función única. Sus estructuras, al igual que sus funciones, varían enormemente. Sin embargo, todas son polímeros de aminoácidos, dispuestos en una secuencia lineal.

Figura 1. Los aminoácidos tienen un carbono central asimétrico al que se unen un grupo amino, un grupo carboxilo, un átomo de hidrógeno y una cadena lateral (grupo R).
Los aminoácidos son los monómeros que forman las proteínas. Cada aminoácido tiene la misma estructura fundamental, que consiste en un átomo de carbono central, también conocido como carbono alfa (α), unido a un grupo amino (NH2), a un grupo carboxilo (COOH) y a un átomo de hidrógeno. Cada aminoácido también tiene otro átomo o grupo de átomos unidos al átomo central conocido como grupo R (Figura 1).
El nombre «aminoácido» se deriva del hecho de que contienen tanto el grupo amino como el grupo carboxilo-ácido en su estructura básica. Como se ha mencionado, hay 20 aminoácidos presentes en las proteínas. Diez de ellos se consideran aminoácidos esenciales en el ser humano porque el cuerpo humano no puede producirlos y se obtienen de la dieta.
Para cada aminoácido, el grupo R (o cadena lateral) es diferente (Figura 2).
Pregunta práctica

Figura 2. Hay 20 aminoácidos comunes que se encuentran habitualmente en las proteínas, cada uno con un grupo R (grupo variante) diferente que determina su naturaleza química.
¿Qué categorías de aminoácidos esperaría encontrar en la superficie de una proteína soluble y cuáles en el interior? ¿Qué distribución de aminoácidos esperaría encontrar en una proteína incrustada en una bicapa lipídica?
La naturaleza química de la cadena lateral determina la naturaleza del aminoácido (es decir, si es ácida, básica, polar o no polar). Por ejemplo, el aminoácido glicina tiene un átomo de hidrógeno como grupo R. Los aminoácidos como la valina, la metionina y la alanina son de naturaleza no polar o hidrofóbica, mientras que los aminoácidos como la serina, la treonina y la cisteína son polares y tienen cadenas laterales hidrofílicas. Las cadenas laterales de la lisina y la arginina tienen carga positiva, por lo que estos aminoácidos también se conocen como aminoácidos básicos. La prolina tiene un grupo R que está unido al grupo amino, formando una estructura anular. La prolina es una excepción a la estructura estándar de un animoácido ya que su grupo amino no está separado de la cadena lateral (Figura 2).
Los aminoácidos se representan con una sola letra mayúscula o con una abreviatura de tres letras. Por ejemplo, la valina se conoce por la letra V o el símbolo de tres letras val. Al igual que algunos ácidos grasos son esenciales en una dieta, algunos aminoácidos también son necesarios. Se conocen como aminoácidos esenciales, y en los humanos incluyen la isoleucina, la leucina y la cisteína. Los aminoácidos esenciales se refieren a los necesarios para la construcción de proteínas en el cuerpo, aunque no sean producidos por éste; qué aminoácidos son esenciales varía de un organismo a otro.

Figura 3. La formación del enlace peptídico es una reacción de síntesis por deshidratación. El grupo carboxilo de un aminoácido se une al grupo amino del aminoácido entrante. En el proceso, se libera una molécula de agua.
La secuencia y el número de aminoácidos determinan en última instancia la forma, el tamaño y la función de la proteína. Cada aminoácido está unido a otro aminoácido mediante un enlace covalente, conocido como enlace peptídico, que se forma mediante una reacción de deshidratación. El grupo carboxilo de un aminoácido y el grupo amino del aminoácido entrante se combinan, liberando una molécula de agua. El enlace resultante es el enlace peptídico (Figura 3).
Los productos formados por dichos enlaces se denominan péptidos. A medida que más aminoácidos se unen a esta cadena creciente, la cadena resultante se conoce como polipéptido. Cada polipéptido tiene un grupo amino libre en un extremo. Este extremo se denomina N terminal, o amino terminal, y el otro extremo tiene un grupo carboxilo libre, también conocido como C o carboxilo terminal. Aunque los términos polipéptido y proteína se utilizan a veces indistintamente, un polipéptido es técnicamente un polímero de aminoácidos, mientras que el término proteína se utiliza para un polipéptido o polipéptidos que se han combinado entre sí, a menudo tienen grupos prostéticos no peptídicos unidos, tienen una forma distinta y tienen una función única. Después de la síntesis de proteínas (traducción), la mayoría de las proteínas sufren modificaciones. Éstas se conocen como modificaciones postraduccionales. Pueden sufrir una escisión, una fosforilación o pueden requerir la adición de otros grupos químicos. Sólo después de estas modificaciones la proteína es completamente funcional.
El significado evolutivo del citocromo c
El citocromo c es un componente importante de la cadena de transporte de electrones, una parte de la respiración celular, y se encuentra normalmente en el orgánulo celular, la mitocondria. Esta proteína tiene un grupo prostético hemo, y el ion central del hemo se reduce y se oxida alternativamente durante la transferencia de electrones. Dado que el papel de esta proteína esencial en la producción de energía celular es crucial, ha cambiado muy poco a lo largo de millones de años. La secuenciación de proteínas ha demostrado que existe una cantidad considerable de homología de la secuencia de aminoácidos del citocromo c entre las distintas especies; en otras palabras, el parentesco evolutivo puede evaluarse midiendo las similitudes o diferencias entre las secuencias de ADN o proteínas de varias especies.
Los científicos han determinado que el citocromo c humano contiene 104 aminoácidos. Para cada molécula de citocromo c de diferentes organismos que se ha secuenciado hasta la fecha, 37 de estos aminoácidos aparecen en la misma posición en todas las muestras de citocromo c. Esto indica que puede haber un ancestro común. Al comparar las secuencias de proteínas de humanos y chimpancés, no se encontró ninguna diferencia de secuencia. Cuando se compararon las secuencias de humanos y monos rhesus, la única diferencia encontrada fue en un aminoácido. En otra comparación, la secuenciación humana con la de la levadura muestra una diferencia en la posición 44.
Estructura de la proteína
Como se ha comentado anteriormente, la forma de una proteína es fundamental para su función. Por ejemplo, una enzima puede unirse a un sustrato específico en un sitio conocido como sitio activo. Si este sitio activo se altera debido a cambios locales o a cambios en la estructura general de la proteína, la enzima puede ser incapaz de unirse al sustrato. Para comprender cómo la proteína adquiere su forma o conformación final, debemos entender los cuatro niveles de la estructura proteica: primario, secundario, terciario y cuaternario.
Estructura primaria
La secuencia única de aminoácidos en una cadena polipeptídica es su estructura primaria. Por ejemplo, la hormona pancreática insulina tiene dos cadenas polipeptídicas, A y B, y están unidas por enlaces disulfuro. El aminoácido terminal N de la cadena A es la glicina, mientras que el aminoácido terminal C es la asparagina (Figura 4). Las secuencias de aminoácidos de las cadenas A y B son exclusivas de la insulina.
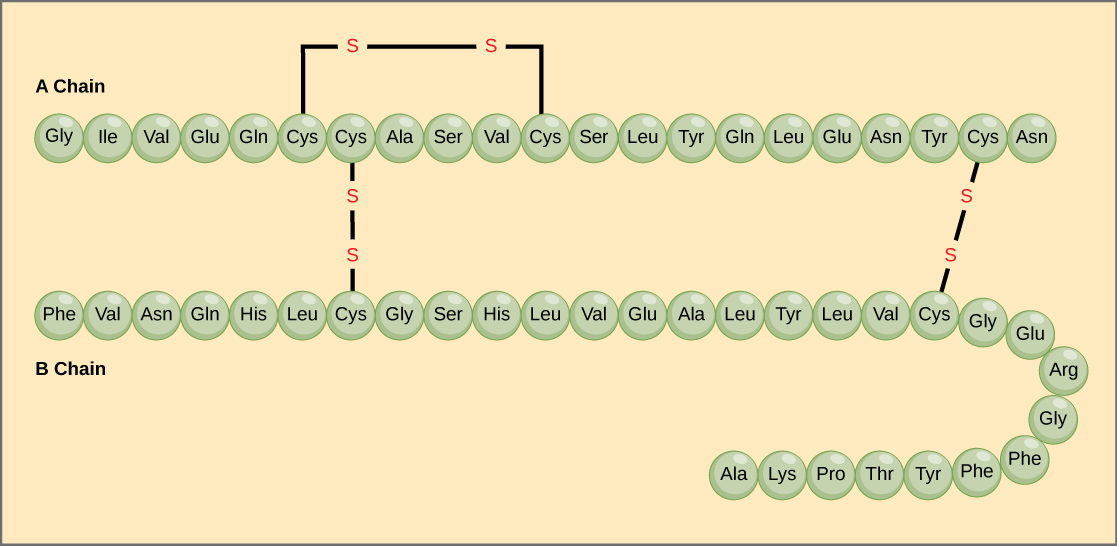
Figura 4. La insulina del suero bovino es una hormona proteica formada por dos cadenas peptídicas, la A (de 21 aminoácidos) y la B (de 30 aminoácidos). En cada cadena, la estructura primaria se indica mediante abreviaturas de tres letras que representan los nombres de los aminoácidos en el orden en que están presentes. El aminoácido cisteína (cys) tiene un grupo sulfhidrilo (SH) como cadena lateral. Dos grupos sulfhidrilos pueden reaccionar en presencia de oxígeno para formar un enlace disulfuro (S-S). Dos enlaces disulfuro conectan las cadenas A y B, y un tercero ayuda a la cadena A a plegarse en la forma correcta. Obsérvese que todos los enlaces disulfuro tienen la misma longitud, pero se han dibujado de diferentes tamaños para mayor claridad.
La secuencia única de cada proteína viene determinada en última instancia por el gen que la codifica. Un cambio en la secuencia de nucleótidos de la región codificante del gen puede hacer que se añada un aminoácido diferente a la cadena polipeptídica en crecimiento, provocando un cambio en la estructura y la función de la proteína. En la anemia falciforme, la cadena β de la hemoglobina (de la que se muestra una pequeña porción en la figura 5) tiene una única sustitución de aminoácidos, lo que provoca un cambio en la estructura y la función de la proteína.
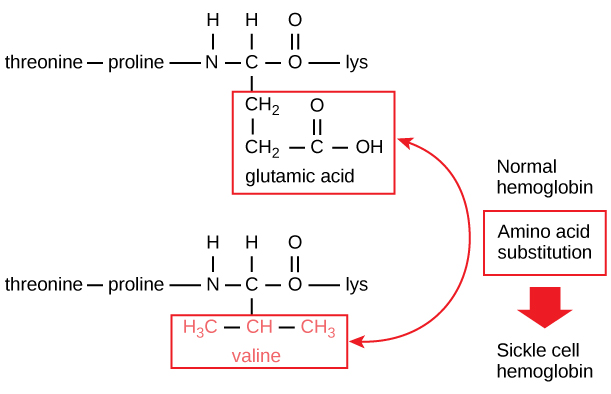
Figura 5. La cadena beta de la hemoglobina tiene una longitud de 147 residuos y, sin embargo, una única sustitución de aminoácidos da lugar a la anemia falciforme. En la hemoglobina normal, el aminoácido en la posición siete es glutamato. En la hemoglobina falciforme, este glutamato se sustituye por una valina.
Específicamente, el aminoácido ácido glutámico se sustituye por valina en la cadena β. Lo que más llama la atención es que una molécula de hemoglobina está formada por dos cadenas alfa y dos cadenas beta que constan cada una de unos 150 aminoácidos. La molécula, por tanto, tiene unos 600 aminoácidos. La diferencia estructural entre una molécula de hemoglobina normal y una molécula de células falciformes -que disminuye drásticamente la esperanza de vida- es un solo aminoácido de los 600. Lo que es aún más notable es que esos 600 aminoácidos están codificados por tres nucleótidos cada uno, y la mutación es causada por un solo cambio de base (mutación puntual), 1 en 1800 bases.
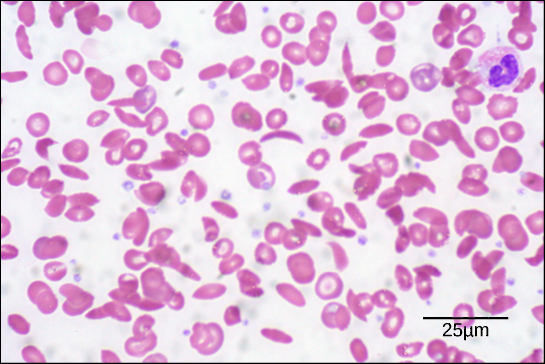
Figura 6. En este frotis de sangre, visualizado a 535 aumentos mediante microscopía de campo claro, las células falciformes tienen forma de media luna, mientras que las células normales tienen forma de disco. (Crédito: modificación del trabajo de Ed Uthman; datos de la barra de escala de Matt Russell)
Debido a este cambio de un aminoácido en la cadena, las moléculas de hemoglobina forman largas fibras que distorsionan los glóbulos rojos bicóncavos, o con forma de disco, y adoptan una forma de media luna o «hoz», que obstruye las arterias (Figura 6). Esto puede provocar un sinfín de problemas de salud graves, como disnea, mareos, dolores de cabeza y dolores abdominales a los afectados por esta enfermedad.
Estructura secundaria
El plegado local del polipéptido en algunas regiones da lugar a la estructura secundaria de la proteína. Las más comunes son las estructuras de α-hélice y β-hoja plegada (Figura 7). Ambas estructuras son la estructura de la hélice α, que se mantiene en forma gracias a los enlaces de hidrógeno. Los enlaces de hidrógeno se forman entre el átomo de oxígeno del grupo carbonilo de un aminoácido y otro aminoácido que está cuatro aminoácidos más adelante en la cadena.
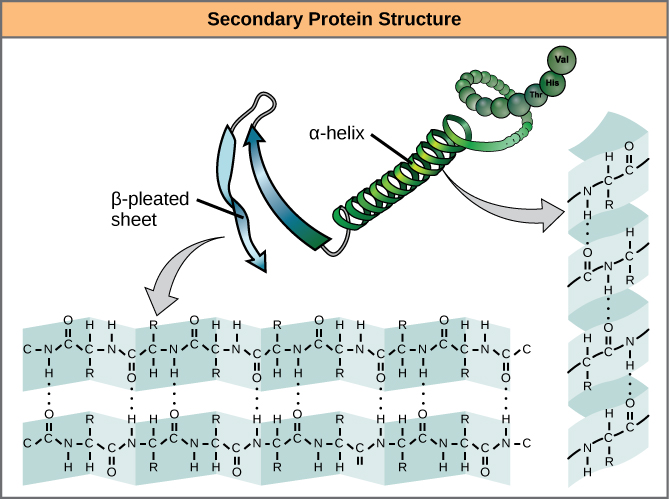
Figura 7. La hélice α y la lámina β-plegada son estructuras secundarias de las proteínas que se forman debido al enlace de hidrógeno entre los grupos carbonilo y amino del esqueleto peptídico. Ciertos aminoácidos tienen propensión a formar una α-hélice, mientras que otros tienen propensión a formar una hoja β-plegada.
Cada vuelta helicoidal en una alfa-hélice tiene 3,6 residuos de aminoácidos. Los grupos R (los grupos variantes) del polipéptido sobresalen de la cadena α-hélice. En la hoja β-plegada, los «pliegues» se forman por enlaces de hidrógeno entre los átomos de la columna vertebral de la cadena polipeptídica. Los grupos R están unidos a los carbonos y se extienden por encima y por debajo de los pliegues del plisado. Los segmentos plegados se alinean de forma paralela o antiparalela entre sí, y se forman enlaces de hidrógeno entre el átomo de nitrógeno parcialmente positivo del grupo amino y el átomo de oxígeno parcialmente negativo del grupo carbonilo de la columna vertebral del péptido. Las estructuras de α-hélice y β-hoja plegada se encuentran en la mayoría de las proteínas globulares y fibrosas y desempeñan un importante papel estructural.
Estructura terciaria
La única estructura tridimensional de un polipéptido es su estructura terciaria (Figura 8). Esta estructura se debe en parte a las interacciones químicas que se producen en la cadena polipeptídica. Principalmente, las interacciones entre los grupos R crean la compleja estructura terciaria tridimensional de una proteína. La naturaleza de los grupos R que se encuentran en los aminoácidos implicados puede contrarrestar la formación de los enlaces de hidrógeno descritos para las estructuras secundarias estándar. Por ejemplo, los grupos R con cargas similares se repelen entre sí y los que tienen cargas diferentes se atraen (enlaces iónicos). Cuando se produce el plegado de la proteína, los grupos R hidrofóbicos de los aminoácidos no polares se sitúan en el interior de la proteína, mientras que los grupos R hidrofílicos se sitúan en el exterior. Los primeros tipos de interacciones también se conocen como interacciones hidrofóbicas. La interacción entre las cadenas laterales de cisteína forma enlaces disulfuro en presencia de oxígeno, el único enlace covalente que se forma durante el plegado de la proteína.
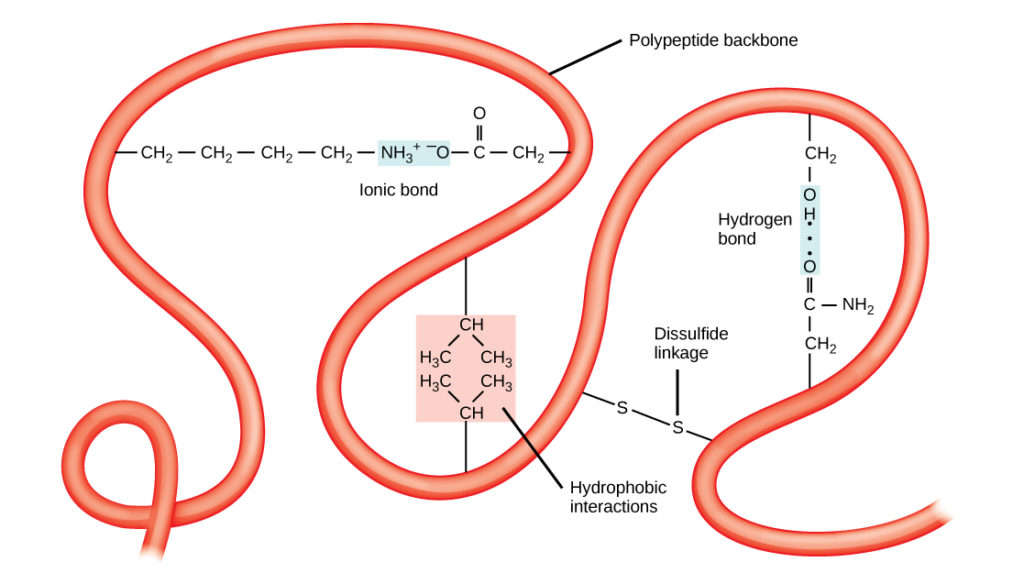
Figura 8. La estructura terciaria de las proteínas está determinada por una serie de interacciones químicas. Estas incluyen interacciones hidrofóbicas, enlaces iónicos, enlaces de hidrógeno y enlaces disulfuro.
Todas estas interacciones, débiles y fuertes, determinan la forma tridimensional final de la proteína. Cuando una proteína pierde su forma tridimensional, puede dejar de ser funcional.
Estructura cuaternaria
En la naturaleza, algunas proteínas están formadas por varios polipéptidos, también conocidos como subunidades, y la interacción de estas subunidades forma la estructura cuaternaria. Las interacciones débiles entre las subunidades ayudan a estabilizar la estructura global. Por ejemplo, la insulina (una proteína globular) tiene una combinación de enlaces de hidrógeno y de disulfuro que hace que se agrupe en su mayor parte en forma de bola. La insulina comienza como un solo polipéptido y pierde algunas secuencias internas en presencia de modificaciones postraduccionales tras la formación de los enlaces disulfuro que mantienen unidas las cadenas restantes. La seda (una proteína fibrosa), sin embargo, tiene una estructura de lámina β-plegada que es el resultado de los enlaces de hidrógeno entre las diferentes cadenas.
Los cuatro niveles de la estructura de las proteínas (primaria, secundaria, terciaria y cuaternaria) se ilustran en la figura 9.
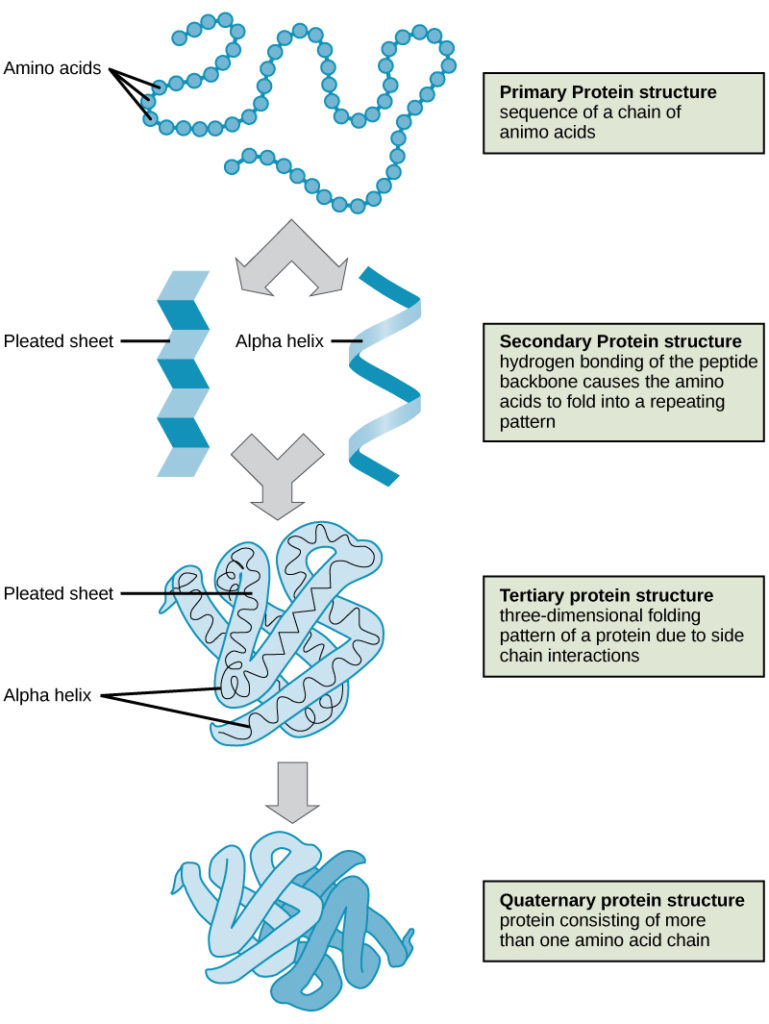
Figura 9. Los cuatro niveles de la estructura de las proteínas pueden observarse en estas ilustraciones. (crédito: modificación del trabajo del Instituto Nacional de Investigación del Genoma Humano)
Denaturación y plegado de proteínas
Cada proteína tiene su propia secuencia y forma únicas que se mantienen unidas por interacciones químicas. Si la proteína se somete a cambios de temperatura, pH o exposición a sustancias químicas, la estructura de la proteína puede cambiar, perdiendo su forma sin perder su secuencia primaria en lo que se conoce como desnaturalización. La desnaturalización suele ser reversible porque la estructura primaria del polipéptido se conserva en el proceso si se elimina el agente desnaturalizador, lo que permite a la proteína reanudar su función. A veces, la desnaturalización es irreversible y provoca la pérdida de la función. Un ejemplo de desnaturalización proteica irreversible es cuando se fríe un huevo. La proteína albúmina de la clara de huevo líquida se desnaturaliza al ponerla en una sartén caliente. No todas las proteínas se desnaturalizan a altas temperaturas; por ejemplo, las bacterias que sobreviven en aguas termales tienen proteínas que funcionan a temperaturas cercanas a la ebullición. El estómago también es muy ácido, tiene un pH bajo y desnaturaliza las proteínas como parte del proceso de digestión; sin embargo, las enzimas digestivas del estómago conservan su actividad en estas condiciones.
El plegamiento de las proteínas es fundamental para su función. Al principio se pensaba que las propias proteínas eran las responsables del proceso de plegado. Sólo recientemente se ha descubierto que, a menudo, reciben asistencia en el proceso de plegado por parte de ayudantes proteicos conocidos como chaperonas (o chaperoninas) que se asocian con la proteína objetivo durante el proceso de plegado. Actúan impidiendo la agregación de los polipéptidos que componen la estructura proteica completa, y se disocian de la proteína una vez que la proteína objetivo está plegada.
Función de las proteínas
Los principales tipos y funciones de las proteínas se enumeran en la Tabla 1.
| Tabla 1. Tipos de proteínas y funciones | ||
|---|---|---|
| Tipo | Ejemplos | Funciones |
| Enzimas digestivas | Amilasa, lipasa, pepsina, tripsina | Ayudan a la digestión de los alimentos catabolizando los nutrientes en unidades monoméricas |
| Transporte | Hemoglobina, albúmina | Transportan sustancias en la sangre o la linfa por todo el cuerpo |
| Estructurales | Actina, tubulina, queratina | Construyen diferentes estructuras, como el citoesqueleto |
| Hormonas | Insulina, tiroxina | Coordinan la actividad de diferentes sistemas corporales |
| Defensa | Inmunoglobulinas | Protegen el cuerpo de patógenos extraños |
| Contráctiles | Actina, miosina | Afectan la contracción muscular |
| Almacenamiento | Proteínas de almacenamiento de los vegetales, clara de huevo (albúmina) | Proporcionan alimento en el desarrollo temprano del embrión y la plántula |
Dos tipos especiales y comunes de proteínas son las enzimas y las hormonas. Las enzimas, que son producidas por las células vivas, son catalizadores en las reacciones bioquímicas (como la digestión) y suelen ser proteínas complejas o conjugadas. Cada enzima es específica para el sustrato (un reactivo que se une a una enzima) sobre el que actúa. La enzima puede ayudar en las reacciones de descomposición, reordenación o síntesis. Las enzimas que descomponen sus sustratos se denominan enzimas catabólicas, las que construyen moléculas más complejas a partir de sus sustratos se denominan enzimas anabólicas y las que afectan a la velocidad de reacción se denominan enzimas catalíticas. Cabe señalar que todas las enzimas aumentan la velocidad de reacción y, por tanto, se consideran catalizadores orgánicos. Un ejemplo de enzima es la amilasa salival, que hidroliza su sustrato, la amilosa, un componente del almidón.
Las hormonas son moléculas de señalización química, normalmente pequeñas proteínas o esteroides, segregadas por las células endocrinas que actúan para controlar o regular procesos fisiológicos específicos, incluyendo el crecimiento, el desarrollo, el metabolismo y la reproducción. Por ejemplo, la insulina es una hormona proteica que ayuda a regular el nivel de glucosa en sangre.
Las proteínas tienen diferentes formas y pesos moleculares; algunas proteínas tienen forma globular mientras que otras son de naturaleza fibrosa. Por ejemplo, la hemoglobina es una proteína globular, pero el colágeno, que se encuentra en nuestra piel, es una proteína fibrosa. La forma de las proteínas es fundamental para su función, y esta forma se mantiene gracias a muchos tipos diferentes de enlaces químicos. Los cambios de temperatura, el pH y la exposición a sustancias químicas pueden provocar cambios permanentes en la forma de la proteína, lo que lleva a la pérdida de su función, conocida como desnaturalización. Todas las proteínas están formadas por diferentes disposiciones de los mismos 20 tipos de aminoácidos.
En Resumen: Proteínas
Las proteínas son una clase de macromoléculas que realizan una diversa gama de funciones para la célula. Ayudan en el metabolismo proporcionando soporte estructural y actuando como enzimas, portadores u hormonas. Los bloques de construcción de las proteínas (monómeros) son los aminoácidos. Cada aminoácido tiene un carbono central que está unido a un grupo amino, un grupo carboxilo, un átomo de hidrógeno y un grupo R o cadena lateral. Existen 20 aminoácidos comunes, cada uno de los cuales difiere en el grupo R. Cada aminoácido está unido a sus vecinos por un enlace peptídico. Una cadena larga de aminoácidos se conoce como polipéptido.
Las proteínas se organizan en cuatro niveles: primario, secundario, terciario y (opcional) cuaternario. La estructura primaria es la secuencia única de aminoácidos. El plegado local del polipéptido para formar estructuras como la hélice α y la lámina β-plegada constituye la estructura secundaria. La estructura tridimensional global es la estructura terciaria. Cuando dos o más polipéptidos se combinan para formar la estructura proteica completa, la configuración se conoce como estructura cuaternaria de una proteína. La forma y la función de las proteínas están estrechamente vinculadas; cualquier cambio en la forma causado por cambios en la temperatura o el pH puede conducir a la desnaturalización de la proteína y a la pérdida de su función.
Compruebe su comprensión
Responda a la(s) pregunta(s) siguiente(s) para ver qué tan bien comprende los temas cubiertos en la sección anterior. Este breve cuestionario no cuenta para su calificación en la clase, y puede repetirlo un número ilimitado de veces.
Use este cuestionario para comprobar su comprensión y decidir si (1) estudiar más la sección anterior o (2) pasar a la siguiente.