Beskriv struktur og funktion af proteiner
Proteiner er polymerer af aminosyrer. Hver aminosyre indeholder et centralt kulstof, et hydrogen, en carboxylgruppe, en aminogruppe og en variabel R-gruppe. R-gruppen angiver, hvilken klasse af aminosyrer den tilhører: elektrisk ladede hydrofile sidekæder, polære men uladede sidekæder, upolære hydrofobiske sidekæder og specialtilfælde.
Proteiner har forskellige “lag” af struktur: primær, sekundær, tertiær, kvaternær.
Proteiner har en række forskellige funktioner i cellerne. De vigtigste funktioner er bl.a. at fungere som enzymer, receptorer, transportmolekyler, regulerende proteiner for genekspression m.m. Enzymer er biologiske katalysatorer, der fremskynder en kemisk reaktion uden at blive permanent ændret. De har “aktive steder”, hvor substratet/reaktanten binder sig, og de kan enten aktiveres eller hæmmes (kompetitive og/eller ikke-kompetitive inhibitorer).
Læringsmål
- Demonstrere kendskab til monomere enheder af proteiner: Aminosyrer
- Definere de forskellige lag af proteinstruktur
- Identificere flere af proteinernes hovedfunktioner
Aminosyrer
Proteiner er et af de mest hyppigt forekommende organiske molekyler i levende systemer og har den mest forskelligartede række af funktioner af alle makromolekyler. Proteiner kan være strukturelle, regulerende, kontraktile eller beskyttende, de kan fungere i transport, lagring eller membraner, eller de kan være toksiner eller enzymer. Hver celle i et levende system kan indeholde tusindvis af proteiner, som hver især har en unik funktion. Deres strukturer, ligesom deres funktioner, varierer meget. De er dog alle sammen polymerer af aminosyrer, der er anbragt i en lineær sekvens.

Figur 1. Aminosyrer har et centralt asymmetrisk kulstof, hvortil der er knyttet en aminogruppe, en carboxylgruppe, et hydrogenatom og en sidekæde (R-gruppe).
Aminosyrer er de monomerer, der udgør proteiner. Hver aminosyre har den samme grundlæggende struktur, som består af et centralt kulstofatom, også kendt som alfa (α)-kulstof, der er bundet til en aminogruppe (NH2), en carboxylgruppe (COOH) og til et hydrogenatom. Hver aminosyre har også et andet atom eller en anden gruppe af atomer bundet til det centrale atom, der er kendt som R-gruppen (figur 1).
Navnet “aminosyre” er afledt af, at de indeholder både aminogruppe og carboxylsyregruppe i deres grundstruktur. Som nævnt er der 20 aminosyrer til stede i proteiner. Ti af disse betragtes som essentielle aminosyrer hos mennesker, fordi menneskekroppen ikke kan producere dem, og de skal hentes gennem kosten.
For hver aminosyre er R-gruppen (eller sidekæden) forskellig (figur 2).
Praktikspørgsmål

Figur 2. Der findes 20 almindelige aminosyrer, der almindeligvis findes i proteiner, hver med en anden R-gruppe (variantgruppe), som bestemmer dens kemiske natur.
Hvilke kategorier af aminosyrer ville du forvente at finde på overfladen af et opløseligt protein, og hvilke ville du forvente at finde i det indre? Hvilken fordeling af aminosyrer ville du forvente at finde i et protein, der er indlejret i et lipiddobbeltlag?
Den kemiske natur af sidekæden bestemmer aminosyrens natur (dvs. om den er sur, basisk, polær eller upolær). For eksempel har aminosyren glycin et hydrogenatom som R-gruppe. Aminosyrer som valin, methionin og alanin er upolære eller hydrofobiske af natur, mens aminosyrer som serin, threonin og cystein er polære og har hydrofile sidekæder. Sidekæderne i lysin og arginin er positivt ladede, og derfor er disse aminosyrer også kendt som basiske aminosyrer. Prolin har en R-gruppe, der er knyttet til aminogruppen og danner en ringlignende struktur. Prolin er en undtagelse fra standardstrukturen for en animosyre, da dens aminogruppe ikke er adskilt fra sidekæden (figur 2).
Aminosyrer er repræsenteret ved et enkelt stort bogstav eller en forkortelse på tre bogstaver. For eksempel er valin kendt ved bogstavet V eller symbolet val på tre bogstaver. Ligesom nogle fedtsyrer er essentielle i en kost, er nogle aminosyrer også nødvendige. De er kendt som essentielle aminosyrer, og hos mennesker omfatter de isoleucin, leucin og cystein. Essentielle aminosyrer henviser til de aminosyrer, der er nødvendige for opbygningen af proteiner i kroppen, selv om de ikke produceres af kroppen; hvilke aminosyrer der er essentielle varierer fra organisme til organisme.

Figur 3. Peptidbindingsdannelse er en dehydreringssyntesereaktion. Carboxylgruppen i den ene aminosyre bindes til aminogruppen i den indkommende aminosyre. I processen frigøres et vandmolekyle.
Rækkefølgen og antallet af aminosyrer bestemmer i sidste ende proteinets form, størrelse og funktion. Hver aminosyre er knyttet til en anden aminosyre ved en kovalent binding, kendt som en peptidbinding, som dannes ved en dehydreringsreaktion. Carboxylgruppen i en aminosyre og aminogruppen i den indkommende aminosyre kombineres, hvorved der frigives et vandmolekyle. Den resulterende binding er peptidbindingen (figur 3).
De produkter, der dannes af sådanne bindinger, kaldes peptider. Når flere aminosyrer føjer sig til denne voksende kæde, kaldes den resulterende kæde for et polypeptid. Hvert polypeptid har en fri aminogruppe i den ene ende. Denne ende kaldes N-terminalen eller aminoterminalen, og den anden ende har en fri carboxylgruppe, også kendt som C- eller carboxylterminalen. Selv om udtrykkene polypeptid og protein undertiden anvendes i flæng, er et polypeptid teknisk set en polymer af aminosyrer, mens udtrykket protein anvendes om et polypeptid eller polypeptider, der er kombineret, ofte har bundet ikke-peptidprotetiske grupper, har en særskilt form og har en unik funktion. Efter proteinsyntesen (translation) er de fleste proteiner modificeret. Disse er kendt som posttranslationelle modifikationer. De kan underkastes spaltning, fosforylering eller kræve tilføjelse af andre kemiske grupper. Først efter disse modifikationer er proteinet helt funktionelt.
Den evolutionære betydning af cytochrom c
Cytochrom c er en vigtig komponent i elektrontransportkæden, en del af den cellulære respiration, og det findes normalt i den cellulære organel, mitokondriet. Dette protein har en hæm-protetisk gruppe, og den centrale ion i hæmet bliver skiftevis reduceret og oxideret under elektronoverførslen. Fordi dette vigtige proteins rolle i produktionen af cellenergi er afgørende, har det ændret sig meget lidt gennem millioner af år. Proteinsekventering har vist, at der er en betydelig mængde cytochrom c aminosyresekvenshomologi blandt forskellige arter; med andre ord kan evolutionært slægtskab vurderes ved at måle ligheder eller forskelle mellem forskellige arters DNA- eller proteinsekvenser.
Videnskabsfolk har fastslået, at menneskets cytochrom c indeholder 104 aminosyrer. For hvert cytochrom c-molekyle fra forskellige organismer, der er blevet sekventeret til dato, forekommer 37 af disse aminosyrer i samme position i alle prøver af cytochrom c. Dette tyder på, at der kan have været en fælles forfader. Ved sammenligning af menneskets og chimpansens proteinsekvenser blev der ikke fundet nogen sekvensforskel. Da sekvenserne fra mennesker og rhesusaber blev sammenlignet, var den eneste forskel, der blev fundet, i én aminosyre. Ved en anden sammenligning viser sekvensering fra menneske til gær en forskel i den 44. position.
Proteinstruktur
Som tidligere omtalt er formen af et protein afgørende for dets funktion. Et enzym kan f.eks. binde sig til et specifikt substrat på et sted, der er kendt som det aktive sted. Hvis dette aktive sted er ændret på grund af lokale ændringer eller ændringer i den overordnede proteinstruktur, kan enzymet muligvis ikke binde til substratet. For at forstå, hvordan proteinet får sin endelige form eller konformation, er vi nødt til at forstå de fire niveauer af proteinstruktur: primær, sekundær, tertiær og kvaternær.
Primær struktur
Den unikke sekvens af aminosyrer i en polypeptidkæde er dens primære struktur. For eksempel har bugspytkirtelhormonet insulin to polypeptidkæder, A og B, og de er forbundet med hinanden ved disulfidbindinger. Den N-terminale aminosyre i A-kæden er glycin, mens den C-terminale aminosyre er asparagin (figur 4). Sekvenserne af aminosyrer i A- og B-kæderne er unikke for insulin.
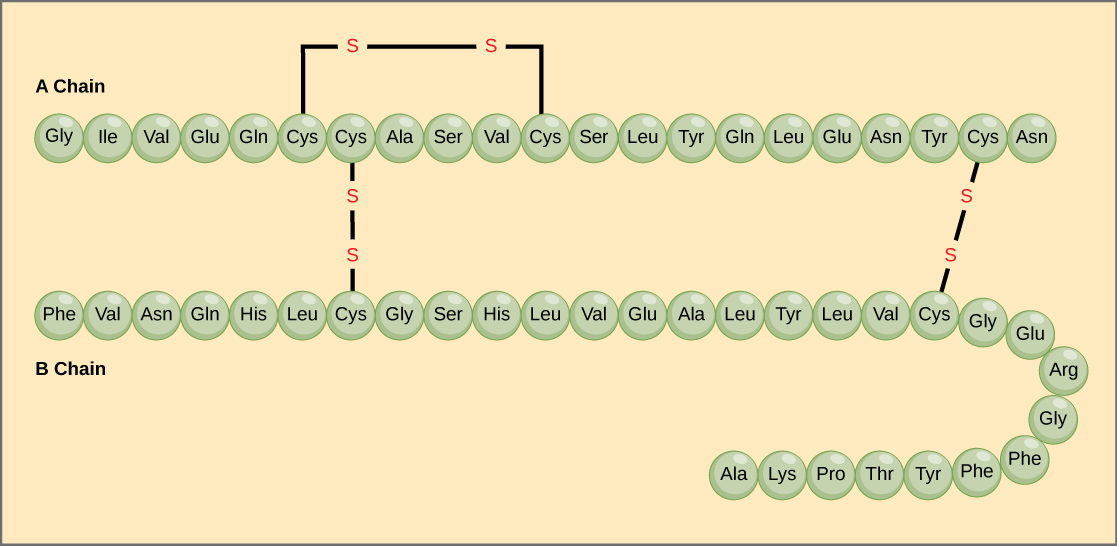
Figur 4. Bovin seruminsulin er et proteinhormon, der består af to peptidkæder, A (21 aminosyrer lange) og B (30 aminosyrer lange). I hver kæde er den primære struktur angivet ved hjælp af forkortelser på tre bogstaver, der repræsenterer navnene på aminosyrerne i den rækkefølge, de er til stede. Aminosyren cystein (cys) har en sulfhydrylgruppe (SH) som sidekæde. To sulfhydrylgrupper kan reagere i tilstedeværelse af ilt for at danne en disulfid (S-S)-binding. To disulfidbindinger forbinder A- og B-kæden med hinanden, og en tredje hjælper A-kæden med at folde sig i den rigtige form. Bemærk, at alle disulfidbindinger har samme længde, men er tegnet i forskellige størrelser af hensyn til overskueligheden.
Den unikke sekvens for hvert protein bestemmes i sidste ende af det gen, der koder for proteinet. En ændring i nukleotidsekvensen i genets kodningsregion kan føre til, at en anden aminosyre tilføjes til den voksende polypeptidkæde, hvilket medfører en ændring i proteinets struktur og funktion. Ved seglcelleanæmi har hæmoglobin β-kæden (hvoraf en lille del er vist i figur 5) en enkelt aminosyresubstitution, hvilket medfører en ændring i proteinets struktur og funktion.
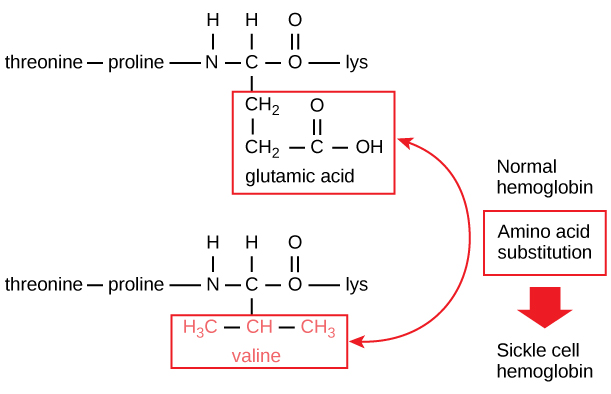
Figur 5. Betakæden i hæmoglobin har en længde på 147 rester, men en enkelt aminosyresubstitution fører til seglcelleanæmi. I normalt hæmoglobin er aminosyren i position syv glutamat. I seglcellehæmoglobin er dette glutamat erstattet af en valin.
Specifikt er aminosyren glutaminsyre erstattet af valin i β-kæden. Det mest bemærkelsesværdige at tænke på er, at et hæmoglobinmolekyle består af to alfakæder og to betakæder, der hver består af ca. 150 aminosyrer. Molekylet har derfor omkring 600 aminosyrer. Den strukturelle forskel mellem et normalt hæmoglobinmolekyle og et seglcellemolekyle – som dramatisk forringer den forventede levetid – er en enkelt aminosyre ud af de 600. Hvad der er endnu mere bemærkelsesværdigt er, at disse 600 aminosyrer er kodet af tre nukleotider hver, og at mutationen er forårsaget af en enkelt baseændring (punktmutation), 1 ud af 1800 baser.
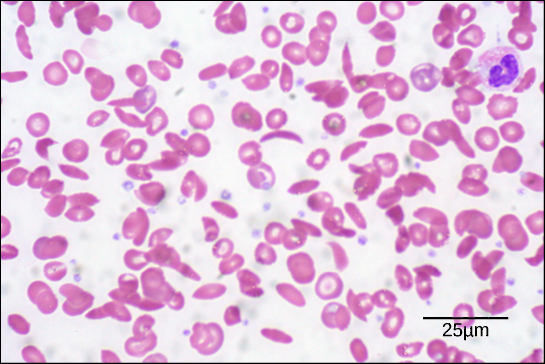
Figur 6. I denne blodudstrygning, visualiseret ved 535x forstørrelse ved hjælp af lysfeltmikroskopi, er seglcellerne halvmåneformede, mens de normale celler er skiveformede. (credit: modifikation af Ed Uthmans arbejde; skala-bar data fra Matt Russell)
På grund af denne ændring af en aminosyre i kæden danner hæmoglobinmolekylerne lange fibre, der forvrænger de bikonkave eller skiveformede røde blodlegemer og antager en halvmåne- eller “seglform”, som tilstopper arterierne (figur 6). Dette kan føre til et utal af alvorlige helbredsproblemer såsom åndenød, svimmelhed, hovedpine og mavesmerter for dem, der er ramt af denne sygdom.
Sekundær struktur
Den lokale foldning af polypeptidet i nogle regioner giver anledning til proteinets sekundære struktur. De mest almindelige er α-helix- og β-foldede arkstrukturer (figur 7). Begge strukturer er α-helix-strukturen – helixen holdes i form af hydrogenbindinger. Brintbindingerne dannes mellem oxygenatomet i carbonylgruppen i en aminosyre og en anden aminosyre, der befinder sig fire aminosyrer længere fremme i kæden.
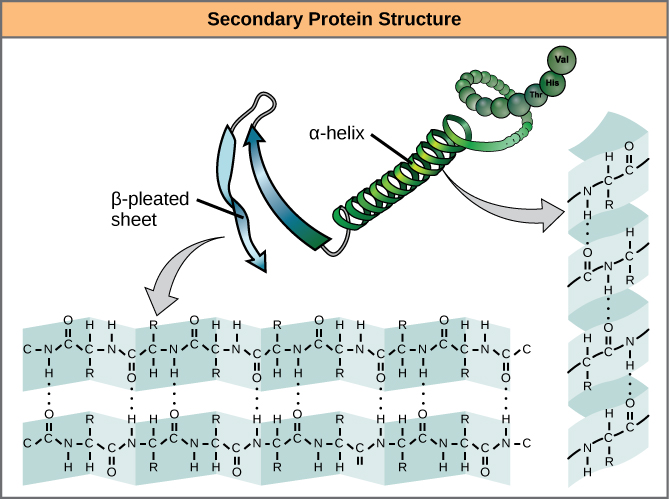
Figur 7. α-helixen og β-pleated sheet er sekundære strukturer i proteiner, der dannes på grund af hydrogenbinding mellem carbonyl- og aminogrupper i peptidryggen. Visse aminosyrer har en tilbøjelighed til at danne en α-helix, mens andre har en tilbøjelighed til at danne et β-plisseret ark.
Hver helix-sving i en alfa-helix har 3,6 aminosyrerester. R-grupperne (variantgrupperne) i polypeptidet stikker ud fra α-helixkæden. I β-helixen dannes “plisserne” ved hydrogenbinding mellem atomerne på polypeptidkædens rygrad. R-grupperne er knyttet til kulstofferne og strækker sig over og under folderne i plisserne. De plisserede segmenter er parallelle eller antiparallelle med hinanden, og der dannes hydrogenbindinger mellem det delvist positive nitrogenatom i aminogruppen og det delvist negative oxygenatom i carbonylgruppen i peptidets rygsøjle. α-helix- og β-plisserede arkstrukturer findes i de fleste kugleformede og fibrøse proteiner, og de spiller en vigtig strukturel rolle.
Tertiær struktur
Den unikke tredimensionelle struktur af et polypeptid er dets tertiære struktur (figur 8). Denne struktur skyldes til dels de kemiske vekselvirkninger, der er i gang på polypeptidkæden. Det er først og fremmest interaktionerne mellem R-grupperne, der skaber den komplekse tredimensionelle tertiærstruktur i et protein. Karakteren af de R-grupper, der findes i de pågældende aminosyrer, kan modvirke dannelsen af de hydrogenbindinger, der er beskrevet for sekundære standardstrukturer. F.eks. bliver R-grupper med ens ladninger frastødt af hinanden, mens grupper med ulige ladninger tiltrækkes af hinanden (ioniske bindinger). Når proteinfoldningen finder sted, ligger de hydrofobiske R-grupper fra upolære aminosyrer inde i proteinet, mens de hydrofile R-grupper ligger på ydersiden. De førstnævnte typer af vekselvirkninger kaldes også hydrofobiske vekselvirkninger. Interaktion mellem cystein-sidekæderne danner disulfidbindinger i tilstedeværelse af ilt, som er den eneste kovalente binding, der dannes under proteinfoldning.
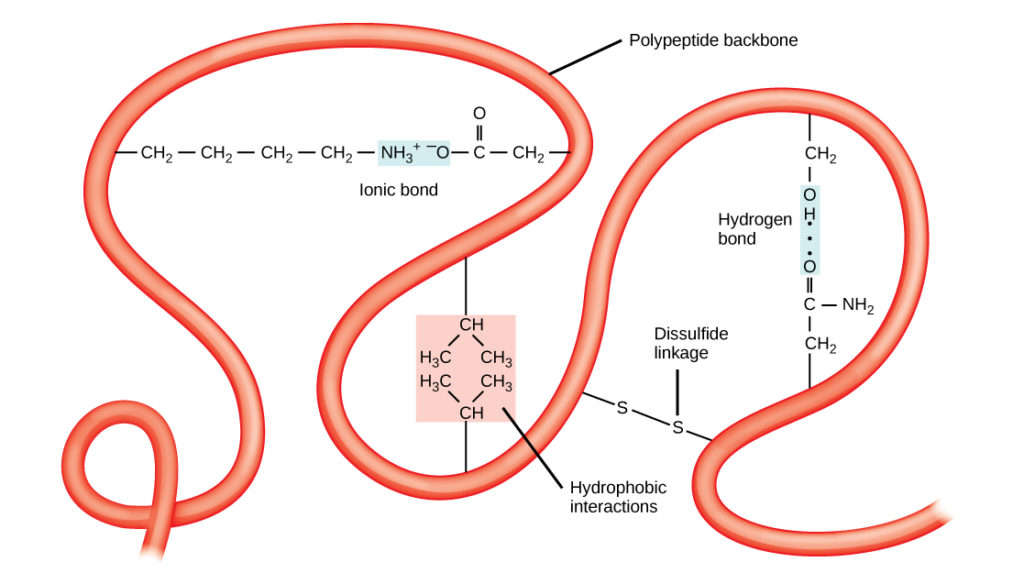
Figur 8. Proteinernes tertiære struktur er bestemt af en række kemiske interaktioner. Disse omfatter hydrofobiske interaktioner, ioniske bindinger, hydrogenbindinger og disulfidbindinger.
Alle disse interaktioner, både svage og stærke, bestemmer proteinets endelige tredimensionelle form. Når et protein mister sin tredimensionelle form, er det muligvis ikke længere funktionelt.
Kvartær struktur
I naturen er nogle proteiner dannet af flere polypeptider, også kendt som underenheder, og samspillet mellem disse underenheder danner den kvartære struktur. Svage interaktioner mellem underenhederne er med til at stabilisere den overordnede struktur. Insulin (et kugleformet protein) har f.eks. en kombination af hydrogenbindinger og disulfidbindinger, der gør, at det for det meste er klumpet sammen til en kugleform. Insulin starter som et enkelt polypeptid og mister nogle interne sekvenser i forbindelse med posttranslationel modifikation efter dannelsen af de disulfidbindinger, der holder de resterende kæder sammen. Silke (et fibrøst protein) har derimod en β-plisseret bladstruktur, som er resultatet af hydrogenbinding mellem forskellige kæder.
De fire niveauer af proteinstruktur (primær, sekundær, tertiær og kvaternær) er illustreret i figur 9.
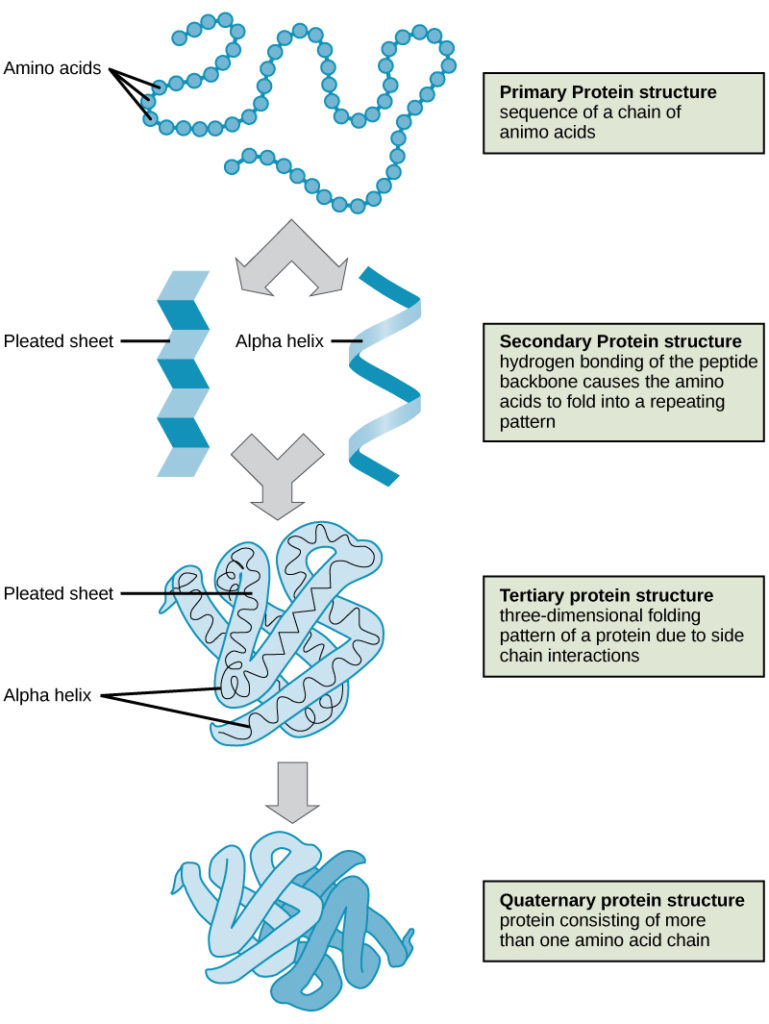
Figur 9. De fire niveauer af proteinstruktur kan iagttages i disse illustrationer. (credit: modifikation af arbejde udført af National Human Genome Research Institute)
Denaturering og proteinfoldning
Hvert protein har sin egen unikke sekvens og form, som holdes sammen af kemiske interaktioner. Hvis proteinet udsættes for ændringer i temperatur, pH-værdi eller udsættelse for kemikalier, kan proteinstrukturen ændre sig og miste sin form uden at miste sin primære sekvens i det, der kaldes denaturering. Denaturering er ofte reversibel, fordi polypeptidets primære struktur bevares i processen, hvis denatureringsmidlet fjernes, hvilket gør det muligt for proteinet at genoptage sin funktion. Nogle gange er denatureringen irreversibel, hvilket fører til tab af funktion. Et eksempel på irreversibel denaturering af proteiner er, når et æg steges. Albuminproteinet i den flydende æggehvide bliver denatureret, når det lægges i en varm pande. Det er ikke alle proteiner, der denatureres ved høje temperaturer; f.eks. har bakterier, der overlever i varme kilder, proteiner, der fungerer ved temperaturer tæt på kogepunktet. Maven er også meget sur, har en lav pH-værdi og denaturerer proteiner som en del af fordøjelsesprocessen; mavens fordøjelsesenzymer bevarer dog deres aktivitet under disse forhold.
Proteinfoldning er afgørende for dets funktion. Oprindeligt troede man, at det var proteinerne selv, der var ansvarlige for foldningsprocessen. Først for nylig fandt man ud af, at de ofte får hjælp i foldningsprocessen fra proteinhjælpere, der er kendt som chaperoner (eller chaperoniner), som associerer sig med målproteinet under foldningsprocessen. De virker ved at forhindre aggregering af de polypeptider, der udgør den komplette proteinstruktur, og de adskiller sig fra proteinet, når målproteinet er foldet.
Proteinernes funktion
De primære typer og funktioner af proteiner er anført i tabel 1.
| Tabel 1. Proteintyper og funktioner | ||
|---|---|---|
| Type | Eksempler | Funktioner |
| Digestivenzymer | Amylase, lipase, pepsin, trypsin | Hjælper til fordøjelsen af føde ved at katabolisere næringsstoffer til monomere enheder |
| Transport | Hæmoglobin, albumin | Transporterer stoffer i blodet eller lymfen gennem hele kroppen |
| Strukturel | Actin, tubulin, keratin | Opbygger forskellige strukturer, som f.eks. cytoskelettet |
| Hormoner | Insulin, thyroxin | Koordinerer aktiviteten af forskellige kropssystemer |
| Forsvar | Immunoglobuliner | Beskytter kroppen mod fremmede patogener |
| Kontraktilt | Actin, myosin | Virker muskelkontraktion |
| Lagring | Lagringsproteiner fra grøntsager, æggehvide (albumin) | Giver næring i den tidlige udvikling af embryonet og kimplanten |
To særlige og almindelige typer af proteiner er enzymer og hormoner. Enzymer, som produceres af levende celler, er katalysatorer i biokemiske reaktioner (som f.eks. fordøjelse) og er normalt komplekse eller konjugerede proteiner. Hvert enzym er specifikt for det substrat (en reaktant, der binder sig til et enzym), som det virker på. Enzymet kan bidrage til nedbrydnings-, omlægnings- eller syntesereaktioner. Enzymer, der nedbryder deres substrater, kaldes kataboliske enzymer, enzymer, der opbygger mere komplekse molekyler ud fra deres substrater, kaldes anabole enzymer, og enzymer, der påvirker reaktionshastigheden, kaldes katalytiske enzymer. Det skal bemærkes, at alle enzymer øger reaktionshastigheden og derfor anses for at være organiske katalysatorer. Et eksempel på et enzym er spyt-amylase, som hydrolyserer sit substrat amylose, en bestanddel af stivelse.
Hormoner er kemiske signalmolekyler, som regel små proteiner eller steroider, der udskilles af endokrine celler, som virker til at kontrollere eller regulere specifikke fysiologiske processer, herunder vækst, udvikling, stofskifte og reproduktion. For eksempel er insulin et proteinhormon, der hjælper med at regulere blodsukkeret.
Proteiner har forskellige former og molekylvægte; nogle proteiner er kugleformede, mens andre er fibrøse af natur. For eksempel er hæmoglobin et kugleformet protein, men kollagen, der findes i vores hud, er et fibrøst protein. Proteinets form er afgørende for dets funktion, og denne form opretholdes af mange forskellige typer kemiske bindinger. Ændringer i temperatur, pH-værdi og udsættelse for kemikalier kan føre til permanente ændringer i proteinets form, hvilket fører til tab af funktion, kendt som denaturering. Alle proteiner består af forskellige arrangementer af de samme 20 typer aminosyrer.
I opsummering: Proteiner
Proteiner er en klasse af makromolekyler, der udfører en række forskellige funktioner for cellen. De hjælper i stofskiftet ved at yde strukturel støtte og ved at fungere som enzymer, transportører eller hormoner. Byggestenene i proteiner (monomerer) er aminosyrer. Hver aminosyre har et centralt kulstof, der er forbundet med en aminogruppe, en carboxylgruppe, et hydrogenatom og en R-gruppe eller sidekæde. Der findes 20 almindeligt forekommende aminosyrer, som hver især adskiller sig fra hinanden med hensyn til R-gruppen. Hver aminosyre er forbundet med sine naboer ved en peptidbinding. En lang kæde af aminosyrer er kendt som et polypeptid.
Proteiner er organiseret på fire niveauer: primær, sekundær, tertiær og (valgfrit) kvaternær. Den primære struktur er den unikke sekvens af aminosyrer. Den lokale foldning af polypeptidet til at danne strukturer såsom α-helixen og β-foldet ark udgør den sekundære struktur. Den overordnede tredimensionelle struktur er den tertiære struktur. Når to eller flere polypeptider kombineres for at danne den komplette proteinstruktur, er konfigurationen kendt som et proteins kvaternære struktur. Proteinets form og funktion er tæt forbundet; enhver formændring forårsaget af ændringer i temperatur eller pH kan føre til denaturering af proteinet og tab af funktion.
Tjek din forståelse
Svar på nedenstående spørgsmål for at se, hvor godt du forstår de emner, der blev behandlet i det foregående afsnit. Denne korte quiz tæller ikke med i din karakter i klassen, og du kan tage den igen et ubegrænset antal gange.
Brug denne quiz til at kontrollere din forståelse og beslutte, om du skal (1) studere det foregående afsnit yderligere eller (2) gå videre til næste afsnit.