Introduzione
La prevalenza di alterazioni della funzione tiroidea nelle donne è molto alta (5/1000 per l’ipotiroidismo e 3/1000 per l’ipertiroidismo1), e poiché molte di queste condizioni si verificano in età fertile, non c’è nulla di strano nell’idea che la gravidanza sia associata a queste malattie. Inoltre, con l’estensione della pratica clinica di misurare i livelli di ormone tiroideo (TH) nelle donne incinte, un numero crescente di anomalie della funzione tiroidea che sarebbero state trascurate in altre circostanze vengono ora rilevate nelle donne incinte.
D’altra parte, la funzione tiroidea materna subisce cambiamenti significativi durante la gravidanza con conseguenti variazioni nei diversi parametri di laboratorio. Per questo motivo, nell’interpretare i diversi parametri della funzione tiroidea si dovrebbe usare un approccio diverso nelle donne incinte rispetto a quelle non incinte, al fine di evitare diagnosi e valutazioni errate con conseguenze potenzialmente gravi.
Come conseguenza di quanto sopra, negli ultimi anni è sorto interesse per la fisiologia e i potenziali cambiamenti della tiroide durante la gravidanza.2 Tra questi, abbiamo esaminato gli aspetti relativi all’ipertiroidismo in gravidanza, le sue sfide e le sue potenziali conseguenze, sia durante la gravidanza (nella madre e/o nel feto) che dopo la nascita (nella madre e/o nel neonato).
Valutazione funzionale della tiroide durante la gravidanza
Significativi cambiamenti fisiologici che hanno un notevole impatto sui diversi parametri della funzione tiroidea materna3,4 si verificano durante la gravidanza, tra cui i seguenti:
- –
TSH. La diminuzione dei livelli di TSH è stata tradizionalmente osservata in ogni periodo della gravidanza rispetto ai livelli riscontrati nelle donne non incinte5 , con livelli minimi nel primo trimestre che successivamente aumentano nel secondo e terzo trimestre. Questi cambiamenti nei livelli di TSH rispecchiano i cambiamenti nei livelli di gonadotropina corionica umana (HCG), che hanno un picco nel primo trimestre e diminuiscono gradualmente in seguito. Questo è il motivo per cui le diverse società scientifiche hanno stabilito valori di riferimento normali6-8 (Tabella 1).
Tabella 1.Valori di riferimento del TSH secondo le diverse società.
Società Livelli di TSH (μU/ml) in gravidanza Primo trimestre Secondo trimestre Terzo trimestre Endo 2007/SEEN 2009 ATA 2011 0.1-2.5 0.2-3 0.3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spanish Society of Endocrinology and Nutrition.
Fonti: Stagnaro-Green et al.,6 Abalovich et al.7 e Galofré et al.8
Si noti che la diminuzione dei livelli di TSH è ancora maggiore nelle gravidanze multiple, e che le donne incinte che fumano hanno livelli di TSH più bassi durante il primo e terzo trimestre.9
- –
TBGT-T4. L’aumento dei livelli di estrogeni associato alla gravidanza aumenta i livelli di TBG e, di conseguenza, i valori di TT4. Tuttavia, i cambiamenti dei livelli di TT4 sono molto consistenti (aumentano del 150%) e lo fanno indipendentemente dal trimestre e dal metodo utilizzato. Quindi, se i livelli di TT4 sono disponibili, la produzione di T4 da parte delle donne incinte può essere stimata moltiplicando per 1,5 i limiti di riferimento nelle donne non incinte.
- –
FT4. Nella pratica clinica, la maggior parte delle misurazioni della T4 libera (FT4) non vengono eseguite utilizzando i metodi gold standard della dialisi di equilibrio o dell’ultrafiltrazione. La procedura utilizzata di routine è un sistema immunologico in cui l’FT4 non è un valore direttamente quantitativo, ma piuttosto stimato attraverso un metodo sensibile alle proteine (influenzato da TBG e albumina), e che quindi è fortemente modificato dalla gravidanza, e varia anche a seconda del trimestre. Inoltre, ogni metodo di prova ha variazioni specifiche. Ciò significa che, per un’adeguata interpretazione dell’FT4 in gravidanza, è necessario disporre di valori di riferimento in funzione dell’età gestazionale e del metodo utilizzato, come indicato dall’American Thyroid Association (ATA).6
Impatto dell’ipertiroidismo sulla madre e sul feto
Come indicato nella tabella 2, l’ipertiroidismo in gravidanza può avere gravi conseguenze sia per la madre che per il feto e, dopo la nascita, per il neonato.10-12 Va inoltre notato che un aumento del rischio di trombosi, apparentemente reversibile con il controllo dell’ipertiroidismo, è stato recentemente riportato nell’ipertiroidismo endogeno.13 A causa dell’aumento del rischio di trombosi venosa profonda e di tromboembolia polmonare durante la gravidanza,14 si deve mantenere un alto livello di sospetto per consentire la diagnosi precoce di questa complicazione, e si devono considerare misure profilattiche.
Impatto materno-fetale dell’ipertiroidismo.
Materno
Aborto spontaneo
Preeclampsia (moltiplica il rischio×5)7
Parto pretermine (moltiplica il rischio×10)12
Abruptio placentae
Insufficienza cardiaca (moltiplica il rischio×20)12
Tempesta tiroidea (moltiplica il rischio×10)12
Trombosi venosa13
Feto
Basso peso alla nascita
Ritardo di crescita intrauterino
Prematurità
Piccolo per l’età gestazionale
Morte fetale
Disfunzione tiroidea (ipertiroidismo o ipotiroidismo)
Gozzo fetale
Neonatale
Ipertiroidismo transitorio
Ipotiroidismo transitorio o permanente
Classificazione dell’ipertiroidismo in gravidanza
La tabella 3 descrive le diverse possibilità diagnostiche quando l’ipertiroidismo si verifica durante la gravidanza. Da un lato, ci sono un certo numero di condizioni che derivano direttamente dalla gravidanza stessa, che possono essere racchiuse sotto la voce di tireotossicosi gestazionale transitoria (TGT). D’altra parte, qualsiasi condizione che porta all’iperfunzione tiroidea al di fuori della gravidanza può verificarsi anche durante la gravidanza. Infine, un aumento dei livelli di TH può verificarsi anche a causa di un apporto esogeno di TH.
Classificazione eziologica dell’ipertiroidismo in gravidanza.
Tireotossicosi gestazionale transitoria
Iperemesi gravidica
Gravidanza multipla
Ipertiroidismo trofoblastico (mole, coriocarcinoma)
Hyperreactio luteinalis
Tireotossicosi gestazionale familiare
Iperplacentosi
Malattia della tiroide
Malattia di Graves
Tiroidite
Gozzo multinodulare
Adenoma tiroideo tossico
Iatrogeno
Trattamento eccessivo
Assunzione involontaria di ormoni tiroidei (contaminazione alimentare, ecc.)
Fittizio
Tirotossicosi gestazionale transitoria
Questa è la causa più comune di ipertiroidismo in gravidanza, e può verificarsi nell’1-3% di tutte le gravidanze.15,16 È stato definito come un ipertiroidismo transitorio limitato alla prima metà della gravidanza e caratterizzato da un aumento dei livelli di FT4 o TT4 (aggiustati) con TSH soppresso o non rilevabile in assenza di autoanticorpi tiroidei16 o di caratteristiche fisiche che suggeriscono la malattia di Graves (GD).17 Questo è solitamente il risultato di un aumento dei livelli di HCG o di una maggiore affinità per i recettori del TSH.
La condizione più caratteristica all’interno di questo gruppo (Tabella 3) è l’iperemesi gravidica (HG), ma ci sono anche altre condizioni associate ad un aumento dei livelli di HCG come la gravidanza multipla o la malattia trofoblastica (mole idatidea o coriocarcinoma) con una prevalenza TGT fino al 50%.17 Esistono anche altre cause meno comuni come l’iperreactio luteinalis,18 caratterizzata dalla formazione di cisti teca-luteina in gravidanza, o l’iperplacentosi,19 dove si osserva un aumento del peso della placenta e della produzione di HCG. Esiste anche una condizione familiare (tireotossicosi gestazionale familiare20) in cui si verifica un’ipersensibilità del recettore del TSH ai livelli fisiologici di HCG a causa di una mutazione autosomica dominante; questa è caratterizzata clinicamente dallo sviluppo della TGT in tutte le gravidanze e in tutte le donne della famiglia con livelli di HCG normali.
Iperemesi gravidica
La causa più comune di TGT è la HG. La HG si verifica in 0,5-10/1000 di tutte le gravidanze,21 ed è associata ad un aumento dei livelli di TH libero e alla soppressione del TSH nel 30-60% dei casi.22 Va notato che il concetto di HG dovrebbe essere limitato alle condizioni associate nel primo trimestre di gravidanza con vomito, disidratazione, perdita di almeno il 5% del peso corporeo e chetonuria.23
In questi casi, l’ipertiroidismo è caratterizzato dalla soppressione dei livelli di TSH e da aumenti minimi di FT4, con livelli di FT3 comunemente normali. L’iperfunzione tiroidea, così come il vomito associato, di solito si risolvono spontaneamente prima della 20a settimana, e il trattamento sintomatico con idratazione endovenosa e complesso vitaminico B è sufficiente a prevenire il rischio eccezionale di encefalopatia di Wernicke.24 Non ci sono prove che il trattamento con farmaci anti-tiroidei (ATD) fornisca alcun beneficio,25 e il loro uso è quindi sconsigliato.6
In via eccezionale, la HG con una componente di iperfunzione tiroidea molto cospicua o la GD con intolleranza gastrointestinale associata (nausea e vomito) possono suggerire la necessità di una diagnosi differenziale tra loro. La tabella 4 mostra le principali differenze. In ogni caso, se l’ipertiroidismo dura oltre il primo trimestre di gravidanza, si deve sospettare una causa diversa dalla TGT.
Differenze tra malattia di Graves e iperemesi.
| Segno | Malattia di Graves | Iperemesi | |
| Sintomi di ipertiroidismo prima della gravidanza | ++ | – | |
| Sintomi di ipertiroidismo durante la gravidanza | +/++ | -/+ | |
| Nausea/vomito | -/+ | +++ | |
| Goiter/ oftalmopatia | + | – | |
| Anticorpi tiroidei | ++ | – | |
| T-US | Ipervascolare | Normale | |
| Anamnesi familiare di HG | – | + | |
| Sintomi simili nella gravidanza precedente | – | + | |
| T4 | |||
| T3 | |||
| T3/TT4 rapporto | >20 |
T-US: ecografia tiroidea; HG: iperemesi gravidica.
Malattia di Graves
Tra le malattie della tiroide, la GD è la causa più comune di ipertiroidismo in gravidanza, verificandosi nello 0,1-1% di tutte le gravidanze (ipertiroidismo clinico e subclinico nello 0,4% e 0,6% rispettivamente).10
La storia naturale della GD in gravidanza è un’esacerbazione dei sintomi durante il primo trimestre a causa dell’effetto additivo della stimolazione da parte dell’HCG del recettore del TSH, seguita da un miglioramento durante la seconda metà della gravidanza a causa dell’effetto immunomodulatore della gravidanza, e la sua ricomparsa dopo la nascita.
Malattia di Graves in gravidanza
I sintomi della GD attiva in gravidanza non differiscono da quelli tipici della condizione. Alcuni sintomi possono talvolta essere confusi con quelli della gravidanza stessa. L’eventuale presenza di segni oculari e gozzo aiuta a chiarire la condizione, e le misurazioni ormonali permettono la diagnosi.
Trattamento della malattia di Graves in gravidanza
Come è noto, ci sono tre potenziali approcci terapeutici alla GD nelle donne non incinte: 131I, chirurgia, o trattamento medico con ATDs. Di queste tre opzioni, la somministrazione di 131I è controindicata in gravidanza a causa del rischio di malformazione,7 e le opzioni sono quindi limitate alla tiroidectomia o all’uso di ATD. Per quanto riguarda la chirurgia, dovrebbe essere eseguita solo in circostanze eccezionali, come discusso di seguito.
Trattamento medico. Farmaci antitiroidei
Per il trattamento medico della GD in gravidanza, il Propiltiouracile (PTU) era tradizionalmente considerato il trattamento di scelta rispetto al Metimazolo/Carbimazolo (MM/CM) fino a pochi anni fa.26 Questo concetto era basato su alcuni studi che suggerivano il minimo trasferimento placentare del PTU rispetto al MM/CM27 e sugli effetti teratogeni del MM/CM. Attualmente è noto che entrambe le ATD attraversano la placenta e hanno quindi la stessa possibilità di colpire il feto e causare ipotiroidismo fetale.26
Inoltre, il ruolo della MM/CM nella comparsa nel feto di aplasia cutis e atresia choanale ed esofagea, insieme ad alcune altre malformazioni globalmente chiamate “embriopatia da metimazolo”,28 è stato molto controverso,29-31 e queste malformazioni sono state attribuite in alcuni casi agli effetti dannosi dell’ipertiroidismo stesso. Studi recenti,32,33 tuttavia, dimostrano che la MM/CM ha effetti teratogeni, a differenza del PTU.
D’altra parte, negli ultimi anni sono apparsi rapporti di casi di epatite tossica fulminante in pazienti trattati con PTU,34,35 con tassi di prevalenza che vanno dallo 0,1% allo 0,5% e un alto tasso di mortalità (25-50%).10,36 Sono stati anche riportati casi di epatite neonatale in neonati nati da madri che erano stati trattati con PTU.37,38
Siamo quindi di fronte a un dilemma: da un lato, sembra essere chiaramente riconosciuto che la MM/CM comporta un rischio di malformazione, e dall’altro, che il PTU può causare complicazioni fatali.
Di fronte a questa alternativa, alcuni autori hanno raccomandato una terapia di ablazione prima della gravidanza nelle donne con GD.39 Tuttavia, questa soluzione risolve appena il problema, perché le donne con GD non pianificano la gravidanza nella maggior parte dei casi. D’altra parte, questa misura non impedisce un eventuale ipertiroidismo fetale (Fhyper) dovuto alla persistenza di alti livelli di anticorpi stimolanti la tiroide (TSI), che richiede un trattamento medico, sollevando così nuovamente il problema.
Per questo motivo, l’ATA ha stabilito i criteri per l’uso di PTU nella popolazione generale e nelle donne in gravidanza.40 Per la gravidanza, l’ATA sconsiglia l’uso di MM/CM nel primo trimestre di gravidanza (il periodo di organogenesi) e raccomanda l’uso di PTU. Dopo la dodicesima settimana di gravidanza, il PTU dovrebbe essere interrotto a causa del rischio di malattia epatica, e il controllo della GD dovrebbe essere continuato con MM/CM. Al di fuori della gravidanza, l’uso di PTU è raccomandato solo in due circostanze: primo, se si verifica una tempesta tiroidea, e secondo, in presenza di effetti avversi indotti da MM/CM.
Per evitare un ritardo nell’inizio del trattamento con PTU, è consigliabile che le donne con GD che possono potenzialmente rimanere incinte e che non usano alcun metodo contraccettivo abbiano a disposizione PTU a casa e che siano istruite a cambiare farmaco (da MM/CM a PTU) non appena si verifica una gravidanza.
Trattamento medico. Gestione clinica
Come discusso sopra, il trattamento della GD durante la gravidanza dovrebbe consistere in PTU nel primo trimestre e MM/CM in seguito. La dose iniziale può variare da 50 a 300mg/die di PTU in tre dosi divise, da 5 a 15mg/die di metimazolo, o da 10 a 15mg/die di carbimazolo come dose singola.6 Si dovrebbe sempre cercare di usare la dose più bassa possibile.
I beta-bloccanti dovrebbero essere usati solo transitoriamente, perché il loro uso a lungo termine è stato associato a ritardo di crescita intrauterina, bradicardia e ipoglicemia neonatale.41 Inoltre, alcuni autori hanno riportato un aumento dell’aborto spontaneo con il trattamento combinato di propranololo e ATD.42
Quando si regola la dose di ATD, si deve cercare di mantenere la funzione tiroidea della madre vicino al limite dell’iperfunzione subclinica, perché la tiroide fetale è molto più sensibile all’effetto bloccante degli ATD. Infatti, la presenza di TSH rilevabile è un’indicazione che la dose di ATD dovrebbe essere diminuita.10,43
La GD in gravidanza mostra un decorso altamente dinamico, per cui fino al 20%-30% delle pazienti raggiunge un grado di controllo che consente la sospensione dell’ATD nell’ultimo trimestre di gravidanza.44 L’uso di uno schema combinato (ATDs e THs) per il trattamento della GD è assolutamente controindicato in gravidanza perché provoca ipotiroidismo fetale (Fhypo).6,43
Chirurgia
Per quanto riguarda l’uso della chirurgia per controllare la GD nelle donne in gravidanza, i diversi consensi e linee guida cliniche6,7,43 concordano nel raccomandarla solo se si verificano i seguenti casi:
- 1
Reazioni avverse agli ATDs che ne impediscono l’uso.
- 2
Necessità di alte dosi di ATD.
- 3
Non conformità del paziente al trattamento medico.
Inoltre, le linee guida italiane43 raccomandano anche la chirurgia nei casi di gozzo materno esteso con compressione delle vie aeree.
Se eseguita, il momento migliore per la chirurgia è a partire dal secondo trimestre. Questo giustifica l’uso di beta-bloccanti e ioduro di sodio (50-100mg/die)45 per un breve periodo di tempo (10-14 giorni) nelle donne incinte con GD come preparazione alla chirurgia. Come discusso sopra, il trattamento a lungo termine con beta-bloccanti dovrebbe essere evitato. La cautela deve essere presa anche quando viene somministrato ioduro di potassio per prevenire lo sviluppo di gozzo e/o Fhypo.
L’intervento chirurgico causa un profondo cambiamento della situazione. Da un lato, l’ipertiroidismo si risolve nelle donne incinte, ma l’ipotiroidismo è indotto nella madre, richiedendo una sostituzione rapida e un monitoraggio regolare del TSH. Anche i livelli di TSI devono essere controllati, e l’ipertiroidismo fetale deve essere monitorato se necessario.
Modifiche nell’autoimmunità tiroidea durante la gravidanza
Alcuni autori hanno dimostrato, almeno in alcuni casi, che l’attività funzionale degli anticorpi contro il recettore del TSH cambia da un’attività stimolante a una inibitoria o bloccante.46,47 Ciò significa che la gravidanza non solo modula i livelli di autoanticorpi, ma anche il loro profilo funzionale. Questo concetto implica che la GD in gravidanza può evolvere non solo verso una funzione normale, ma anche verso l’ipofunzione a causa di questo cambiamento di attività stimolante-bloccante, come è stato riportato in alcuni casi.48 Cioè, la GD in gravidanza è un processo mutevole che richiede un monitoraggio regolare e costante, e che non dovrebbe essere trascurato anche quando è stata raggiunta una situazione di apparente remissione che non richiede ATD.
Misurazione degli anticorpi stimolanti la tiroide in gravidanza
Al fine di prevenire l’impatto di potenziali autoanticorpi TSI sulla tiroide fetale, nel 1998 l’ETA ha pubblicato49 criteri che stabiliscono le indicazioni per la misurazione dei TSI in gravidanza a seconda delle caratteristiche della GD nella madre (Tabella 5).
Indicazioni per la misurazione della TSI secondo la European Thyroid Association.
(I) Donna eutiroidea con GD curata con trattamento medico prima della gravidanza
– Nessuna misurazione
(II) Donna eutiroidea con GD curata dopo131I o chirurgia
– Misurare il TSI precocemente: se positivo, monitorare l’ipertiroidismo fetale
– Misurare il TSI nel terzo trimestre (se positivo nel primo trimestre): se positivo, monitorare l’ipertiroidismo neonatale
(III) Donna trattata per la GD durante la gravidanza
– Misurare la TSI nel terzo trimestre se positiva, monitorare l’ipertiroidismo neonatale
GD: malattia di Graves.
Fonte: Laurberg et al.49
Nei casi in cui la GD è stata curata prima della gravidanza con un trattamento medico, la condizione immunitaria è considerata risolta, e la misurazione del TSI non è necessaria.
Quando la GD è risolta usando la terapia di ablazione (chirurgia o radioterapia), la condizione immunitaria può persistere. I livelli di TSI di solito diventano negativi 12-18 mesi dopo l’intervento chirurgico. Dopo la terapia di ablazione con 131I, i livelli aumentano inizialmente nei primi mesi e successivamente diminuiscono, anche se possono rimanere alti fino a cinque anni.50 Ciò significa che per prevenire un potenziale Fhyper dopo il 131I, deve essere mantenuta una contraccezione a lungo termine. Quindi, nelle donne che vogliono concepire e che hanno alti titoli di TSI, la chirurgia è preferita al 131I. In tutti questi casi, i livelli di TSI devono essere quantificati precocemente per valutare il rischio potenziale di HF, e devono essere misurati di nuovo nel terzo trimestre per vedere se continuano ad essere positivi e se esiste quindi un rischio di ipertiroidismo neonatale.
In caso di GD attiva durante la gravidanza, il rischio potenziale di Fhyper è controllato dal trattamento della madre con ATDs. Si ritiene comunque consigliabile testare la TSI alla fine della gravidanza per valutare il rischio di ipertiroidismo neonatale.
L’ATA6 consiglia il test a circa 20-24 settimane, e stabilisce raccomandazioni molto più generali:
- –
Madre con ipertiroidismo attivo.
- –
Storia del trattamento con 131I.
- –
Tiroidectomia precedente.
- –
Nato precedente con ipertiroidismo.
Malattia di Graves nel feto
Si deve tener presente che la tiroide fetale raggiunge la maturità dalla 20a settimana, ed è quindi capace di rispondere alle stesse influenze (ATD e TSI) della tiroide adulta. Per questo motivo, sia Fhypo che Fhyper possono essere riscontrati nell’ambito della GD in gravidanza.
Ipotiroidismo fetale
Fhypo si verifica di solito a causa di un sovradosaggio relativo di ATD, che può mantenere una funzione normale nella madre, ma causa una chiara ipofunzione nel feto.
Segni clinici suggestivi
La condizione può essere sospettata clinicamente sulla base del gozzo fetale nell’ecografia ostetrica e nello sviluppo di poliidramnios in una donna incinta trattata con ATD.
La presenza di gozzo fetale, indipendentemente dagli aspetti funzionali, è un segnale di allarme a causa del suo effetto massa51 (Fig. 1). Bisogna considerare che l’ingrossamento della tiroide causa un’iperestensione della parte posteriore del collo del feto, che a sua volta compromette la mobilità intrauterina del feto e, di conseguenza, porta ad una presentazione anomala alla nascita (distocia di spalla, presentazione podalica, ecc.). Anche se questa iperestensione non impedisce un’adeguata posizione cefalica del feto, impedisce un’adeguata flessione del collo fetale per il parto, causando una presentazione frontale. Tutte queste situazioni richiedono l’esecuzione di un taglio cesareo. Tuttavia, questa non è la complicazione principale, poiché la compressione esercitata dal gozzo sulle cartilagini tracheali immature del feto può causare una compressione tracheale ed esofagea. Questo si traduce in un’ostruzione delle vie aeree, con il relativo rischio di asfissia. Inoltre, la compressione esofagea compromette la deglutizione del liquido amniotico, portando all’accumulo di liquido e allo sviluppo del poliidramnios. Questo favorisce la nascita prematura, la principale causa di morbilità e mortalità neonatale.
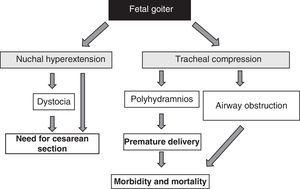
Conseguenze dello sviluppo del gozzo nel feto.
Diagnosi
L’unica procedura completamente affidabile per confermare un sospetto Fhypo è la misurazione dei livelli fetali di TH usando la cordocentesi. Si tratta di una procedura che non è priva di complicazioni (è associata ad un rischio del 2% di morte fetale52) ed è più complessa della semplice amniocentesi. Tuttavia, la misurazione dei livelli di TH fetali nel liquido amniotico non è affidabile e non è correlata alla loro misurazione nel sangue fetale.53 Va tenuto presente che i TH di origine materna possono essere trovati nel liquido amniotico.54 Secondo le diverse linee guida,6,43 la cordocentesi dovrebbe essere eseguita solo quando viene rilevato il gozzo in un feto la cui madre sta assumendo ATD e non può essere fatta una diagnosi certa di Fhyper o Fhypo, e sempre in un centro esperto.
Invece di questo approccio, è stata recentemente suggerita la misurazione del composto W, risultante dal metabolismo dei TH fetali. Nel feto, a differenza degli adulti, il metabolismo dei THs segue la via di sulfo-coniugazione per formare solfato di diiodotironina; questo composto è a sua volta metilato nella placenta e nella parete uterina prima di passare nella circolazione materna e formare il composto W. Questo composto si trova in tutte le donne incinte dallo sviluppo della funzione tiroidea fetale e aumenta gradualmente durante la gravidanza, scomparendo dopo il parto. È stato quindi proposto come marker della funzione tiroidea fetale.55 In questo contesto, una progressione inadeguata dei livelli di composto W in una donna incinta trattata con ATD può suggerire lo sviluppo di Fhypo.56 Tuttavia, per il momento questo non è altro che un metodo quasi sperimentale.
Trattamento
La prima misura da prendere è la sospensione degli ATD. Tuttavia, a causa della latenza degli effetti degli ATD una volta interrotti, la sostituzione del TH è necessaria fino a quando la tiroide fetale non si riprende completamente. Il passaggio placentare dei TH è limitato, e devono quindi essere somministrati per via intra-amniotica. Questa via, anche se invasiva, è molto più sicura della cordocentesi, con un rischio minimo di aborto dopo la prima metà della gravidanza.57
Per quanto riguarda il trattamento intra-amniotico del feto con T4, non esiste uno schema di trattamento stabilito, e i dati della letteratura sono piuttosto contrastanti.53,58,59 Una recente revisione51 dei casi riportati fino ad oggi ha concluso che la dose media è di circa 279μg di levotiroxina una volta alla settimana (per una a sei settimane). Questo sembra invertire il gozzo fetale 0,5-2,5 settimane dopo la prima dose. Le misurazioni ripetute del TH sono state effettuate in alcuni casi, mentre in altri la scomparsa del gozzo è stata monitorata solo con gli ultrasuoni.
Ipertiroidismo fetale
Ipertiroidismo è una complicazione rara e può verificarsi fino all’1-2% dei bambini nati da madri con GD attuale o precedente, sebbene possa essere una condizione sottodiagnosticata.60,61
Lo sviluppo di Fhyper, ad eccezione dei rarissimi casi di mutazioni del recettore del TSH,62 può essere il risultato di una GD mal controllata in una donna incinta o, più comunemente, può insorgere in una donna incinta con GD curata prima della gravidanza con una terapia di ablazione che continua ad avere alti livelli di TSI. Le indicazioni per misurare il TSI per accertare il rischio di Fhyper sono già state discusse. Livelli di TSI 3 o 5 volte superiori al normale6,63 comportano un rischio di Fhyper.
Segni clinici suggestivi
La comparsa del gozzo fetale è una delle prime caratteristiche. Si possono anche osservare bradicardia fetale, età ossea avanzata, ritardo di crescita generale e craniosinostosi.64 Nelle forme più gravi, possono verificarsi insufficienza cardiaca con idrope fetale o alterata maturazione del sistema nervoso centrale con ritardo mentale. Alla fine può verificarsi un parto prematuro.65
Diagnosi
I segni sopra menzionati non sono definitivi; la tachicardia non si verifica sempre, e la presenza di gozzo nell’ecografia è un reperto comune nel Fhypo. Se sorge il dubbio se si tratti di Fhypo dovuto all’effetto degli ATD o di Fhyper dovuto allo scarso controllo materno, alcuni autori hanno proposto un sistema di punteggio basato sui dati ecografici66 (Tabella 6). Se il dubbio persiste, i TH fetali devono essere misurati mediante cordocentesi, come indicato nella sezione Fhypo. Il composto W (precedentemente discusso) potrebbe essere utile a questo scopo in futuro.
Scoring ecografico per differenziare ipertiroidismo da ipotiroidismo nel gozzo fetale.
| Caratteristica ecografica | Punti |
| Frequenza cardiaca fetale | |
| Tachicardia | 1 |
| Normale | 0 |
| Vascolarizzazione del gozzo | |
| Centrale | 1 |
| Periferico o assente | 0 |
| Movimenti fetali | |
| Normale | 1 |
| Aumentati | 0 |
| Maturazione maturazione | |
| Accelerata | -1 |
| Normale | 0 |
| Ritardato | 1 |
| Interpretazione del punteggio | |
| ≥2 suggerisce ipertiroidismo | |
Trattamento
Il trattamento dovrebbe essere basato sulle ATD. In questo caso, a differenza del Fhypo, il trattamento non deve essere somministrato per via intra-amniotica perché le ATD attraversano liberamente la placenta. In caso di Fhyper in una donna incinta con GD scarsamente controllata, è necessario solo un aggiustamento del trattamento nella madre. Al contrario, se la madre ha una funzione normale grazie a una precedente terapia di ablazione, e solo il feto mostra un’iperfunzione, MM/CM deve essere somministrato alla madre iniziando con dosi di 10-20mg/giorno. Il trattamento deve essere monitorato ogni 4-5 giorni in base alla frequenza cardiaca fetale e al decorso del gozzo per non sovradosare il feto e causare la Fhypo.10
Se la madre presenta ipotiroidismo quando vengono somministrati gli ATD, le deve essere somministrata levotiroxina, che attraversa appena la placenta e quindi compensa l’ipotiroidismo senza influire sul feto. Questa è l’unica circostanza in cui lo schema combinato può essere utilizzato.
Malattia di Graves nel neonato
Nei neonati, la GD durante la gravidanza può causare sia ipertiroidismo che ipotiroidismo.
Ipertiroidismo neonatale
Questo può verificarsi nell’1-5% dei bambini nati da donne incinte con GD10 attiva e alti titoli di TSI nell’ultimo trimestre. Il feto mantiene una funzione normale durante la gravidanza grazie all’effetto delle ATD ricevute dalla madre. Gli ATD hanno un’emivita di 24-72 ore e dopo questo periodo cessano di agire sulla tiroide fetale. Questo diventa esposto al TSI materno, che può persistere fino a 12 settimane dopo il parto.
Iperfunzione tiroidea e persino insufficienza cardiaca, che si verificano un paio di giorni dopo il parto in un neonato inizialmente asintomatico, appaiono come risultato.
Questa condizione può anche verificarsi in neonati da madri che hanno ricevuto la terapia di ablazione prima della gravidanza e continuano ad avere elevati livelli di TSI, in cui Fhyper non diagnosticato si è verificato. In questi casi, l’ipertiroidismo neonatale è una continuazione del Fhyper; i neonati mostrano un grave coinvolgimento, basso peso e maturazione ossea accelerata alla nascita.
Il trattamento deve consistere nella somministrazione di MM/CM a dosi di 0,5-1mg/kg di peso corporeo/giorno e propranololo 2mg/kg di peso corporeo/giorno36 a seconda del decorso clinico e tenendo presente che si tratta di una situazione transitoria. Va notato che i TSI possono alla fine cambiare il loro profilo funzionale per diventare bloccanti dei recettori e sviluppare ipotiroidismo.
Ipotiroidismo neonatale secondario
Nei bambini nati da madri con GD mal controllata, si può scoprire che i livelli elevati di THs a cui sono stati esposti durante la gravidanza hanno causato la soppressione della secrezione di TSH portando a ipotiroidismo secondario alla nascita.67 Questa situazione può essere transitoria o definitiva come risultato di una compromissione permanente dell’ipofisi nella secrezione di TSH.
Ai neonati deve essere somministrata levotiroxina, seguita da una valutazione regolare fino all’eventuale recupero della secrezione di TSH.
Può anche verificarsi un ipotiroidismo neonatale transitorio dovuto alla persistenza di autoanticorpi materni che bloccano il recettore RSH.68
Malattia di Graves nelle donne dopo il parto
La GD precedentemente controllata, sia prima che dopo la gravidanza, può ripresentarsi dopo il parto. Il tasso di recidiva dopo il parto può raggiungere l’84%, rispetto al 56% nelle donne senza gravidanza.69 Si raccomanda pertanto di misurare i TH materni sei settimane dopo il parto e fino a un anno.10
Se la GD si ripresenta, sarà necessario un trattamento medico con MM/CM. Sebbene gli ATD siano secreti nel latte materno, la loro somministrazione non comporta alcun rischio durante l’allattamento, e fino a 20-30 mg di MM/CM possono essere assunti senza alcun impatto sulla tiroide dei neonati.70 Gli ATD devono essere assunti in dosi divise e sempre dopo la fine dell’assunzione di latte.
E’ stato suggerito che i TSI nel latte materno potrebbero raggiungere la circolazione generale dei neonati attraverso l’epitelio gastrointestinale immaturo del bambino e causare o prolungare l’ipertiroidismo neonatale. Tuttavia, non ci sono ancora prove conclusive che ciò si verifichi.71
Addendum
Dopo la presentazione di questo manoscritto, la North American Society of Endocrinology ha pubblicato nuove linee guida di pratica clinica sulla gestione della disfunzione tiroidea durante la gravidanza e il post-partum (J Clin Endocrinol Metab 2012; 97: 2543-2565). Le raccomandazioni fornite nella sezione sull’ipertiroidismo in gravidanza non differiscono sostanzialmente da quelle discusse in questa revisione.
Conflitti di interesse
L’autore dichiara di non avere conflitti di interesse.