Introduktion
Prevalensen av förändringar i sköldkörtelfunktionen hos kvinnor är mycket hög (5/1000 för hypotyreoidism och 3/1000 för hypertyreoidism1), och eftersom många av dessa tillstånd uppträder i barnafödande ålder finns det inget konstigt i att graviditet är förknippat med dessa sjukdomar. I takt med att den kliniska praktiken att mäta nivåerna av sköldkörtelhormon (TH) hos gravida kvinnor utökas upptäcks dessutom allt fler avvikelser i sköldkörtelfunktionen som skulle ha förbisetts under andra omständigheter hos gravida kvinnor.
Å andra sidan genomgår mödrarnas sköldkörtelfunktion betydande förändringar under graviditeten, vilket resulterar i förändringar i de olika laboratorieparametrarna. På grund av detta bör man använda ett annat tillvägagångssätt hos gravida än hos icke gravida kvinnor när man tolkar de olika sköldkörtelfunktionsparametrarna för att undvika felaktiga diagnoser och bedömningar med potentiellt allvarliga konsekvenser.
Som en följd av ovanstående har det under de senaste åren uppstått ett intresse för sköldkörtelns fysiologi och de potentiella förändringarna av sköldkörteln under graviditet.2 Bland dessa har vi gått igenom aspekter relaterade till hypertyreos under graviditet, dess utmaningar och dess potentiella konsekvenser, både under graviditeten (hos modern och/eller fostret) och efter födseln (hos modern och/eller det nyfödda barnet).
Funktionell bedömning av sköldkörteln under graviditeten
Signifikanta fysiologiska förändringar som har en avsevärd inverkan på olika parametrar för mammans sköldkörtelfunktion3,4 inträffar under graviditeten, bland annat följande:
- –
TSH. Sänkta TSH-nivåer har traditionellt setts under alla graviditetsperioder jämfört med de nivåer som finns hos icke-gravida kvinnor,5 med miniminivåer under den första trimestern som sedan ökar under den andra och tredje trimestern. Dessa förändringar i TSH-nivåerna återspeglar förändringarna i nivåerna av humant choriongonadotropin (HCG), som når sin topp under den första trimestern och därefter gradvis minskar. Därför har de olika vetenskapliga sällskapen fastställt normala referensvärden6-8 (tabell 1).
Tabell 1.Referens TSH-värden enligt olika sällskap.
Samhälle TSH-nivåer (μU/ml) vid graviditet Första trimestern Sekund. trimester Tredje trimester Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spanish Society of Endocrinology and Nutrition.
Källor: Stagnaro-Green et al.6,6 Abalovich et al.7 och Galofré et al.8
Det bör noteras att minskningen av TSH-nivåerna är ännu större vid flerfaldiga graviditeter och att gravida kvinnor som röker har lägre TSH-nivåer under den första och tredje trimestern.9
- –
TBGT-T4. Ökade östrogennivåer i samband med graviditet ökar TBG-nivåerna och följaktligen TT4-värdena. Förändringarna i TT4-nivåerna är dock mycket konsekventa (de ökar med 150 %) och gör det oberoende av både trimester och den metod som används. Om TT4-nivåer finns tillgängliga kan man därför uppskatta den gravida kvinnans T4-produktion genom att multiplicera referensgränserna för icke gravida kvinnor med 1,5.
- –
FT4. I klinisk praxis utförs de flesta mätningar av fritt T4 (FT4) inte med guldstandardmetoderna jämviktsdialys eller ultrafiltrering. Det förfarande som rutinmässigt används är ett immunoassay-system där FT4 inte är ett direkt kvantifierat värde, utan snarare uppskattas genom en proteinkänslig metod (som påverkas av TBG och albumin), och som därför modifieras starkt av graviditet, och som också varierar beroende på trimester. Dessutom har varje testmetod specifika variationer. Detta innebär att för en adekvat tolkning av FT4 under graviditet måste referensvärden beroende på gestationsålder och använd metod finnas tillgängliga, vilket anges av American Thyroid Association (ATA).6
Hypertyreoidismens påverkan på mamman och fostret
Som framgår av tabell 2 kan hypertyreoidism under graviditet få allvarliga konsekvenser för både mamman och fostret och, efter födseln, för det nyfödda barnet10 .-12 Det bör också noteras att en ökad risk för trombos, som uppenbarligen är reversibel med kontroll av hypertyreos, nyligen har rapporterats vid endogen hypertyreos13 . På grund av den ökade risken för djup venös trombos och pulmonell tromboembolism under graviditet14 bör en hög misstänksamhetsnivå upprätthållas för att möjliggöra tidig upptäckt av denna komplikation, och profylaktiska åtgärder kan behöva övervägas.
Tabell 2.Materiell-fetal påverkan av hypertyreoidism.
Maternell
Missfall
Preeklampsi (multiplicerar risken×5)7
För tidig förlossning (multiplicerar risken×10)12
. Abruptio placentae
Hjärtsvikt (multiplicerar risken×20)12
Sköldkörtelstorm (multiplicerar risken×10)12
Venös trombos13
Fetalt
Låg Födelsevikt
Intrauterin tillväxthämning
För tidigt född
Liten i förhållande till gestationsåldern
Fosterdöd
Sköldkörtelns dysfunktion (hypertyreoidism eller hypotyreos)
Fetal struma
Neonatal
Övergående hypertyreos
Övergående eller permanent hypotyreos
Källor: Patil-Sisodia och Mestman10 och Laurberg et al.11.Klassificering av hypertyreoidism under graviditet
Tabell 3 beskriver de olika diagnostiska möjligheterna när hypertyreoidism uppstår under graviditet. Å ena sidan finns det ett antal tillstånd som är en direkt följd av själva graviditeten och som kan samlas under rubriken transient gestationell thyreotoxikos (TGT). Å andra sidan kan alla tillstånd som leder till överfunktion av sköldkörteln utanför graviditeten också uppstå under graviditeten. Slutligen kan ökade TH-nivåer också uppstå på grund av exogen TH-tillförsel.
Tabell 3.Etiologisk klassificering av hypertyreoidism under graviditet.
Transient gestationell thyreotoxikos
Hyperemesis gravidarum
Multipel graviditet
Trophoblastisk hypertyreoidism (mole, choriokarcinom)
Hyperreactio luteinalis
Familjär gestationell thyreotoxikos
Hyperplacentos
Sköldkörtelsjukdom
Graves sjukdom
Thyroidit
Multinodulär struma
Toxiskt sköldkörteladenom
Iatrogen
Överbehandling
Oavsiktligt intag av sköldkörtelhormoner (kontaminering av livsmedel, etc.)
Fiktiv
Transient gestationell thyreotoxikos
Detta är den vanligaste orsaken till hypertyreoidism under graviditet och kan förekomma i 1-3 % av alla graviditeter15,16 . Den har definierats som en övergående hypertyreos som är begränsad till den första halvan av graviditeten och som kännetecknas av förhöjda FT4- eller TT4-nivåer (justerade) med undertryckta eller odetekterbara TSH-nivåer i avsaknad av autoantikroppar mot sköldkörteln16 eller fysiska egenskaper som tyder på Graves sjukdom (GD).17 Detta är vanligen ett resultat av förhöjda HCG-nivåer eller av en större affinitet för TSH-receptorer.
Det mest karakteristiska tillståndet inom denna grupp (tabell 3) är hyperemesis gravidarum (HG), men det finns andra tillstånd som också är förknippade med ökade HCG-nivåer, t.ex. multipel graviditet eller trophoblastisk sjukdom (hydatidmoleum eller choriokarcinom) med en TGT-prevalens på upp till 50 %.17 Det finns också andra mindre vanliga orsaker som hyperreactio luteinalis,18 som kännetecknas av bildandet av theca-luteincystor i samband med graviditet, eller hyperplacentos,19 där ökad placentavikt och HCG-produktion ses. Det finns också ett familjärt tillstånd (familjär gestationell thyreotoxikos20) där TSH-receptorns överkänslighet mot fysiologiska HCG-nivåer uppstår på grund av en dominant autosomal mutation; detta kännetecknas kliniskt av TGT-utveckling i alla graviditeter och hos alla kvinnor i familjen med normala HCG-nivåer.
Hyperemesis gravidarum
Den vanligaste orsaken till TGT är HG. HG förekommer i 0,5-10/1000 av alla graviditeter,21 och är förknippad med ökade fria TH-nivåer och TSH-suppression i 30-60 % av fallen.22 Det bör noteras att begreppet HG bör begränsas till tillstånd som under graviditetens första trimester är förknippade med kräkningar, uttorkning, förlust av minst 5 % av kroppsvikten och ketonuri.23
I dessa fall kännetecknas hypertyreoidism av att TSH-nivåerna är undertryckta och att FT4-nivåerna ökar minimalt, med vanligtvis normala FT3-nivåer. Sköldkörtelhyperfunktion, liksom associerade kräkningar, försvinner vanligen spontant före vecka 20, och symtomatisk behandling med intravenös hydrering och B-vitaminkomplex är tillräcklig för att förhindra den exceptionella risken för Wernickes encefalopati24 . Det finns inga bevis för att behandling med antisköldkörtelmedicin (ATD) ger någon fördel,25 och deras användning är därför olämplig.6
Utomatiskt kan HG med en mycket iögonfallande sköldkörtelhyperfunktionskomponent eller GD med associerad gastrointestinal intolerans (illamående och kräkningar) antyda att det finns ett behov av differentialdiagnos mellan dem. Tabell 4 visar de viktigaste skillnaderna. Om hypertyreos varar längre än graviditetens första trimester bör man i alla fall misstänka en annan orsak än TGT.
Tabell 4.Skillnader mellan Graves sjukdom och hyperemesis.
Sign Graves sjukdom Hyperemesis . Symtom på hypertyreoidism före graviditet ++ – Symtom på hypertyreoidism under graviditeten +/++ -/+ Kräkningar -/+ +++ Klitoris/oftalmopati + – Tyreoideantikroppar ++ – T-US Hypervaskulär Normal Familjehistoria av HG – + Samma symtom vid tidigare graviditet – + T4 T3 TT3/TT4-förhållande >20 T-USA: HG: hyperemesis gravidarum.
Graves sjukdom
Av sköldkörtelsjukdomar är GD den vanligaste orsaken till hypertyreoidism under graviditet och förekommer i 0,1-1 % av alla graviditeter (klinisk och subklinisk hypertyreoidism i 0,4 % respektive 0,6 %).10
Den naturliga historiken för GD under graviditet är en förvärring av symtomen under den första trimestern på grund av den additiva effekten av stimulering av TSH-receptorn med HCG, följt av en förbättring under den andra halvan av graviditeten på grund av graviditetens immunmodulerande effekt, och dess återkomst efter födseln.
Graves sjukdom under graviditet
Symtomen på aktiv GD under graviditet skiljer sig inte från de symtom som är typiska för tillståndet. Vissa symtom kan ibland förväxlas med symtom på själva graviditeten. Den eventuella förekomsten av okulära tecken och struma hjälper till att klargöra tillståndet, och hormonmätningar gör det möjligt att ställa diagnos.
Behandling av Graves sjukdom under graviditet
Som bekant finns det tre potentiella terapeutiska tillvägagångssätt för GD hos icke-gravida kvinnor: 131I, kirurgi eller medicinsk behandling med ATD:er. Av dessa tre alternativ är administrering av 131I kontraindicerat under graviditet på grund av risken för missbildning,7 och alternativen är därför begränsade till tyreoidektomi eller användning av ATD. När det gäller kirurgi bör den endast utföras i undantagsfall, vilket diskuteras nedan.
Medicinsk behandling. Antithyreoidala läkemedel
För medicinsk behandling av GD under graviditet har propyltiouracil (PTU) traditionellt ansetts vara den bästa behandlingen jämfört med methimazol/karbimazol (MM/CM) fram till för några år sedan.26 Detta koncept baserades på vissa studier som tyder på att PTU överförs minimalt till placenta jämfört med MM/CM27 och på de teratogena effekterna av MM/CM. Det är för närvarande känt att båda ATD:erna passerar placenta och därför har samma chans att påverka fostret och orsaka fetal hypotyreos26 .
Den roll som MM/CM spelar för förekomsten hos fostret av aplasia cutis och choanal- och esofagusatresi, tillsammans med vissa andra missbildningar som globalt kallas ”methimazolembryopati ”28 , har dessutom varit mycket kontroversiell29-31 , och dessa missbildningar har i vissa fall tillskrivits de skadliga effekterna av själva hypertyreosen. Nya studier32,33 visar dock att MM/CM har teratogena effekter, till skillnad från PTU.
Å andra sidan har rapporter om fall av fulminant toxisk hepatit hos patienter som behandlats med PTU dykt upp under de senaste åren34,35 med prevalenssiffror som varierar mellan 0,1 % och 0,5 % och med en hög dödlighet (25-50 %).10,36 Det har till och med rapporterats om fall av neonatal hepatit hos nyfödda barn födda av mödrar som behandlats med PTU37,38 .
Vi står därför inför ett dilemma: å ena sidan verkar det vara klart erkänt att MM/CM innebär en risk för missbildningar och å andra sidan att PTU kan orsaka dödliga komplikationer.
När de ställs inför detta alternativ har vissa författare rekommenderat ablationsbehandling före graviditet hos kvinnor med GD.39 Denna lösning löser dock knappast problemet, eftersom kvinnor med GD i de flesta fall inte planerar graviditet. Å andra sidan förhindrar denna åtgärd inte eventuell fetal hypertyreoidism (Fhyper) på grund av att höga nivåer av sköldkörtelstimulerande antikroppar (TSI) kvarstår, vilket kräver medicinsk behandling, vilket alltså väcker problemet igen.
ATA har därför fastställt kriterier för användning av PTU i den allmänna befolkningen och hos gravida kvinnor.40 När det gäller graviditet avråder ATA från användning av MM/CM under graviditetens första trimester (organogenesiperioden) och rekommenderar användning av PTU. Efter graviditetsvecka 12 bör PTU avbrytas på grund av risken för leversjukdom, och GD-kontrollen bör fortsätta med MM/CM. Utanför graviditeten rekommenderas användning av PTU endast under två omständigheter: för det första om sköldkörtelstorm uppstår och för det andra vid förekomst av biverkningar inducerade av MM/CM.
För att undvika en fördröjning av behandlingsstarten med PTU är det tillrådligt att kvinnor med GD som potentiellt kan bli gravida och som inte använder någon preventivmetod har PTU tillgängligt i hemmet och att de instrueras att byta medicinering (från MM/CM till PTU) så snart graviditet verifieras.
Medicinsk behandling. Klinisk behandling
Som diskuterats ovan bör behandlingen av GD under graviditet bestå av PTU under den första trimestern och MM/CM därefter. Startdosen kan variera från 50 till 300 mg/dag PTU i tre delade doser, 5 till 15 mg/dag methimazol eller 10 till 15 mg/dag karbimazol som en engångsdos.6 Man bör alltid försöka använda lägsta möjliga dos.
Beta-blockerare bör endast användas övergående, eftersom långtidsanvändning av dem har förknippats med intrauterin tillväxthämning, bradykardi och neonatal hypoglykemi41 . Dessutom har vissa författare rapporterat ökat antal missfall vid kombinerad behandling med propranolol och ATD.42
När man justerar ATD-dosen bör man försöka upprätthålla moderns sköldkörtelfunktion nära gränsen för subklinisk hyperfunktion, eftersom fostrets sköldkörtel är mycket känsligare för den blockerande effekten av ATD:er. I själva verket är förekomsten av detekterbart TSH en indikation på att ATD-dosen bör minskas.10,43
GD under graviditet uppvisar ett mycket dynamiskt förlopp, så att upp till 20-30 % av patienterna uppnår en grad av kontroll som gör det möjligt att avbryta ATD-dosen under graviditetens sista trimester.44 Användning av ett kombinerat schema (ATD och TH) för behandling av GD är absolut kontraindicerat under graviditet eftersom det orsakar fetal hypotyreoidism (Fhypo).6,43
Kirurgi
När det gäller användning av kirurgi för att kontrollera GD hos gravida kvinnor är de olika konsenserna och kliniska riktlinjerna6,7,43 eniga om att rekommendera det endast om följande inträffar:
- 1
Biverkningar av ATD som förhindrar användningen av dem.
- 2
Behovet av höga ATD-doser.
- 3
Patienten följer inte den medicinska behandlingen.
Därutöver rekommenderar de italienska riktlinjerna43 även kirurgi vid fall av omfattande maternell struma med komprimering av luftvägarna.
Om kirurgi utförs är den bästa tiden för operation från och med andra trimestern. Detta motiverar användning av betablockerare och natriumjodid (50-100 mg/dag)45 under en kort tidsperiod (10-14 dagar) hos gravida kvinnor med GD som en förberedelse för operation. Som diskuterats ovan bör långtidsbehandling med betablockerare undvikas. Försiktighet bör också iakttas när kaliumjodid administreras för att förhindra utveckling av struma och/eller Fhypo.
Kirurgi orsakar en djupgående förändring av situationen. Å ena sidan löses hypertyreos hos gravida kvinnor, men hypotyreos induceras hos modern, vilket kräver snabb ersättning och regelbunden TSH-övervakning. TSH-nivåerna bör också kontrolleras, och fetal hypertyreoidism bör övervakas vid behov.
Förändringar i autoimmunitet i sköldkörteln under graviditeten
Vissa författare har visat, åtminstone i vissa fall, att den funktionella aktiviteten hos antikroppar mot TSH-receptorn förändras från en stimulerande till en hämmande eller blockerande aktivitet.46,47 Detta innebär att graviditeten inte bara modulerar nivåerna av autoantikroppar, utan också deras funktionella profil. Detta koncept innebär att GD under graviditet kan utvecklas inte bara till normal funktion utan även till hypofunktion på grund av denna förändring i stimulerande-blockerande aktivitet, vilket har rapporterats i vissa fall48 . Med andra ord är GD under graviditet en föränderlig process som kräver konstant regelbunden övervakning och som inte bör försummas även när en situation med uppenbar remission som inte kräver ATD:er har uppnåtts.
Mätning av sköldkörtelstimulerande antikroppar under graviditet
För att förhindra att eventuella TSI-autoantikroppar påverkar sköldkörteln hos fostret publicerade ETA 199849 kriterier som fastställer indikationerna för TSI-mätning under graviditet beroende på egenskaperna hos GD hos modern (tabell 5).
Tabell 5.Indikationer för mätning av TSI enligt European Thyroid Association.
(I) Euthyroid kvinna med GD botad med medicinsk behandling före graviditet
– Ingen mätning
(II) Euthyroid kvinna med GD botad efter131I eller kirurgi
– Mät TSI tidigt: Om positiv, övervaka fetal hypertyreoidism
– Mät TSI i tredje trimestern (om positiv i första trimestern): Om positiv, övervaka neonatal hypertyreoidism
(III) Kvinna som behandlas för GD under graviditeten
– Mät TSI i tredje trimestern om positiv, övervaka neonatal hypertyreoidism
GD: Graves’ sjukdom.
Källa: Laurberg et al.49
I de fall där GD har botats före graviditeten med medicinsk behandling anses immuntillståndet vara löst och TSI-mätning krävs inte.
När GD har lösts med hjälp av ablationsbehandling (kirurgi eller strålbehandling) kan immuntillståndet kvarstå. TSI-nivåerna blir vanligtvis negativa 12-18 månader efter operationen. Efter 131I-ablationsbehandling ökar nivåerna initialt under de första månaderna för att sedan minska, även om de kan förbli höga i upp till fem år.50 Detta innebär att för att förhindra potentiell Fhyper efter 131I måste långsiktig preventivmetod upprätthållas. Hos kvinnor som vill bli gravida och har höga TSI-titrar är därför kirurgi att föredra framför 131I. I alla dessa fall bör TSI-nivåerna kvantifieras tidigt för att bedöma den potentiella risken för Fhyper, och bör mätas igen under tredje trimestern för att se om de fortsätter att vara positiva och om det därför finns en risk för neonatal hypertyreoidism.
I händelse av aktiv GD under graviditeten kontrolleras den potentiella risken för Fhyper genom behandling av modern med ATD:er. Det anses dock lämpligt att testa TSI i slutet av graviditeten för att bedöma risken för neonatal hypertyreoidism.
I ATA6 rekommenderas testning vid cirka 20-24 veckor, och där anges mycket mer allmänna rekommendationer:
- –
Moder med aktiv hypertyreoidism.
- –
Historia av behandling med 131I.
- –
Förutet tyreoidektomi.
- –
Förutet nyfött barn med hypertyreoidism.
Graves sjukdom hos foster
Det bör beaktas att den fosterlika sköldkörteln uppnår sin mognad från vecka 20, och att den därför kan reagera på samma påverkan (ATD:er och TSD:er) som den vuxna sköldkörteln. På grund av detta kan både Fhypo och Fhyper förekomma vid GD under graviditet.
Fetal hypotyreoidism
Fhypo uppstår vanligen på grund av relativ ATD-överdosering, vilket kan upprätthålla normal funktion hos modern, men orsakar en tydlig hypofunktion hos fostret.
Suggestiva kliniska tecken
Tillståndet kan kliniskt misstänkas baserat på fetal struma i obstetriskt ultraljud och vid utveckling av polyhydramnios hos en gravid kvinna som behandlats med ATD:er.
Närvaron av fetal struma, oavsett funktionella aspekter, är en larmsignal på grund av dess masseffekt51 (fig. 1). Man bör ta hänsyn till att en förstoring av sköldkörteln orsakar hyperextension av fostrets bakre nacke, vilket i sin tur försämrar den intrauterina fosterrörligheten och följaktligen leder till en onormal presentation vid födseln (axeldystoci, breech-presentation osv.). ). Även om denna hyperextension inte förhindrar en adekvat cefalisk position för fostret, förhindrar den en adekvat flexion av fosterhalsen vid förlossningen, vilket leder till att fostret presenteras i ansiktet. Alla dessa situationer kräver kejsarsnitt. Detta är dock inte den viktigaste komplikationen, eftersom den kompression som struman utövar på fostrets omogna luftrörsbrosk kan orsaka kompression av luftrör och esofagus. Detta leder till luftvägsobstruktion med åtföljande risk för asfyxi. Dessutom försvårar esofaguskompressionen sväljningen av fostervatten, vilket leder till vätskeansamling och utveckling av polyhydramnios. Detta gynnar för tidig födsel, som är den främsta orsaken till neonatal sjuklighet och dödlighet.
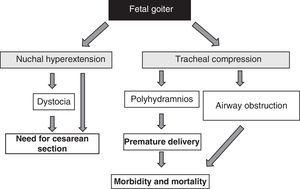 Figur 1.
Figur 1.Konsekvenser av strumautveckling hos fostret.
(0,1MB).Diagnostik
Den enda helt tillförlitliga proceduren för att bekräfta en misstänkt Fhypo är mätning av fetala TH-nivåer med hjälp av chordocentes. Detta är ett förfarande som inte är fritt från komplikationer (det är förknippat med en 2-procentig risk för fosterdöd52) och är mer komplicerat än enkel fosterdiagnostik. Mätningen av fetala TH-nivåer i fostervatten är dock inte tillförlitlig och korrelerar inte med mätningen i fosterblod.53 Man bör komma ihåg att TH av moderligt ursprung kan finnas i fostervatten.54 Enligt de olika riktlinjerna6,43 ska chordocentes endast utföras när struma upptäcks hos ett foster vars mamma tar ATD:er och en säker diagnos av Fhyper eller Fhypo inte kan ställas, och alltid på ett erfaret center.
Istället för detta tillvägagångssätt har det nyligen föreslagits att man ska mäta förening W, som är ett resultat av metaboliseringen av fetala TH:er. Hos fostret följer metabolismen av THs, till skillnad från hos vuxna, sulfokonjugationsvägen för att bilda diiodtyroninsulfat; denna förening metyleras i sin tur i placenta och livmodervägg innan den övergår i moderns cirkulation och bildar förening W. Denna förening återfinns hos alla gravida kvinnor från och med utvecklingen av den fetala sköldkörtelfunktionen, och den ökar gradvis under graviditeten för att sedan försvinna efter förlossningen. Den har därför föreslagits som en markör för fetal sköldkörtelfunktion.55 I denna miljö kan en otillräcklig utveckling av nivåerna av förening W hos en gravid kvinna som behandlas med ATD:er tyda på utveckling av Fhypo.56 För närvarande är detta dock inte mer än en kvasiexperimentell metod.
Behandling
Den första åtgärden som ska vidtas är att avbryta behandlingen med ATD:er. På grund av ATD-effekternas latenstid när de väl har avbrutits krävs emellertid också TH-substitution tills den fetala sköldkörteln har återhämtat sig fullständigt. Placentapassagen av THs är begränsad, och de bör därför administreras intra-amniotiskt. Denna väg är, även om den är invasiv, mycket säkrare än chordocentes, med en minimal risk för missfall efter den första halvan av graviditeten.57
När det gäller intra-amniotisk behandling av fostret med T4 finns det inget etablerat behandlingsschema, och litteraturuppgifterna är tämligen motsägelsefulla.53,58,59 I en nyligen genomförd genomgång51 av de fall som hittills rapporterats drogs slutsatsen att den genomsnittliga dosen är cirka 279μg levotyroxin en gång i veckan (i en till sex veckor). Detta verkar reversera fetal struma 0,5-2,5 veckor efter den första dosen. Upprepade TH-mätningar gjordes i vissa fall, medan strumans försvinnande i andra fall endast övervakades med ultraljud.
Fetal hypertyreoidism
Fhyper är en sällsynt komplikation och kan förekomma hos upp till 1-2 % av de barn som föds av mödrar med aktuell eller tidigare GD, även om det möjligen kan vara ett underdiagnostiserat tillstånd.60,61
Utvecklingen av Fhyper, med undantag för de mycket sällsynta fallen av TSH-receptormutationer,62 kan vara resultatet av dåligt kontrollerad GD hos en gravid kvinna eller, vilket är vanligare, kan uppstå hos en gravid kvinna med GD som botats före graviditeten med ablationsbehandling och som fortsätter att ha höga TSI-nivåer. Indikationerna för att mäta TSI för att fastställa risken för Fhyper har redan diskuterats. TSI-nivåer som är 3 eller 5 gånger högre än normalt6,63 innebär en risk för Fhyper.
Suggestiva kliniska tecken
Förekomsten av fetal struma är ett av de tidigaste kännetecknen. Fosterbradykardi, avancerad benålder, allmän tillväxthämning och kraniosynostos kan också ses.64 I allvarligare former kan hjärtsvikt med fetal hydrops eller nedsatt mognad av det centrala nervsystemet med mental retardation förekomma. En för tidig förlossning kan så småningom inträffa.65
Diagnos
De ovan nämnda tecknen är inte definitiva; takykardi förekommer inte alltid, och förekomst av struma i ultraljud är ett vanligt fynd vid Fhypo. Om det uppstår tvivel om huruvida tillståndet är Fhypo på grund av effekten av ATD:er eller Fhyper på grund av dålig moderlig kontroll har vissa författare föreslagit ett poängsystem baserat på ultraljudsdata66 (tabell 6). Om tvivel kvarstår bör fetala THs mätas med hjälp av chordocentesis, enligt vad som anges i avsnittet om Fhypo. Föreningen W (tidigare diskuterad) kan möjligen vara till hjälp för detta ändamål i framtiden.
Tabell 6.Ultraljudsscoring för att skilja hypertyreoidism från hypotyreoidism vid fetal struma.
Ultrasound feature Points Fetal hjärtfrekvens Tachykardi 1 Normal 0 Goiter vaskularisering Central 1 Perifer eller saknas 0 Fetalrörelser Normal 1 Ökat 0 Benskörhet mognad Snabbare -1 Normal 0 Fördröjd 1 Tolkning av poäng ≥2 tyder på hypertyreoidism Anpassat från Huel et al.66Behandling
Behandlingen bör baseras på ATD. I detta fall bör behandlingen, till skillnad från för Fhypo, inte administreras via intra-amniotisk väg eftersom ATD:er fritt passerar placenta. I händelse av Fhyper hos en gravid kvinna med dåligt kontrollerad GD krävs endast en justering av behandlingen hos modern. Om modern däremot har en normal funktion tack vare tidigare ablationsbehandling och endast fostret uppvisar hyperfunktion bör MM/CM administreras till modern med början med doser på 10-20 mg/dag. Behandlingen bör övervakas var 4-5:e dag utifrån fostrets HR och strumans förlopp för att inte överdosera fostret och orsaka Fhypo.10
Om mamman upplever hypotyreoidism när ATD administreras bör hon ges levotyroxin, som knappt passerar placenta och därför kompenserar hypotyreoidism utan att påverka fostret. Detta är den enda omständighet där det kombinerade schemat kan användas.
Graves sjukdom hos nyfödda
Hos nyfödda kan GD under graviditeten orsaka både hypertyreoidism och hypotyreoidism.
Neonatal hypertyreoidism
Detta kan förekomma hos 1-5 % av de spädbarn som föds till gravida kvinnor med aktiv GD10 och höga TSI-titrar i sista trimestern. Fostret bibehåller normal funktion under graviditeten på grund av effekten av de ATD:er som modern får. ATD:erna har en halveringstid på 24-72 timmar och efter denna period upphör de att verka på fostrets sköldkörtel. Denna blir utsatt för maternell TSI, som kan kvarstå i upp till 12 veckor efter förlossningen.
Som en följd av detta uppträder sköldkörtelhyperfunktion och till och med hjärtsvikt, som uppträder ett par dagar efter förlossningen hos ett ursprungligen symtomfritt nyfött barn.
Detta tillstånd kan också uppträda hos nyfödda barn till mödrar som har fått ablationsbehandling före graviditeten och som fortsätter att ha förhöjda TSI-nivåer, hos vilka odiagnostiserad Fhyper förekommit. I dessa fall är neonatal hypertyreoidism en fortsättning på Fhyper; de nyfödda visar allvarlig involvering, låg vikt och accelererad benmognad vid födseln.
Behandlingen bör bestå av administrering av MM/CM i doser på 0,5-1 mg/kg kroppsvikt/dygn och propranolol 2 mg/kg kroppsvikt/dygn36 beroende på det kliniska förloppet och med tanke på att detta är en övergående situation. Det bör noteras att TSD:er så småningom kan ändra sin funktionsprofil till att bli receptorblockerare och utveckla hypotyreos.
Sekundär neonatal hypotyreos
I barn som föds av mödrar med dåligt kontrollerad GD kan det visa sig att förhöjda nivåer av TH:er som de exponerats för under graviditeten har orsakat en undertryckning av TSH-sekretionen vilket leder till sekundär hypotyreos vid födseln.67 Denna situation kan vara övergående eller definitiv som ett resultat av en permanent hypofysär försämring av TSH-sekretionen.
Nyfödda bör ges levotyroxin, följt av regelbunden bedömning tills TSH-sekretionen slutligen återhämtar sig.
Transient neonatal hypotyreos på grund av persistens av maternella autoantikroppar som blockerar RSH-receptorn kan också förekomma.68
Graves sjukdom hos kvinnor efter förlossningen
Prex kontrollerad GD, antingen före eller efter graviditeten, kan återkomma efter förlossningen. Återfallsfrekvensen efter förlossning kan vara upp till 84 %, jämfört med 56 % hos kvinnor utan graviditet.69 Det rekommenderas därför att mödrarnas THs mäts sex veckor efter förlossningen och i upp till ett år.10
Om GD återkommer krävs medicinsk behandling med MM/CM. Även om ATD utsöndras i bröstmjölk innebär administreringen av dem ingen risk under amning, och upp till 20-30 mg MM/CM kan tas utan påverkan på sköldkörteln hos nyfödda.70 ATD bör tas i delade doser och alltid efter det att mjölkintaget har upphört.
Det har föreslagits att TSD i bröstmjölk skulle kunna nå den allmänna cirkulationen hos nyfödda genom spädbarnets omogna gastrointestinala epitel och orsaka eller förlänga neonatal hypertyreoidism. Det finns dock ännu inga avgörande bevis för att detta sker.71
Addendum
När detta manuskript lämnades in utfärdade North American Society of Endocrinology nya riktlinjer för klinisk praxis om hantering av sköldkörteldysfunktion under graviditet och postpartum (J Clin Endocrinol Metab 2012; 97: 2543-2565). De rekommendationer som ges i avsnittet om hypertyreoidism under graviditet skiljer sig inte väsentligt från dem som diskuteras i denna översikt.
Intressekonflikter
Författaren uppger att han inte har några intressekonflikter.
- –