Indledning
Forekomsten af ændringer i skjoldbruskkirtelfunktionen hos kvinder er meget høj (5/1000 for hypothyroidisme og 3/1000 for hyperthyroidisme1), og da mange af disse tilstande opstår i den fødedygtige alder, er der intet mærkeligt i tanken om, at graviditet er forbundet med disse sygdomme. I takt med at den kliniske praksis med måling af skjoldbruskkirtelhormonniveauet (TH) hos gravide udvides, påvises der desuden nu et stigende antal skjoldbruskkirtelfunktionsanomalier, som ville være blevet overset under andre omstændigheder, hos gravide kvinder.
På den anden side undergår moderens skjoldbruskkirtelfunktion betydelige ændringer under graviditeten, hvilket resulterer i ændringer i de forskellige laboratorieparametre. På grund af dette bør der anvendes en anden tilgang hos gravide end hos ikke-gravide kvinder ved fortolkning af de forskellige skjoldbruskkirtelfunktionsparametre for at undgå forkerte diagnoser og vurderinger med potentielt alvorlige konsekvenser.
Som følge af ovenstående er der i de senere år opstået interesse for fysiologien og de potentielle ændringer i skjoldbruskkirtlen under graviditet.2 Blandt disse har vi gennemgået aspekter vedrørende hyperthyreose under graviditet, dens udfordringer og dens potentielle konsekvenser, både under graviditeten (hos moderen og/eller fosteret) og efter fødslen (hos moderen og/eller den nyfødte).
Funktionel vurdering af skjoldbruskkirtlen under graviditeten
Signifikante fysiologiske ændringer, som har en betydelig indvirkning på de forskellige parametre for moderens skjoldbruskkirtelfunktion3,4 , forekommer under graviditeten, herunder følgende:
- –
TSH. Der er traditionelt set nedsatte TSH-niveauer i enhver graviditetsperiode sammenlignet med de niveauer, der findes hos ikke-gravide kvinder,5 med minimumsniveauer i første trimester, som efterfølgende stiger i andet og tredje trimester. Disse ændringer i TSH-niveauerne afspejler ændringerne i niveauerne af humant choriongonadotropin (HCG), som topper i første trimester og falder gradvist derefter. Derfor har de forskellige videnskabelige selskaber fastsat normale referenceværdier6-8 (tabel 1).
Tabel 1.Reference TSH-værdier i henhold til forskellige selskaber.
Samfund TSH-niveauer (μU/ml) i graviditeten Første trimester Sekund trimester Tredje trimester Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spanish Society of Endocrinology and Nutrition.
Kilder: Stagnaro-Green et al.6,6 Abalovich et al.7 og Galofré et al.8
Det skal bemærkes, at faldet i TSH-niveauet er endnu større ved flerfoldsgraviditeter, og at gravide kvinder, der ryger, har lavere TSH-niveauer i første og tredje trimester.9
- –
TBGT-T4. Øgede østrogenniveauer i forbindelse med graviditet øger TBG-niveauerne og følgelig TT4-værdierne. Ændringerne i TT4-niveauerne er imidlertid meget konsekvente (de stiger med 150 %) og gør det uafhængigt af både trimester og den anvendte metode. Hvis TT4-niveauerne er til rådighed, kan gravides T4-produktion således anslås ved at multiplicere referencegrænserne hos ikke-gravide kvinder med 1,5.
- –
FT4. I klinisk praksis foretages de fleste målinger af frit T4 (FT4) ikke ved hjælp af guldstandardmetoderne ligevægtsdialyse eller ultrafiltrering. Den procedure, der rutinemæssigt anvendes, er et immunoassay-system, hvor FT4 ikke er en direkte kvantificeret værdi, men snarere estimeres ved hjælp af en proteinfølsom metode (påvirket af TBG og albumin), og som derfor er stærkt modificeret af graviditet, og som også varierer afhængigt af trimester. Desuden har hver enkelt forsøgsmetode specifikke variationer. Det betyder, at der for at kunne foretage en passende fortolkning af FT4 under graviditet skal foreligge referenceværdier afhængig af gestationsalder og anvendt metode, som anført af American Thyroid Association (ATA).6
Indflydelse af hyperthyreose på moderen og fosteret
Som det fremgår af tabel 2, kan hyperthyreose under graviditet have alvorlige konsekvenser for både moderen og fosteret og efter fødslen for den nyfødte.10-12 Det skal også bemærkes, at der for nylig er blevet rapporteret om en øget risiko for trombose, som tilsyneladende er reversibel ved kontrol af hyperthyreose, ved endogen hyperthyreose13 . På grund af den øgede risiko for dyb venetrombose og pulmonal tromboemboli under graviditet14 bør der opretholdes en høj grad af mistanke for at muliggøre tidlig påvisning af denne komplikation, og profylaktiske foranstaltninger skal muligvis overvejes.
Tabel 2.Maternal-fetale konsekvenser af hyperthyreose.
Maternel
Abort
Præeklampsi (multiplicerer risikoen×5)7
Præterm fødsel (multiplicerer risikoen×10)12
Abruptio placentae
Hjertesvigt (multiplicerer risikoen×20)12
Skjoldbrus (multiplicerer risikoen×10)12
Venøs trombose13
Føtal
Lav fødselsvægt
Intrauterin væksthæmning
For tidligt født
Lille i forhold til gestationsalder
Føtal død
Dysfunktion af skjoldbruskkirtlen (hyperthyroidisme eller hypothyroidisme)
Føtal struma
Neonatal
Forbigående hyperthyroidisme
Forbigående eller permanent hypothyroidisme
Kilder: Patil-Sisodia og Mestman10 og Laurberg et al.11.Klassifikation af hyperthyreoidisme under graviditet
Tabel 3 beskriver de forskellige diagnostiske muligheder, når hyperthyreoidisme opstår under graviditet. På den ene side er der en række tilstande, der direkte skyldes selve graviditeten, og som kan samles under betegnelsen transient gestationel thyrotoksicose (TGT). På den anden side kan enhver tilstand, der fører til hyperfunktion af skjoldbruskkirtlen uden for graviditeten, også opstå under graviditeten. Endelig kan forhøjede TH-niveauer også forekomme på grund af eksogen TH-tilførsel.
Tabel 3.Etiologisk klassifikation af hyperthyreoidisme i graviditeten.
Transient gestationel thyreotoksicose
Hyperemesis gravidarum
Multipel graviditet
Trophoblastisk hyperthyreoidisme (mol, choriocarcinom)
Hyperreactio luteinalis
Familiær gestationel thyreotoksicose
Hyperplacentose
Thyroidea sygdom
Graves sygdom
Thyroiditis
Multinodulær struma
Giftigt skjoldbruskkirteladenom
Iatrogen
Overbehandling
Utilsigtet indtagelse af skjoldbruskkirtelhormoner (fødevareforurening, osv.)
Fiktiv
Transient gestationel thyrotoksicose
Dette er den mest almindelige årsag til hyperthyreose under graviditet og kan forekomme i 1-3% af alle graviditeter15,16. Den er blevet defineret som en forbigående hyperthyreose, der er begrænset til første halvdel af graviditeten og er karakteriseret ved forhøjede FT4- eller TT4-niveauer (justeret) med undertrykt eller ikke påviseligt TSH i fravær af thyroidea autoantistoffer16 eller fysiske træk, der tyder på Graves’ sygdom (GD).17 Dette er normalt et resultat af forhøjede HCG-niveauer eller af en større affinitet for TSH-receptorer.
Den mest karakteristiske tilstand inden for denne gruppe (tabel 3) er hyperemesis gravidarum (HG), men der er andre tilstande, der også er forbundet med forhøjede HCG-niveauer, såsom multipel graviditet eller trophoblastisk sygdom (hydatid mol eller choriocarcinom) med en TGT-prævalens på op til 50 %.17 Der findes også andre mindre almindelige årsager såsom hyperreactio luteinalis18 , der er karakteriseret ved dannelse af theca-lutein-cyster i forbindelse med graviditet, eller hyperplacentose19 , hvor der ses øget placentavægt og HCG-produktion. Der findes også en familiær tilstand (familiær gestationel thyrotoksicose20 ), hvor TSH-receptorens overfølsomhed over for fysiologiske HCG-niveauer opstår på grund af en dominant autosomal mutation; dette er klinisk karakteriseret ved TGT-udvikling i alle graviditeter og hos alle kvinder i familien med normale HCG-niveauer.
Hyperemesis gravidarum
Den mest almindelige årsag til TGT er HG. HG forekommer i 0,5-10/1000 af alle graviditeter,21 og er forbundet med forhøjede frie TH-niveauer og TSH-suppression i 30-60 % af tilfældene.22 Det skal bemærkes, at begrebet HG bør begrænses til tilstande, der i første trimester af graviditeten er forbundet med opkastning, dehydrering, tab af mindst 5 % af kropsvægten og ketonuri.23
I disse tilfælde er hyperthyreoidisme karakteriseret ved suppression af TSH-niveauerne og minimale FT4-stigninger, med almindeligvis normale FT3-niveauer. Skjoldbruskkirtelhyperfunktion samt tilknyttede opkastninger forsvinder normalt spontant inden uge 20, og symptomatisk behandling med intravenøs hydrering og B-vitaminkompleks er tilstrækkelig til at forebygge den ekstraordinære risiko for Wernickes encefalopati24 . Der er ingen dokumentation for, at behandling med anti-thyreoidea-midler (ATD) giver nogen fordel,25 og brugen heraf er derfor frarådes.6
Udtagelsesvis kan HG med en meget iøjnefaldende thyroideahyperfunktionskomponent eller GD med associeret gastrointestinal intolerance (kvalme og opkastninger) antyde behovet for differentialdiagnose mellem dem. Tabel 4 viser de vigtigste forskelle. Under alle omstændigheder bør man under alle omstændigheder, hvis hyperthyroidisme varer ud over graviditetens første trimester, mistænke en anden årsag end TGT.
Tabel 4.Differencer mellem Graves’ sygdom og hyperemesis.
Tegn Graves’ sygdom Hyperemesis Symptomer på hyperthyreose før graviditet ++ – Symptomer på hyperthyreose under graviditet Symptomer på hyperthyreose under graviditet +/++ -/+ Nausea/vomiting -/+ +++ Kiter/ophthalmopati + – Thyreoidea-antistoffer ++ – T-US Hypervaskulær Normal Familiehistorie med HG – + Sammenlignende symptomer i tidligere graviditet – + T4 T3 TT3/TT4-forhold >20 T-US: thyroid ultralyd; HG: hyperemesis gravidarum.
Graves’ sygdom
Af skjoldbruskkirtelsygdomme er GD den mest almindelige årsag til hyperthyroidisme i graviditeten og forekommer i 0,1-1 % af alle graviditeter (klinisk og subklinisk hyperthyroidisme i henholdsvis 0,4 % og 0,6 %).10
Den naturlige historie for GD under graviditet er en forværring af symptomerne i første trimester på grund af den additive virkning af stimulering af TSH-receptoren med HCG, efterfulgt af en forbedring i anden halvdel af graviditeten på grund af graviditetens immunmodulerende virkning, og dens tilbagevenden efter fødslen.
Graves’ sygdom under graviditet
Symptomerne på aktiv GD under graviditet adskiller sig ikke fra dem, der er typiske for sygdommen. Nogle symptomer kan undertiden forveksles med dem, der skyldes selve graviditeten. Den mulige tilstedeværelse af okulære tegn og struma hjælper med at klarlægge tilstanden, og hormonmålinger gør det muligt at stille diagnosen.
Behandling af Graves’ sygdom under graviditet
Som bekendt er der tre potentielle terapeutiske tilgange til GD hos ikke-gravide kvinder: 131I, kirurgi eller medicinsk behandling med ATD’er. Af disse tre muligheder er administration af 131I kontraindiceret i graviditet på grund af risikoen for misdannelser7 , og mulighederne er derfor begrænset til thyreoidektomi eller brug af ATD’er. Hvad angår kirurgi, bør den kun udføres under ekstraordinære omstændigheder, som diskuteret nedenfor.
Medicinsk behandling. Antithyroide lægemidler
Med hensyn til medicinsk behandling af GD under graviditet blev propylthiouracil (PTU) traditionelt betragtet som den foretrukne behandling sammenlignet med methimazol/Carbimazol (MM/CM) indtil for nogle få år siden.26 Dette koncept var baseret på nogle undersøgelser, der tyder på minimal placentatoverførsel af PTU sammenlignet med MM/CM27 og på de teratogene virkninger af MM/CM. Det er i dag kendt, at begge ATD’er krydser placenta og derfor har samme chance for at påvirke fosteret og forårsage føtal hypothyreose26 .
Dertil kommer, at MM/CM’s rolle i forbindelse med forekomsten hos fosteret af aplasia cutis og choanal- og esophagealatresi sammen med nogle andre misdannelser, der globalt kaldes “methimazolembryopati “28 , har været meget kontroversiel29-31 , og disse misdannelser er i nogle tilfælde blevet tilskrevet de skadelige virkninger af selve hyperthyroidismen. Nyere undersøgelser32,33 viser imidlertid, at MM/CM har teratogene virkninger i modsætning til PTU.
På den anden side er der i de senere år dukket rapporter om tilfælde af fulminant toksisk hepatitis hos patienter, der er behandlet med PTU,34,35 med prævalensrater på mellem 0,1 % og 0,5 % og en høj dødelighed (25-50 %).10,36 Der er endda rapporteret om tilfælde af neonatal hepatitis hos nyfødte født af mødre, der var blevet behandlet med PTU.37,38 Der er endda blevet rapporteret om tilfælde af neonatal hepatitis hos nyfødte født af mødre, der var blevet behandlet med PTU.37,38
Vi står derfor over for et dilemma: på den ene side synes det klart anerkendt, at MM/CM indebærer en risiko for misdannelser, og på den anden side, at PTU kan forårsage fatale komplikationer.
Ved dette alternativ har nogle forfattere anbefalet ablationsbehandling før graviditet hos kvinder med GD.39 Denne løsning løser dog næppe problemet, da kvinder med GD i de fleste tilfælde ikke planlægger graviditet. På den anden side forhindrer denne foranstaltning ikke eventuel føtal hyperthyroidisme (Fhyper) på grund af vedvarende høje niveauer af skjoldbruskkirtelstimulerende antistoffer (TSI), som kræver medicinsk behandling, hvilket således rejser problemet igen.
ATA har derfor opstillet kriterier for brugen af PTU i den almindelige befolkning og hos gravide kvinder.40 For graviditet fraråder ATA brugen af MM/CM i første trimester af graviditeten (organogeneseperioden) og anbefaler brugen af PTU. Efter 12. graviditetsuge bør PTU ophøre på grund af risikoen for leversygdom, og GD-kontrol bør fortsættes med MM/CM. Uden for graviditeten anbefales brugen af PTU kun under to omstændigheder: for det første, hvis der opstår skjoldbruskkirtelsestorm, og for det andet ved tilstedeværelse af bivirkninger induceret af MM/CM.
For at undgå en forsinkelse i starten af behandlingen med PTU anbefales det, at kvinder med GD, der potentielt kan blive gravide, og som ikke bruger nogen præventionsmetode, har PTU til rådighed i hjemmet og instrueres i at skifte medicin (fra MM/CM til PTU), så snart graviditet er verificeret.
Medicinsk behandling. Klinisk behandling
Som nævnt ovenfor bør behandlingen af GD under graviditet bestå af PTU i første trimester og derefter MM/CM. Startdosis kan variere fra 50 til 300 mg/dag PTU i tre delte doser, 5 til 15 mg/dag methimazol eller 10 til 15 mg/dag carbimazol som en enkelt dosis.6 Man bør altid forsøge at anvende den lavest mulige dosis.
Betablokkere bør kun anvendes midlertidigt, da deres langtidsanvendelse har været forbundet med intrauterin væksthæmning, bradykardi og neonatal hypoglykæmi.41 Desuden har nogle forfattere rapporteret om øget abort ved kombineret behandling med propranolol og ATD.42
Ved justering af ATD-dosis bør man forsøge at opretholde moderens skjoldbruskkirtelfunktion nær grænsen for subklinisk hyperfunktion, fordi den føtale skjoldbruskkirtel er meget mere følsom over for den blokerende virkning af ATD’er. Faktisk er tilstedeværelsen af påviseligt TSH en indikation på, at ATD-dosis bør nedsættes.10,43
GD under graviditet viser et meget dynamisk forløb, således at op til 20-30% af patienterne opnår en grad af kontrol, der gør det muligt at ophøre med ATD i graviditetens sidste trimester.44 Anvendelse af et kombineret skema (ATD’er og TH’er) til behandling af GD er absolut kontraindiceret under graviditet, da det medfører fosterhypotyreose (Fhypo).6,43
Kirurgi
Med hensyn til anvendelse af kirurgi til kontrol af GD hos gravide er de forskellige konsenser og kliniske retningslinjer6,7,43 enige om kun at anbefale det, hvis følgende forekommer:
- 1
Bivirkninger på ATD’er, som forhindrer deres anvendelse.
- 2
Behov for høje ATD-doser.
- 3
Patientens manglende overholdelse af medicinsk behandling.
Dertil kommer, at de italienske retningslinjer43 også anbefaler operation i tilfælde af omfattende maternel struma med kompression af luftvejene.
Hvis operation udføres, er det bedste tidspunkt for operation fra andet trimester og fremefter. Dette berettiger til brug af betablokkere og natriumjodid (50-100 mg/dag)45 i en kort periode (10-14 dage) hos gravide kvinder med GD som forberedelse til operation. Som diskuteret ovenfor bør langtidsbehandling med betablokkere undgås. Forsigtighed bør også udvises, når der gives kaliumjodid for at forhindre udvikling af struma og/eller Fhypo.
Kirurgi medfører en dybtgående ændring af situationen. På den ene side løses hyperthyroidisme hos gravide kvinder, men hypotyreose induceres hos moderen, hvilket kræver hurtig udskiftning og regelmæssig TSH-overvågning. TSI-niveauerne bør også kontrolleres, og føtal hyperthyreose bør om nødvendigt overvåges.
Ændringer i autoimmunitet i skjoldbruskkirtlen under graviditet
Nogle forfattere har vist, i hvert fald i nogle tilfælde, at den funktionelle aktivitet af antistoffer mod TSH-receptoren ændres fra en stimulerende til en hæmmende eller blokerende aktivitet.46,47 Det betyder, at graviditet ikke kun modulerer autoantistofniveauerne, men også deres funktionelle profil. Dette koncept indebærer, at GD under graviditet kan udvikle sig ikke kun til normal funktion, men endda til hypofunktion på grund af denne ændring i stimulerende-blokerende aktivitet, som det er blevet rapporteret i nogle tilfælde48 . Det vil sige, at GD under graviditet er en foranderlig proces, der kræver konstant regelmæssig overvågning, og som ikke bør negligeres, selv når der er opnået en situation med tilsyneladende remission, der ikke kræver ATD’er.
Måling af skjoldbruskkirtelstimulerende antistoffer i graviditeten
For at forebygge virkningen af potentielle TSI-autoantistoffer på den føtale skjoldbruskkirtel offentliggjorde ETA i 199849 kriterier, der fastsætter indikationerne for TSI-måling i graviditeten afhængigt af karakteristika for GD hos moderen (tabel 5).
Tabel 5.Indikationer for måling af TSI i henhold til European Thyroid Association.
(I) Euthyroid kvinde med GD helbredt med medicinsk behandling før graviditet
– Ingen måling
(II) Euthyroid kvinde med GD helbredt efter131I eller operation
– Måling af TSI tidligt: hvis positiv, overvåg føtal hyperthyroidisme
– Mål TSI i tredje trimester (hvis positiv i første trimester): hvis positiv, overvåge neonatal hyperthyreoidisme
(III) Kvinde behandlet for GD under graviditeten
– Mål TSI i tredje trimester hvis positiv, overvåge neonatal hyperthyreoidisme
GD: Graves’ sygdom.
Kilde:
Kilde: Laurberg et al.49
I tilfælde, hvor GD er blevet helbredt før graviditeten med medicinsk behandling, anses immuntilstanden for at være løst, og TSI-måling er ikke nødvendig.
Når GD er løst ved hjælp af ablationsbehandling (kirurgi eller strålebehandling), kan immuntilstanden bestå. TSI-niveauerne bliver normalt negative 12-18 måneder efter operationen. Efter 131I-ablationsbehandling stiger niveauerne i første omgang i de første par måneder og falder derefter, selv om de kan forblive høje i op til fem år.50 Det betyder, at for at forebygge potentielle Fhyper efter 131I skal langvarig prævention opretholdes. Hos kvinder, der ønsker at blive gravide og har høje TSI-titre, er kirurgi således at foretrække frem for 131I. I alle disse tilfælde bør TSI-niveauerne kvantificeres tidligt for at vurdere den potentielle risiko for Fhyper og bør måles igen i tredje trimester for at se, om de fortsat er positive, og om der derfor er risiko for neonatal hyperthyroidisme.
I tilfælde af aktiv GD under graviditeten kontrolleres den potentielle risiko for Fhyper ved behandling af moderen med ATD’er. Det anses dog for tilrådeligt at teste TSI i slutningen af graviditeten for at vurdere risikoen for neonatal hyperthyroidisme.
ATA6 anbefaler testning ved ca. 20-24 uger og opstiller meget mere generelle anbefalinger:
- –
Moder med aktiv hyperthyroidisme.
- –
Historie af behandling med 131I.
- –
Prior thyroidektomi.
- –
Prior nyfødt med hyperthyreoidisme.
Graves sygdom hos foster
Det skal tages i betragtning, at den føtale skjoldbruskkirtel når modenhed fra uge 20 og derfor er i stand til at reagere på de samme påvirkninger (ATD’er og TSI’er) som den voksne skjoldbruskkirtel. På grund af dette kan både Fhypo og Fhyper findes i forbindelse med GD i graviditeten.
Fetal hypothyroidisme
Fhypo opstår normalt på grund af relativ ATD-overdosering, som kan opretholde normal funktion hos moderen, men forårsager en klar hypofunktion hos fosteret.
Suggestive kliniske tegn
tilstanden kan klinisk mistænkes på baggrund af føtal struma i obstetrisk ultralyd og ved udvikling af polyhydramnios hos en gravid kvinde, der behandles med ATD’er.
Anstedeværelsen af føtal struma, uanset de funktionelle aspekter, er et alarmsignal på grund af dens masseeffekt51 (Fig. 1). Det bør tages i betragtning, at forstørrelse af skjoldbruskkirtlen forårsager hyperextension af fosterets nakke, hvilket igen forringer den intrauterine fostermobilitet og som følge heraf fører til en unormal præsentation ved fødslen (skulderdystoci, sædepræsentation osv.). ). Selv om denne hyperextension ikke forhindrer en passende cephalisk position af fosteret, forhindrer den en passende fleksion af fosterets hals ved fødslen, hvilket medfører ansigtspræsentation. Alle disse situationer kræver kejsersnit. Dette er imidlertid ikke den vigtigste komplikation, da den kompression, som strumaen udøver på fosterets umodne trachealbrusk, kan forårsage tracheal- og esophagealkompression. Dette resulterer i luftvejsobstruktion med deraf følgende risiko for asfyksi. Desuden hæmmer esophageal kompression synkningen af fostervand, hvilket fører til væskeophobning og udvikling af polyhydramnios. Dette begunstiger for tidlig fødsel, som er hovedårsagen til neonatal morbiditet og mortalitet.
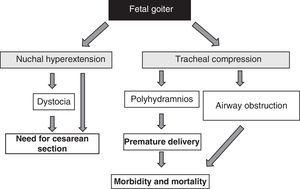 Figur 1.
Figur 1.Konsekvenser af strumaudvikling hos fosteret.
(0,1MB).Diagnostik
Den eneste fuldt pålidelige procedure til bekræftelse af en formodet Fhypo er måling af det føtale TH-niveau ved hjælp af chordocentesis. Dette er en procedure, der ikke er uden komplikationer (den er forbundet med en risiko på 2 % for fosterdød52) og er mere kompleks end simpel fostervandsprøve. Måling af føtale TH-niveauer i fostervand er imidlertid ikke pålidelig og korrelerer ikke med deres måling i fosterblod.53 Man skal være opmærksom på, at TH af moderens oprindelse kan findes i fostervand.54 Ifølge de forskellige retningslinjer6,43 bør chordocentese kun udføres, når der påvises struma hos et foster, hvis mor tager ATD’er, og der ikke kan stilles en sikker diagnose af Fhyper eller Fhypo, og altid på et erfarent center.
I stedet for denne fremgangsmåde er der for nylig blevet foreslået måling af sammensat W, som stammer fra metabolismen af føtale TH’er. Hos fosteret følger metabolismen af TH’er i modsætning til hos voksne den sulfo-konjugerede vej til dannelse af diiodthyroninsulfat; denne forbindelse methyleres igen i placenta og livmodervæggen, inden den overgår i moderens kredsløb og danner forbindelse W. Denne forbindelse findes hos alle gravide kvinder fra udviklingen af den føtale skjoldbruskkirtelfunktion og stiger gradvist i løbet af graviditeten for at forsvinde efter fødslen. Det er derfor blevet foreslået som en markør for den føtale skjoldbruskkirtelfunktion.55 I denne sammenhæng kan en utilstrækkelig udvikling af niveauet af forbindelse W hos en gravid kvinde, der er behandlet med ATD’er, tyde på udvikling af Fhypo.56 Foreløbig er dette dog ikke andet end en kvasieksperimentel metode.
Behandling
Den første foranstaltning, der skal træffes, er ophør af ATD’er. Men på grund af ATD-effekternes latenstid, når de er afbrudt, er det også nødvendigt med TH-substitution, indtil den føtale skjoldbruskkirtel er fuldstændig genoprettet. Placentapassage af TH’er er begrænset, og de bør derfor administreres ad intra-amniotisk vej. Denne vej er, selv om den er invasiv, meget mere sikker end chordocentese, og risikoen for abort er minimal efter første halvdel af graviditeten.57
Med hensyn til intra-amniotisk behandling af fosteret med T4 findes der ikke noget etableret behandlingsskema, og litteraturdataene er ret modstridende.53,58,59 En nylig gennemgang51 af de hidtil rapporterede tilfælde konkluderede, at den gennemsnitlige dosis er ca. 279μg levothyroxin en gang ugentligt (i en til seks uger). Dette ser ud til at vende føtal struma 0,5-2,5 uger efter den første dosis. I nogle tilfælde blev der foretaget gentagne TH-målinger, mens man i andre tilfælde kun overvågede strumaens forsvinden ved hjælp af ultralyd.
Fetal hyperthyroidisme
Fhyper er en sjælden komplikation og kan forekomme hos op til 1-2 % af de børn, der fødes af mødre med nuværende eller tidligere GD, selv om det muligvis kan være en underdiagnosticeret tilstand.60,61
Udviklingen af Fhyper, bortset fra de meget sjældne tilfælde af TSH-receptormutationer,62 kan være resultatet af dårligt kontrolleret GD hos en gravid kvinde eller, mere almindeligt, kan opstå hos en gravid kvinde med GD, der er kureret før graviditeten med ablationsbehandling, og som fortsat har høje TSI-niveauer. Indikationerne for måling af TSI for at fastslå risikoen for Fhyper er allerede blevet diskuteret. TSI-niveauer, der er 3 eller 5 gange højere end normalt6,63 , indebærer en risiko for Fhyper.
Suggestive kliniske tegn
Forekomsten af føtal struma er et af de tidligste kendetegn. Der kan også ses føtal bradykardi, fremskreden knoglealder, generel væksthæmning og kraniosynostose.64 I mere alvorlige former kan der forekomme hjertesvigt med føtal hydrops eller nedsat modning af centralnervesystemet med mental retardering. Der kan eventuelt forekomme for tidlig fødsel.65
Diagnose
De ovennævnte tegn er ikke entydige; takykardi forekommer ikke altid, og tilstedeværelsen af struma i ultralyd er et almindeligt fund ved Fhypo. Hvis der opstår tvivl om, hvorvidt tilstanden er Fhypo på grund af virkningen af ATD’er eller Fhyper på grund af dårlig moderkontrol, har nogle forfattere foreslået et scoringssystem baseret på ultralydsdata66 (tabel 6). Hvis der fortsat er tvivl, bør føtal THs måles ved hjælp af chordocentese, som anført i afsnittet om Fhypo. Forbindelse W (tidligere omtalt) kan muligvis være nyttig til dette formål i fremtiden.
Tabel 6.Ultrasound scoring til at skelne hyperthyroidisme fra hypothyroidisme i føtal struma.
Ultrasound feature Points Føtal hjerterytme Tachykardi 1 Normal 0 Kirtelvaskularisering Central 1 Perifere eller fraværende 0 Føtalbevægelser Normal 1 Øget 0 Knogler modning Accelererede -1 Normale 0 Forsinket 1 Scorefortolkning ≥2 tyder på hyperthyroidisme Adapteret fra Huel et al.66Behandling
Behandlingen bør være baseret på ATD’er. I dette tilfælde bør behandlingen, i modsætning til Fhypo, ikke gives ad intra-amniotisk vej, fordi ATD’er frit krydser placenta. I tilfælde af Fhyper hos en gravid kvinde med dårligt kontrolleret GD er det kun nødvendigt at justere behandlingen hos moderen. Hvis moderen derimod har en normal funktion takket være tidligere ablationsbehandling, og kun fosteret viser hyperfunktion, bør MM/CM administreres til moderen begyndende med doser på 10-20 mg/dag. Behandlingen bør overvåges hver 4-5 dag på baggrund af den føtale HR og strumaens forløb for ikke at overdosere fosteret og forårsage Fhypo.10
Hvis moderen oplever hypothyroidisme ved indgivelse af ATD’er, bør hun gives levothyroxin, som næppe passerer placenta og derfor kompenserer for hypothyroidisme uden at påvirke fosteret. Dette er den eneste omstændighed, hvor det kombinerede skema kan anvendes.
Graves sygdom hos den nyfødte
I nyfødte kan GD under graviditeten forårsage både hyperthyroidisme og hypothyroidisme.
Neonatal hyperthyroidisme
Dette kan forekomme hos 1-5 % af de børn, der fødes af gravide kvinder med aktiv GD10 og høje TSI-titre i det sidste trimester. Fosteret opretholder normal funktion under graviditeten på grund af virkningen af de ATD’er, som moderen har modtaget. ATD’er har en halveringstid på 24-72 timer, og efter denne periode ophører de med at virke på den føtale skjoldbruskkirtel. Denne bliver udsat for moderens TSI, som kan bestå i op til 12 uger efter fødslen.
Der opstår som følge heraf skjoldbruskkirtelhyperfunktion og endog hjertesvigt, der opstår et par dage efter fødslen hos en oprindeligt asymptomatisk nyfødt.
Denne tilstand kan også forekomme hos nyfødte til mødre, der har modtaget ablationsbehandling før graviditeten og fortsat har forhøjede TSI-niveauer, hos hvem der er opstået udiagnosticeret Fhyper. I disse tilfælde er neonatal hyperthyroidisme en fortsættelse af Fhyper; nyfødte viser alvorlig involvering, lav vægt og accelereret knoglemodning ved fødslen.
Behandlingen bør bestå af indgivelse af MM/CM i doser på 0,5-1 mg/kg legemsvægt/dag og propranolol 2 mg/kg legemsvægt/dag36 afhængigt af det kliniske forløb og under hensyntagen til, at der er tale om en forbigående situation. Det skal bemærkes, at TSI’er til sidst kan ændre deres funktionelle profil til at blive receptorblokkere og udvikle hypothyreose.
Sekundær neonatal hypothyreose
I spædbørn født af mødre med dårligt kontrolleret GD kan det vise sig, at forhøjede niveauer af TH’er, som de har været udsat for under graviditeten, har forårsaget undertrykkelse af TSH-sekretionen, hvilket har ført til sekundær hypothyreose ved fødslen.67 Denne situation kan være forbigående eller definitiv som følge af permanent hypofyseforstyrrelse i TSH-sekretionen.
Nyfødte bør gives levothyroxin, efterfulgt af regelmæssig vurdering indtil eventuel genopretning af TSH-sekretionen.
Transient neonatal hypothyreose som følge af persistens af moderens autoantistoffer, der blokerer RSH-receptoren, kan også ses.68
Graves sygdom hos postpartumkvinder
Tidligere kontrolleret GD, enten før eller efter graviditeten, kan genopstå efter fødslen. Recidivraten efter fødslen kan være op til 84 % sammenlignet med 56 % hos kvinder uden graviditet.69 Det anbefales derfor, at moderens THs måles seks uger efter fødslen og i op til et år.10
Hvis GD vender tilbage, vil det være nødvendigt med medicinsk behandling med MM/CM. Selv om ATD’er udskilles i modermælk, indebærer deres indgivelse ingen risiko under amning, og op til 20-30 mg MM/CM kan indtages uden indvirkning på nyfødtes skjoldbruskkirtel.70 ATD’er bør indtages i opdelte doser og altid efter endt mælkeindtagelse.
Det er blevet foreslået, at TSI i modermælk kan nå den nyfødtes generelle cirkulation gennem spædbarnets umodne gastrointestinale epithel og forårsage eller forlænge neonatal hyperthyreose. Der er dog endnu ikke noget afgørende bevis for, at dette sker.71
Addendum
Efter indsendelse af dette manuskript udstedte det nordamerikanske selskab for endokrinologi nye retningslinjer for klinisk praksis om håndtering af skjoldbruskkirteldysfunktion under graviditet og postpartum (J Clin Endocrinol Metab 2012; 97: 2543-2565). De anbefalinger, der er givet i afsnittet om hyperthyreose under graviditet, adskiller sig ikke væsentligt fra dem, der diskuteres i denne gennemgang.
Interessekonflikter
Forfatteren erklærer, at han ikke har nogen interessekonflikter.
- –