Wprowadzenie
Częstość występowania zmian czynności tarczycy u kobiet jest bardzo duża (5/1000 dla niedoczynności tarczycy i 3/1000 dla nadczynności tarczycy1), a ponieważ wiele z tych schorzeń występuje w wieku rozrodczym, nie ma nic dziwnego w tym, że ciąża wiąże się z tymi chorobami. Ponadto, wraz z rozszerzeniem praktyki klinicznej dotyczącej pomiaru stężenia hormonów tarczycy (TH) u kobiet ciężarnych, coraz więcej nieprawidłowości w funkcjonowaniu tarczycy, które w innych okolicznościach zostałyby przeoczone, jest obecnie wykrywanych u kobiet w ciąży.
Z drugiej strony, czynność tarczycy matki ulega znacznym zmianom w czasie ciąży, co powoduje zmiany różnych parametrów laboratoryjnych. Z tego powodu należy stosować inne podejście do interpretacji różnych parametrów czynności tarczycy u kobiet ciężarnych niż u nieciężarnych, aby uniknąć błędnych rozpoznań i ocen o potencjalnie poważnych konsekwencjach.
W związku z powyższym w ostatnich latach pojawiło się zainteresowanie fizjologią i potencjalnymi zmianami w tarczycy w czasie ciąży.2 Wśród nich dokonaliśmy przeglądu aspektów związanych z nadczynnością tarczycy w ciąży, jej wyzwaniami i potencjalnymi konsekwencjami, zarówno w czasie ciąży (u matki i/lub płodu), jak i po porodzie (u matki i/lub noworodka).
Ocena czynności tarczycy w czasie ciąży
W czasie ciąży zachodzą istotne zmiany fizjologiczne, które mają znaczący wpływ na różne parametry czynności tarczycy matki3,4, w tym następujące:
- –
TSH. Obniżone stężenie TSH jest tradycyjnie obserwowane w każdym okresie ciąży w porównaniu z poziomem stwierdzanym u kobiet niebędących w ciąży,5 z minimalnym poziomem w pierwszym trymestrze, który następnie wzrasta w drugim i trzecim trymestrze. Te zmiany w stężeniu TSH odzwierciedlają zmiany w stężeniu ludzkiej gonadotropiny kosmówkowej (HCG), które osiąga szczyt w pierwszym trymestrze, a następnie stopniowo się zmniejsza. Z tego powodu różne towarzystwa naukowe ustaliły normalne wartości referencyjne6-8 (tabela 1).
Tabela 1.Wartości referencyjne TSH według różnych towarzystw.
Społeczeństwo Stężenia TSH (μU/ml) w ciąży Pierwszy trymestr Drugi trymestr Trzeci trymestr Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spanish Society of Endocrinology and Nutrition.
Źródła: Stagnaro-Green i wsp,6 Abalovich i wsp,7 oraz Galofré i wsp.8
Należy zauważyć, że spadki stężenia TSH są jeszcze większe w ciążach mnogich, a kobiety ciężarne palące papierosy mają niższe stężenie TSH w pierwszym i trzecim trymestrze.9
- –
TBGT-T4. Zwiększone stężenie estrogenów związane z ciążą powoduje wzrost stężenia TBG, a w konsekwencji wartości TT4. Zmiany w poziomie TT4 są jednak bardzo konsekwentne (wzrastają o 150%) i zachodzą niezależnie od trymestru ciąży i zastosowanej metody. Dlatego, jeśli dostępne są poziomy TT4, produkcję T4 przez kobiety ciężarne można oszacować mnożąc przez 1,5 limity referencyjne u kobiet nieciężarnych.
- –
FT4. W praktyce klinicznej większość pomiarów wolnej T4 (FT4) nie jest wykonywana przy użyciu złotych standardów dializy równowagowej lub metody ultrafiltracji. Rutynowo stosowaną procedurą jest system immunologiczny, w którym FT4 nie jest wartością bezpośrednio oznaczaną ilościowo, ale raczej szacowaną metodą wrażliwą na białko (wpływ TBG i albuminy), która jest zatem silnie modyfikowana przez ciążę, a także różni się w zależności od trymestru. Ponadto, każda metoda badawcza ma swoje specyficzne odmiany. Oznacza to, że dla właściwej interpretacji FT4 w ciąży konieczne jest dysponowanie wartościami referencyjnymi zależnymi od wieku ciążowego i stosowanej metody, zgodnie z zaleceniami American Thyroid Association (ATA).6
Wpływ nadczynności tarczycy na matkę i płód
Jak przedstawiono w tabeli 2, nadczynność tarczycy w ciąży może mieć poważne konsekwencje zarówno dla matki i płodu, jak i dla noworodka po urodzeniu.10-Należy również zauważyć, że w endogennej nadczynności tarczycy odnotowano ostatnio zwiększone ryzyko zakrzepicy, pozornie odwracalne po opanowaniu nadczynności tarczycy.13 Ze względu na zwiększone ryzyko zakrzepicy żył głębokich i płucnej choroby zakrzepowo-zatorowej w czasie ciąży,14 należy zachować wysoki poziom podejrzliwości, aby umożliwić wczesne wykrycie tego powikłania, i być może trzeba będzie rozważyć działania profilaktyczne.
Matczyno-płodowy wpływ nadczynności tarczycy.
Matczyne
Poronienie
Stan przedrzucawkowy (zwielokrotnia ryzyko×5)7
Poród przedwczesny (zwielokrotnia ryzyko×10)12
. Abruptio placentae
Niewydolność serca (zwielokrotnione ryzyko×20)12
Burza tarczycowa (zwielokrotnione ryzyko×10)12
Zakrzepica żylna13
Niska masa urodzeniowa płodu
Niska Niska masa urodzeniowa
Wewnątrzmaciczne zahamowanie wzrostu
Wcześniactwo
Małe w stosunku do wieku ciążowego
Zgon płodu
Zaburzenia czynności tarczycy (nadczynność tarczycy lub niedoczynność tarczycy)
Wole płodowe
Noworodek
Przemijająca nadczynność tarczycy
Przemijająca lub trwała niedoczynność tarczycy
Klasyfikacja nadczynności tarczycy w ciąży
Tabela 3 opisuje różne możliwości diagnostyczne w przypadku wystąpienia nadczynności tarczycy w ciąży. Z jednej strony, istnieje wiele stanów bezpośrednio wynikających z samej ciąży, które można określić jako przejściową tyreotoksykozę ciążową (Transient gestational thyrotoxicosis – TGT). Z drugiej strony, każdy stan prowadzący do nadczynności tarczycy poza ciążą może wystąpić również w czasie ciąży. Wreszcie, podwyższone stężenie TH może również wystąpić w wyniku egzogennej podaży TH.
Klasyfikacja etiologiczna nadczynności tarczycy w ciąży.
Przemijająca tyreotoksykoza ciążowa
Hyperemesis gravidarum
Ciąża mnoga
Nadczynność tarczycy trofoblastyczna (mol, choriocarcinoma)
Hyperreactio luteinalis
Rodzinna tyreotoksykoza ciążowa
Hiperplacentoza
Choroby tarczycy
Choroba Gravesa
Zapalenie tarczycy
. Zapalenie tarczycy
Wole wieloguzkowe
Gruczolak toksyczny tarczycy
Jatrogenne
Nadmierne leczenie
Nieumyślne przyjmowanie hormonów tarczycy (zanieczyszczenie żywności, etc.)
Factitious
Transient gestational thyrotoxicosis
Jest to najczęstsza przyczyna nadczynności tarczycy w ciąży, może wystąpić w 1-3% wszystkich ciąż.15,16. Została zdefiniowana jako przemijająca nadczynność tarczycy, która jest ograniczona do pierwszej połowy ciąży i charakteryzuje się zwiększonym stężeniem FT4 lub TT4 (skorygowanym) przy stłumionym lub niewykrywalnym TSH przy braku autoprzeciwciał tarczycowych16 lub cech fizycznych sugerujących chorobę Gravesa-Basedowa (GD).17 Jest to zwykle wynikiem zwiększonego stężenia HCG lub większego powinowactwa do receptorów TSH.
Najbardziej charakterystycznym stanem w tej grupie (tabela 3) jest hyperemesis gravidarum (HG), ale istnieją inne stany również związane ze zwiększonym stężeniem HCG, takie jak ciąża mnoga lub choroba trofoblastyczna (wodniak lub choriocarcinoma) z częstością występowania TGT do 50%.17 Istnieją również inne, rzadsze przyczyny, takie jak hyperreactio luteinalis,18 charakteryzujące się tworzeniem torbieli theca-luteinowych w czasie ciąży, lub hyperplacentoza,19 w której obserwuje się zwiększoną masę łożyska i produkcję HCG. Istnieje również rodzinna postać choroby (rodzinna tyreotoksykoza ciążowa20), w której występuje nadwrażliwość receptora TSH na fizjologiczne stężenie HCG, spowodowana dominującą mutacją autosomalną; klinicznie charakteryzuje się ona rozwojem TGT we wszystkich ciążach i u wszystkich kobiet w rodzinie z prawidłowym stężeniem HCG.
Hyperemesis gravidarum
Najczęstszą przyczyną TGT jest HG. HG występuje w 0,5-10/1000 wszystkich ciąż,21 i wiąże się ze zwiększonym stężeniem wolnego TH i supresją TSH w 30-60% przypadków.22 Należy zauważyć, że pojęcie HG powinno być ograniczone do stanów związanych w pierwszym trymestrze ciąży z wymiotami, odwodnieniem, utratą co najmniej 5% masy ciała i ketonurią.23
W tych przypadkach nadczynność tarczycy charakteryzuje się supresją stężenia TSH i minimalnym wzrostem FT4, przy powszechnie prawidłowym stężeniu FT3. Nadczynność tarczycy, jak również towarzyszące jej wymioty, zwykle ustępują samoistnie przed 20. tygodniem, a leczenie objawowe polegające na dożylnym nawadnianiu i podawaniu witaminy B complex jest wystarczające, aby zapobiec wyjątkowemu ryzyku wystąpienia encefalopatii Wernickego.24 Nie ma dowodów, że leczenie lekami przeciwtarczycowymi (ATD) przynosi jakiekolwiek korzyści,25 a zatem ich stosowanie jest niewskazane.6
Wyjątkowo, HG z silnie zaznaczoną komponentą nadczynności tarczycy lub GD z towarzyszącą nietolerancją ze strony przewodu pokarmowego (nudności i wymioty) mogą sugerować potrzebę diagnostyki różnicowej między nimi. Tabela 4 przedstawia główne różnice. W każdym przypadku, jeśli nadczynność tarczycy trwa dłużej niż pierwszy trymestr ciąży, należy podejrzewać przyczynę inną niż TGT.
Różnice między chorobą Gravesa i nadczynnością tarczycy.
| Oznaczenie | choroba Gravesa | nadczynność | |
| Objawy nadczynności tarczycy przed ciążą | ++ | – | |
| Objawy nadczynności tarczycy w ciąży | +/++ | -/+ | |
| Nudności/wymioty | -/+ | +++ | |
| Węzły/oftalmopatia | + | – | |
| Przeciwciała tarczycowe | ++ | – | |
| T-.US | Nadciśnienie tętnicze | Normalne | |
| Gorączka w wywiadzie rodzinnym | – | + | |
| Podobne objawy w poprzedniej ciąży | – | + | |
| . | |||
| T4 | |||
| T3 | |||
| T3/TT4 stosunek | >20 |
T-.US: USG tarczycy; HG: hyperemesis gravidarum.
Choroba Gravesa-Basedowa
Wśród chorób tarczycy GD jest najczęstszą przyczyną nadczynności tarczycy w ciąży, występującą w 0,1-1% wszystkich ciąż (kliniczna i subkliniczna nadczynność tarczycy odpowiednio w 0,4% i 0,6%).10
Historia naturalna GD w ciąży to zaostrzenie objawów w pierwszym trymestrze spowodowane addytywnym efektem stymulacji receptora TSH przez HCG, następnie poprawa w drugiej połowie ciąży spowodowana immunomodulacyjnym działaniem ciąży i jej nawrót po porodzie.
Choroba Gravesa-Basedowa w ciąży
Objawy aktywnej GD w ciąży nie różnią się od typowych dla tego schorzenia. Niektóre objawy mogą być czasem mylone z objawami samej ciąży. Ewentualna obecność objawów ocznych i wola pomaga wyjaśnić stan, a pomiary hormonów pozwalają na postawienie diagnozy.
Leczenie choroby Gravesa-Basedowa w ciąży
Jak wiadomo, istnieją trzy potencjalne metody leczenia GD u kobiet niebędących w ciąży: podawanie 131I, operacja lub leczenie medyczne z zastosowaniem ATD. Spośród tych trzech opcji podawanie 131I jest przeciwwskazane w ciąży ze względu na ryzyko wad rozwojowych,7 a zatem możliwości są ograniczone do tyreoidektomii lub stosowania ATD. Jeśli chodzi o leczenie chirurgiczne, powinno być ono wykonywane tylko w wyjątkowych okolicznościach, co omówiono poniżej.
Postępowanie medyczne. Leki przeciwtarczycowe
W przypadku leczenia GD w ciąży jeszcze kilka lat temu propylotiouracyl (PTU) był tradycyjnie uważany za lek z wyboru w porównaniu z metimazolem/karbimazolem (MM/CM).26 Koncepcja ta opierała się na niektórych badaniach sugerujących minimalny transfer łożyskowy PTU w porównaniu z MM/CM27 oraz na teratogennym działaniu MM/CM. Obecnie wiadomo, że oba ATD przechodzą przez łożysko i dlatego mają takie samo prawdopodobieństwo oddziaływania na płód i wywołania niedoczynności tarczycy u płodu.26
Ponadto rola MM/CM w występowaniu u płodu aplasia cutis oraz atrezji przewodu żółciowego i przełyku, a także innych wad rozwojowych określanych ogólnie jako „embriopatia metimazolowa”,28 budzi wiele kontrowersji,29-31 a wady te przypisywano w niektórych przypadkach szkodliwemu działaniu samej nadczynności tarczycy. Ostatnie badania,32,33 wskazują jednak, że MM/CM ma działanie teratogenne, w przeciwieństwie do PTU.
Z drugiej strony, w ostatnich latach pojawiły się doniesienia o przypadkach piorunującego toksycznego zapalenia wątroby u pacjentów leczonych PTU,34,35 z częstością występowania od 0,1% do 0,5% i dużą śmiertelnością (25-50%).10,36 Opisywano nawet przypadki zapalenia wątroby u noworodków urodzonych przez matki, które były leczone PTU.37,38
Stajemy zatem przed dylematem: z jednej strony wydaje się jasno uznane, że MM/CM wiąże się z ryzykiem wad rozwojowych, a z drugiej strony, że PTU może powodować śmiertelne powikłania.
W obliczu tej alternatywy niektórzy autorzy zalecają leczenie ablacyjne przed zajściem w ciążę u kobiet z GD.39 Rozwiązanie to jednak w niewielkim stopniu rozwiązuje problem, ponieważ kobiety z GD w większości przypadków nie planują ciąży. Z drugiej strony, takie postępowanie nie zapobiega ewentualnej nadczynności tarczycy u płodu (Fhyper) z powodu utrzymywania się wysokiego stężenia przeciwciał stymulujących tarczycę (TSI), co wymaga leczenia, a więc ponownie podnosi problem.
Z tego powodu ATA ustaliła kryteria stosowania PTU w populacji ogólnej i u kobiet w ciąży.40 W przypadku ciąży ATA odradza stosowanie MM/CM w pierwszym trymestrze ciąży (okres organogenezy) i zaleca stosowanie PTU. Po 12. tygodniu ciąży należy zaprzestać stosowania PTU ze względu na ryzyko chorób wątroby, a kontrolę GD należy kontynuować za pomocą MM/CM. Poza ciążą stosowanie PTU jest zalecane tylko w dwóch sytuacjach: po pierwsze, jeśli wystąpi burza tarczycowa, a po drugie, w obecności działań niepożądanych wywołanych przez MM/CM.
Aby uniknąć opóźnienia w rozpoczęciu leczenia PTU, zaleca się, aby kobiety z GD, które potencjalnie mogą zajść w ciążę i nie stosują żadnej metody antykoncepcyjnej, miały dostępne w domu PTU i zostały poinstruowane, aby zmienić lek (z MM/CM na PTU), jak tylko ciąża zostanie zweryfikowana.
Postępowanie medyczne. Postępowanie kliniczne
Jak omówiono powyżej, leczenie GD w czasie ciąży powinno składać się z PTU w pierwszym trymestrze i MM/CM w późniejszym okresie. Dawka początkowa może wynosić od 50 do 300 mg/dobę PTU w trzech dawkach podzielonych, 5 do 15 mg/dobę metimazolu lub 10 do 15 mg/dobę karbimazolu w dawce pojedynczej.6 Należy zawsze starać się stosować możliwie najmniejszą dawkę.
Beta-blokery powinny być stosowane tylko przejściowo, ponieważ ich długotrwałe stosowanie wiąże się z wewnątrzmacicznym zahamowaniem wzrostu, bradykardią i hipoglikemią noworodków.41 Ponadto niektórzy autorzy donoszą o częstszych poronieniach podczas skojarzonego leczenia propranololem i ATD.42
Podczas dostosowywania dawki ATD należy dążyć do utrzymania czynności tarczycy u matki w pobliżu granicy subklinicznej nadczynności, ponieważ tarczyca płodu jest znacznie bardziej wrażliwa na blokujące działanie ATD. W rzeczywistości obecność wykrywalnego TSH jest wskazaniem do zmniejszenia dawki ATD.10,43
GD w ciąży wykazuje bardzo dynamiczny przebieg, tak że nawet 20%-30% pacjentek osiąga stopień kontroli pozwalający na odstawienie ATD w ostatnim trymestrze ciąży.44 Stosowanie schematu skojarzonego (ATD i TH) w leczeniu GD jest bezwzględnie przeciwwskazane w ciąży, ponieważ powoduje niedoczynność tarczycy u płodu (Fhypo).6,43
Chirurgia
Jeśli chodzi o stosowanie chirurgii w celu kontroli GD u kobiet w ciąży, różne konsensusy i wytyczne kliniczne6,7,43 są zgodne co do tego, że zaleca się ją tylko w przypadku wystąpienia następujących sytuacji:
- 1
Działania niepożądane ATD uniemożliwiające ich stosowanie.
- 2
Potrzeba stosowania dużych dawek ATD.
- 3
Nieprzestrzeganie przez pacjentkę zaleceń medycznych.
Wytyczne włoskie43 zalecają ponadto zabieg chirurgiczny w przypadkach rozległego wola ciążowego z uciskiem dróg oddechowych.
Jeżeli zabieg jest wykonywany, najlepszym czasem na jego przeprowadzenie jest okres od drugiego trymestru ciąży. Uzasadnia to stosowanie beta-blokerów i jodku sodu (50-100mg/dobę)45 przez krótki okres (10-14 dni) u ciężarnych z GD jako przygotowanie do operacji. Jak wspomniano powyżej, należy unikać długotrwałego leczenia beta-blokerami. Należy również zachować ostrożność w przypadku podawania jodku potasu, aby zapobiec rozwojowi wola i/lub Fhypo.
Operacja powoduje głęboką zmianę sytuacji. Z jednej strony nadczynność tarczycy u kobiet w ciąży ustępuje, ale u matki indukowana jest niedoczynność tarczycy, wymagająca szybkiej substytucji i regularnego monitorowania TSH. Należy także kontrolować stężenie TSI, a w razie potrzeby monitorować nadczynność tarczycy u płodu.
Zmiany w autoimmunizacji tarczycy w czasie ciąży
Niektórzy autorzy wykazali, przynajmniej w niektórych przypadkach, że aktywność czynnościowa przeciwciał przeciwko receptorowi TSH zmienia się z pobudzającej na hamującą lub blokującą.46,47 Oznacza to, że ciąża moduluje nie tylko stężenie autoprzeciwciał, ale także ich profil czynnościowy. Koncepcja ta sugeruje, że GD w ciąży może ewoluować nie tylko do normalnej funkcji, ale nawet do niedoczynności z powodu tej zmiany aktywności stymulująco-blokującej, co opisywano w niektórych przypadkach.48 Oznacza to, że GD w ciąży jest procesem zmiennym, który wymaga stałego, regularnego monitorowania i którego nie należy lekceważyć nawet wtedy, gdy osiągnięto pozorną remisję niewymagającą stosowania ATD.
Pomiar przeciwciał stymulujących tarczycę w ciąży
Aby zapobiec wpływowi potencjalnych autoprzeciwciał TSI na tarczycę płodu, w 1998 roku ETA opublikowała49 kryteria ustalające wskazania do pomiaru TSI w ciąży w zależności od charakterystyki GD u matki (tab. 5).
Wskazania do pomiaru TSI według Europejskiego Stowarzyszenia Tarczycy.
(I) Kobieta w stanie eutyreozy z GD wyleczona leczeniem medycznym przed ciążą
– Brak pomiaru
(II) Kobieta w stanie eutyreozy z GD wyleczona po131I lub operacji
– Pomiar TSI wcześnie: jeśli wynik dodatni, monitorować nadczynność tarczycy u płodu
– Zmierzyć TSI w trzecim trymestrze (jeśli wynik dodatni w pierwszym trymestrze): jeśli wynik dodatni, monitorować nadczynność tarczycy noworodków
(III) Kobieta leczona z powodu GD w czasie ciąży
– Zmierzyć TSI w trzecim trymestrze, jeśli wynik dodatni, monitorować nadczynność tarczycy noworodków
GD: choroba Gravesa-Basedowa.
Źródło: Laurberg i wsp.49
W przypadkach, w których GD została wyleczona przed zajściem w ciążę za pomocą leczenia farmakologicznego, stan immunologiczny uważa się za rozwiązany, a pomiar TSI nie jest wymagany.
Gdy GD zostaje rozwiązana za pomocą terapii ablacyjnej (chirurgii lub radioterapii), stan immunologiczny może się utrzymywać. Poziom TSI staje się zwykle ujemny 12-18 miesięcy po operacji. Po terapii ablacyjnej 131I poziom TSI początkowo wzrasta w ciągu pierwszych kilku miesięcy, a następnie obniża się, choć może pozostać wysoki nawet przez pięć lat.50 Oznacza to, że aby zapobiec potencjalnemu Fhyper po 131I, należy utrzymywać długoterminową antykoncepcję. Dlatego u kobiet, które chcą zajść w ciążę i mają wysokie miana TSI, operacja jest preferowana zamiast 131I. We wszystkich tych przypadkach poziom TSI powinien być oznaczony wcześnie, aby ocenić potencjalne ryzyko HF, i powinien być ponownie oznaczony w trzecim trymestrze, aby sprawdzić, czy nadal jest dodatni i czy w związku z tym istnieje ryzyko nadczynności tarczycy u noworodków.
W przypadku aktywnej GD w czasie ciąży potencjalne ryzyko Fhyper jest kontrolowane przez leczenie matki ATD. Uważa się jednak za wskazane wykonanie badania TSI pod koniec ciąży w celu oceny ryzyka wystąpienia nadczynności tarczycy u noworodków.
ATA6 zaleca wykonanie badania w około 20-24 tygodniu i określa znacznie bardziej ogólne zalecenia:
- –
Matka z aktywną nadczynnością tarczycy.
- –
Historia leczenia 131I.
- –
Poprzednia tyreoidektomia.
- –
Poprzedni noworodek z nadczynnością tarczycy.
Choroba Gravesa u płodu
Należy pamiętać, że tarczyca płodu osiąga dojrzałość od 20. tygodnia, a zatem jest w stanie reagować na te same wpływy (ATD i TSI), co tarczyca dorosłego człowieka. Z tego powodu zarówno Fhypo, jak i Fhyper mogą występować w przebiegu GD w ciąży.
Niedoczynność tarczycy u płodu
Fhypo występuje zwykle z powodu względnego przedawkowania ATD, które może utrzymywać prawidłową czynność u matki, ale powoduje wyraźną hipofunkcję u płodu.
Sugestywne objawy kliniczne
Chorobę można klinicznie podejrzewać na podstawie wola płodowego w położniczym badaniu ultrasonograficznym oraz rozwoju wielowodzia u ciężarnej leczonej ATD.
Występowanie wola płodowego, niezależnie od aspektów czynnościowych, jest sygnałem alarmowym ze względu na jego efekt masowy51 (ryc. 1). Należy wziąć pod uwagę, że powiększenie tarczycy powoduje nadmierne rozciągnięcie tylnej części szyi płodu, co z kolei upośledza wewnątrzmaciczną ruchomość płodu i w konsekwencji prowadzi do nieprawidłowej prezentacji przy porodzie (dystocja barkowa, ułożenie miednicowe itp.). Nawet jeśli hiperekstensja nie uniemożliwia odpowiedniego ułożenia cefalicznego płodu, to uniemożliwia odpowiednie zgięcie szyi płodu podczas porodu, powodując prezentację twarzową. Wszystkie te sytuacje wymagają wykonania cięcia cesarskiego. Nie jest to jednak główne powikłanie, gdyż ucisk wywierany przez wole na niedojrzałe chrząstki tchawicy płodu może powodować ucisk tchawicy i przełyku. Powoduje to niedrożność dróg oddechowych, co wiąże się z ryzykiem asfiksji. Ponadto ucisk przełyku utrudnia połykanie płynu owodniowego, prowadząc do jego nagromadzenia i rozwoju wielowodzia. Sprzyja to przedwczesnemu porodowi, który jest główną przyczyną zachorowalności i śmiertelności noworodków.
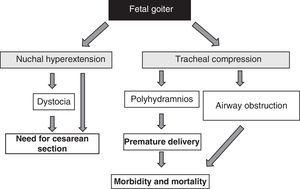
Konsekwencje rozwoju wola u płodu.
Diagnostyka
Jedyną w pełni wiarygodną procedurą potwierdzającą podejrzenie Fhypo jest pomiar poziomu TH u płodu za pomocą chordocentezy. Jest to procedura, która nie jest pozbawiona powikłań (wiąże się z 2% ryzykiem zgonu płodu52) i jest bardziej złożona niż zwykła amniopunkcja. Pomiar stężenia TH płodowych w płynie owodniowym nie jest jednak wiarygodny i nie koreluje z ich pomiarem we krwi płodu.53 Należy pamiętać, że w płynie owodniowym mogą znajdować się TH pochodzenia matczynego.54 Zgodnie z różnymi wytycznymi,6,43 chordocenteza powinna być wykonywana tylko w przypadku wykrycia wola u płodu, którego matka przyjmuje ATD i nie można postawić pewnego rozpoznania Fhyper lub Fhypo, i zawsze w doświadczonym ośrodku.
Zamiast tego podejścia zaproponowano ostatnio pomiar związku W, powstającego w wyniku metabolizmu płodowych THs. U płodu, inaczej niż u dorosłych, metabolizm TH przebiega na drodze sulfo-koniugacji, tworząc siarczan dijodotyroniny; związek ten jest z kolei metylowany w łożysku i ścianie macicy, zanim przejdzie do krążenia matczynego i utworzy związek W. Związek ten występuje u wszystkich ciężarnych kobiet od momentu rozwoju funkcji tarczycy płodu i stopniowo wzrasta w czasie ciąży, zanikając po porodzie. Dlatego zaproponowano go jako marker czynności tarczycy płodu.55 W tym kontekście nieodpowiednia progresja stężenia związku W u ciężarnej leczonej ATD może sugerować rozwój Fhypo.56 Jednak na razie jest to jedynie metoda quasi-eksperymentalna.
Leczenie
Pierwszym działaniem, jakie należy podjąć, jest zaprzestanie stosowania ATD. Jednak ze względu na opóźnione działanie ATD po ich odstawieniu, konieczna jest również substytucja TH do czasu całkowitego wyzdrowienia tarczycy płodu. Przenikanie łożyskowe TH jest ograniczone, dlatego też należy je podawać drogą wewnątrz owodniową. Droga ta, choć inwazyjna, jest znacznie bezpieczniejsza niż chordocenteza, przy minimalnym ryzyku poronienia po pierwszej połowie ciąży.57
Jeśli chodzi o leczenie płodu T4 drogą dootrzewnową, nie ma ustalonego schematu leczenia, a dane z piśmiennictwa są dość sprzeczne.53,58,59 W ostatnim przeglądzie51 zgłoszonych do tej pory przypadków stwierdzono, że średnia dawka wynosi około 279 μg lewotyroksyny raz w tygodniu (przez jeden do sześciu tygodni). Wydaje się, że powoduje to odwrócenie wola płodowego 0,5-2,5 tygodnia po podaniu pierwszej dawki. W niektórych przypadkach wykonano powtórne pomiary TH, podczas gdy w innych przypadkach zanik wola monitorowano jedynie za pomocą badania ultrasonograficznego.
Nadczynność tarczycy u płodu
Wole jest rzadkim powikłaniem i może wystąpić nawet u 1-2% dzieci urodzonych przez matki z obecną lub wcześniejszą GD, chociaż może być stanem niedostatecznie zdiagnozowanym.60,61
Rozwój Fhyper, z wyjątkiem bardzo rzadkich przypadków mutacji receptora TSH,62 może być wynikiem źle kontrolowanej GD u ciężarnej lub, co częstsze, może wystąpić u ciężarnej z GD wyleczoną przed ciążą za pomocą terapii ablacyjnej, u której nadal utrzymuje się wysokie stężenie TSI. Wskazania do pomiaru TSI w celu określenia ryzyka wystąpienia Fhypera zostały już omówione. Poziom TSI 3- lub 5-krotnie wyższy od prawidłowego6,63 wiąże się z ryzykiem wystąpienia wola płodowego.
Sugestywne objawy kliniczne
Występowanie wola płodowego jest jedną z najwcześniejszych cech. Można również zaobserwować bradykardię płodową, zaawansowany wiek kostny, ogólne opóźnienie wzrostu i kraniosynostozę.64 W cięższych postaciach może wystąpić niewydolność serca z wodogłowiem płodu lub zaburzone dojrzewanie ośrodkowego układu nerwowego z opóźnieniem umysłowym. Ostatecznie może dojść do przedwczesnego porodu.65
Diagnostyka
Wyżej wymienione objawy nie są ostateczne; tachykardia nie zawsze występuje, a obecność wola w badaniu ultrasonograficznym jest częstym objawem w przypadku Fhypo. Jeśli pojawią się wątpliwości, czy stan jest Fhypo z powodu wpływu ATDs lub Fhyper z powodu słabej kontroli matki, niektórzy autorzy zaproponowali system punktacji oparty na danych ultrasonograficznych66 (Tabela 6). Jeśli nadal istnieją wątpliwości, należy oznaczyć THs u płodu za pomocą chordocentezy, jak podano w części dotyczącej Fhypo. Związek W (omówiony wcześniej) może być pomocny w tym celu w przyszłości.
Ultrasonograficzna ocena punktowa w celu różnicowania nadczynności i niedoczynności tarczycy w wolem płodowym.
| Cecha ultrasonograficzna | Punkty |
| Centrala serca płodu | |
| Tachykardia | 1 |
| Normalna | 0 |
| Unaczynienie wola | |
| Centralne | 1 |
| . Obwodowe lub nieobecne | 0 |
| Ruchy płodu | |
| Normalne | 1 |
| Zwiększone | 0 |
| Dojrzewanie kości Dojrzewanie | |
| Przyspieszone | -1 |
| Normalne | 0 |
| . Opóźniony | 1 |
| Interpretacja wyniku | |
| ≥2 sugeruje nadczynność tarczycy | |
Traktowanie
Traktowanie powinno być oparte na ATD. W tym przypadku, inaczej niż w przypadku Fhypo, leczenie nie powinno być podawane drogą doamniotyczną, ponieważ ATD swobodnie przekraczają łożysko. W przypadku wystąpienia Fhyper u ciężarnej ze źle kontrolowaną GD, wymagana jest jedynie korekta leczenia u matki. Natomiast jeśli matka ma prawidłową funkcję dzięki wcześniejszej terapii ablacyjnej, a tylko płód wykazuje nadczynność, MM/CM należy podawać matce, zaczynając od dawek 10-20mg/dobę. Leczenie powinno być monitorowane co 4-5 dni na podstawie HR płodu i przebiegu wola, aby nie przedawkować i nie spowodować Fhypo.10
Jeśli u matki wystąpi niedoczynność tarczycy po podaniu ATD, powinna otrzymać lewotyroksynę, która prawie nie przenika przez łożysko i dlatego wyrównuje niedoczynność tarczycy bez wpływu na płód. Jest to jedyna okoliczność, w której można zastosować schemat łączony.
Choroba Gravesa u noworodków
U noworodków GD w czasie ciąży może powodować zarówno nadczynność, jak i niedoczynność tarczycy.
Nadczynność tarczycy u noworodków
Może ona wystąpić u 1-5% dzieci urodzonych przez ciężarne z aktywną GD10 i wysokimi mianami TSI w ostatnim trymestrze. Płód zachowuje prawidłowe funkcje w czasie ciąży dzięki działaniu ATD otrzymywanych przez matkę. ATD mają okres półtrwania 24-72h i po tym czasie przestają działać na tarczycę płodu. Staje się on narażony na działanie matczynego TSI, które może utrzymywać się do 12 tygodni po porodzie.
W konsekwencji pojawia się nadczynność tarczycy, a nawet niewydolność serca, występująca kilka dni po porodzie u początkowo bezobjawowego noworodka.
Stan ten może wystąpić również u noworodków matek, które przed ciążą otrzymały terapię ablacyjną i nadal mają podwyższone stężenie TSI, u których wystąpiło nierozpoznane Fhyper. W tych przypadkach noworodkowa nadczynność tarczycy jest kontynuacją Fhyper; noworodki wykazują ciężkie zajęcie, niską masę ciała i przyspieszone dojrzewanie kości po urodzeniu.
Leczenie powinno polegać na podawaniu MM/CM w dawkach 0,5-1mg/kg masy ciała/dobę i propranololu 2mg/kg masy ciała/dobę36 w zależności od przebiegu klinicznego i pamiętając, że jest to sytuacja przejściowa. Należy zauważyć, że TSI mogą ostatecznie zmienić swój profil funkcjonalny, stając się blokerami receptorów i rozwinąć niedoczynność tarczycy.
Wtórna niedoczynność tarczycy u noworodków
W przypadku dzieci urodzonych przez matki ze źle kontrolowaną GD może okazać się, że podwyższone poziomy TH, na które były narażone w czasie ciąży, spowodowały supresję wydzielania TSH, prowadząc do wtórnej niedoczynności tarczycy po urodzeniu.67 Sytuacja ta może być przejściowa lub ostateczna w wyniku trwałego upośledzenia wydzielania TSH przez przysadkę.
Noworodkom należy podawać lewotyroksynę, a następnie regularnie oceniać ich stan aż do ostatecznego powrotu wydzielania TSH.
Można również zaobserwować przejściową niedoczynność tarczycy u noworodków spowodowaną utrzymywaniem się matczynych autoprzeciwciał blokujących receptor RSH.68
Graves disease in postpartum women
Poprzednio kontrolowana GD, przed lub po ciąży, może nawrócić po porodzie. Częstość nawrotów po porodzie może wynosić do 84%, w porównaniu z 56% u kobiet, które nie zaszły w ciążę.69 Dlatego zaleca się oznaczanie TH u matki sześć tygodni po porodzie i przez okres do jednego roku.10
Jeśli GD nawróci, konieczne będzie leczenie MM/CM. Mimo że ATD są wydzielane do mleka kobiecego, ich podawanie w okresie laktacji nie wiąże się z żadnym ryzykiem i można przyjmować do 20-30 mg MM/CM bez wpływu na tarczycę noworodków.70 ATD powinny być przyjmowane w dawkach podzielonych i zawsze po zakończeniu przyjmowania mleka.
Sugerowano, że TSI zawarte w mleku kobiecym mogą przedostawać się do krążenia ogólnego noworodków przez niedojrzały nabłonek przewodu pokarmowego niemowlęcia i powodować lub przedłużać noworodkową nadczynność tarczycy. Jednak jak dotąd nie ma jednoznacznych dowodów, że tak się dzieje.71
Uzupełnienie
Po złożeniu tego manuskryptu Północnoamerykańskie Towarzystwo Endokrynologiczne wydało nowe wytyczne praktyki klinicznej dotyczące postępowania w przypadku zaburzeń czynności tarczycy w okresie ciąży i połogu (J Clin Endocrinol Metab 2012; 97: 2543-2565). Zalecenia podane w części dotyczącej nadczynności tarczycy w ciąży nie różnią się istotnie od zaleceń omówionych w niniejszym przeglądzie.
Konflikty interesów
Autor oświadcza, że nie ma konfliktów interesów.
.