Introduction
La prévalence des altérations de la fonction thyroïdienne chez la femme est très élevée (5/1000 pour l’hypothyroïdie et 3/1000 pour l’hyperthyroïdie1), et comme beaucoup de ces affections surviennent à l’âge de la procréation, il n’y a rien d’étrange à ce que la grossesse soit associée à ces maladies. De plus, au fur et à mesure que la pratique clinique de la mesure des taux d’hormones thyroïdiennes (TH) chez les femmes enceintes s’étend, un nombre croissant d’anomalies de la fonction thyroïdienne qui auraient été négligées dans d’autres circonstances sont maintenant détectées chez les femmes enceintes.
D’autre part, la fonction thyroïdienne maternelle subit des changements importants pendant la grossesse, ce qui entraîne des modifications des différents paramètres de laboratoire. Pour cette raison, une approche différente doit être utilisée chez les femmes enceintes par rapport aux femmes non enceintes lors de l’interprétation des différents paramètres de la fonction thyroïdienne afin d’éviter des diagnostics et des évaluations erronés avec des conséquences potentiellement graves.
En conséquence de ce qui précède, un intérêt s’est manifesté ces dernières années pour la physiologie et les changements potentiels de la glande thyroïde pendant la grossesse2. Parmi ceux-ci, nous avons passé en revue les aspects liés à l’hyperthyroïdie pendant la grossesse, ses défis et ses conséquences potentielles, à la fois pendant la grossesse (chez la mère et/ou le fœtus) et après la naissance (chez la mère et/ou le nouveau-né).
Évaluation fonctionnelle de la thyroïde pendant la grossesse
Des changements physiologiques importants qui ont un impact considérable sur les différents paramètres de la fonction thyroïdienne maternelle3,4 se produisent pendant la grossesse, y compris les suivants :
- –
TSH. Une diminution des niveaux de TSH a traditionnellement été observée dans toute période de grossesse par rapport aux niveaux trouvés chez les femmes non enceintes,5 avec des niveaux minimums au cours du premier trimestre qui augmentent ensuite au cours des deuxième et troisième trimestres. Ces changements dans les niveaux de TSH reflètent les changements dans les niveaux de gonadotrophine chorionique humaine (HCG), qui atteignent un pic au cours du premier trimestre et diminuent progressivement par la suite. C’est pourquoi les différentes sociétés scientifiques ont établi des valeurs normales de référence6-8 (tableau 1).
Tableau 1.Valeurs de référence de la TSH selon différentes sociétés.
Société Niveaux de TSH (μU/ml) au cours de la grossesse Premier trimestre Second trimestre Troisième trimestre Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA : American Thyroid Association ; Endo : Endocrine Society ; SEEN : Société espagnole d’endocrinologie et de nutrition.
Sources : Stagnaro-Green et al.6, Abalovich et al.7 et Galofré et al.8
Il convient de noter que les diminutions des niveaux de TSH sont encore plus importantes dans les grossesses multiples, et que les femmes enceintes qui fument ont des niveaux de TSH plus faibles au cours des premier et troisième trimestres.9
- –
TBGT-T4. L’augmentation des niveaux d’œstrogènes associée à la grossesse augmente les niveaux de TBG et, par conséquent, les valeurs de TT4. Cependant, les changements dans les niveaux de TT4 sont très cohérents (ils augmentent de 150%) et le font indépendamment à la fois du trimestre et de la méthode utilisée. Ainsi, si les taux de TT4 sont disponibles, la production de T4 par les femmes enceintes peut être estimée en multipliant par 1,5 les limites de référence chez les femmes non enceintes.
- –
FT4. Dans la pratique clinique, la plupart des mesures de la T4 libre (FT4) ne sont pas effectuées en utilisant les méthodes de référence que sont la dialyse à l’équilibre ou l’ultrafiltration. La procédure couramment utilisée est un système de dosage immunologique où la FT4 n’est pas une valeur directement quantifiée, mais plutôt estimée par une méthode sensible aux protéines (influencée par la TBG et l’albumine), et qui est donc fortement modifiée par la grossesse, et varie également en fonction du trimestre. En outre, chaque méthode d’essai présente des variations spécifiques. Cela signifie que, pour une interprétation adéquate du FT4 pendant la grossesse, il faut disposer de valeurs de référence dépendant de l’âge gestationnel et de la méthode utilisée, comme l’indique l’American Thyroid Association (ATA).6
Conséquences de l’hyperthyroïdie sur la mère et le fœtus
Comme le montre le tableau 2, l’hyperthyroïdie pendant la grossesse peut avoir des conséquences graves tant pour la mère que pour le fœtus et, après la naissance, pour le nouveau-né10.-Il convient également de noter qu’un risque accru de thrombose, apparemment réversible avec le contrôle de l’hyperthyroïdie, a récemment été signalé dans l’hyperthyroïdie endogène13. En raison de l’augmentation du risque de thrombose veineuse profonde et de thromboembolie pulmonaire pendant la grossesse,14 un haut niveau de suspicion doit être maintenu pour permettre une détection précoce de cette complication, et des mesures prophylactiques peuvent devoir être envisagées.
Conséquences materno-fœtales de l’hyperthyroïdie.
Maternel
Fausse couche
Prééclampsie (multiplie le risque×5)7
Accouchement prématuré (multiplie le risque×10)12
. Abruptio placentae
Insuffisance cardiaque (multiplie le risque par 20)12
Thrombose thyroïdienne (multiplie le risque par 10)12
Thrombose veineuse13
Insuffisance pondérale fœtale
. poids de naissance
Retard de croissance intra-utérin
Prématurité
Petite taille pour l’âge gestationnel
Mort fœtale
Dysfonctionnement thyroïdien (hyperthyroïdie ou hypothyroïdie)
Goitre fœtal
Néonatal
Hyperthyroïdie transitoire
Hypothyroïdie transitoire ou permanente
Classification de l’hyperthyroïdie pendant la grossesse
Le tableau 3 décrit les différentes possibilités de diagnostic lorsque l’hyperthyroïdie survient pendant la grossesse. D’une part, il existe un certain nombre d’affections résultant directement de la grossesse elle-même, qui peuvent être englobées dans la rubrique de la thyrotoxicose gestationnelle transitoire (TGT). D’autre part, toute affection entraînant une hyperfonctionnement de la thyroïde en dehors de la grossesse peut également se produire pendant la grossesse. Enfin, une augmentation des taux de TH peut également survenir en raison d’un apport exogène de TH.
Classification étiologique de l’hyperthyroïdie pendant la grossesse.
Thyrotoxicose gestationnelle transitoire
Hyperemesis gravidarum
Grossesse multiple
Hyperthyroïdie trophoblastique (môle, choriocarcinome)
Hyperréactivité lutéinique
Thyrotoxicose familiale gestationnelle
Hyperplacentose
Maladie thyroïdienne
Maladie de Basedow
Thyroïdite
Goitre multinodulaire
Adénome thyroïdien toxique
Iatrogène
Surtraitement
Apport involontaire d’hormones thyroïdiennes (contamination alimentaire, etc.)
Factice
Thyrotoxicose gestationnelle transitoire
C’est la cause la plus fréquente d’hyperthyroïdie pendant la grossesse, et elle peut survenir dans 1 à 3 % de toutes les grossesses15,16. Elle a été définie comme une hyperthyroïdie transitoire qui se limite à la première moitié de la grossesse et qui se caractérise par une augmentation des taux de FT4 ou de TT4 (ajustés) avec une TSH supprimée ou indétectable en l’absence d’auto-anticorps thyroïdiens16 ou de caractéristiques physiques suggérant une maladie de Basedow (GD).17 Cela résulte généralement d’une augmentation des taux de HCG ou d’une plus grande affinité pour les récepteurs de la TSH.
L’affection la plus caractéristique au sein de ce groupe (tableau 3) est l’hyperemesis gravidarum (HG), mais d’autres affections sont également associées à une augmentation des taux de HCG, comme les grossesses multiples ou les maladies trophoblastiques (môle hydatique ou choriocarcinome) avec une prévalence de la TGT pouvant atteindre 50 %.17 Il existe également d’autres causes moins fréquentes comme l’hyperreactio luteinalis,18 caractérisée par la formation de kystes de thèque-lutéine dans le cadre d’une grossesse, ou l’hyperplacentose,19 où l’on observe une augmentation du poids du placenta et de la production d’HCG. Il existe également une affection familiale (thyrotoxicose familiale gestationnelle20) dans laquelle une hypersensibilité du récepteur de la TSH aux niveaux physiologiques d’HCG se produit en raison d’une mutation autosomique dominante ; elle se caractérise cliniquement par le développement d’une TGT dans toutes les grossesses et chez toutes les femmes de la famille avec des niveaux normaux d’HCG.
Hyperémèse gravidique
La cause la plus fréquente de TGT est l’HG. L’HG survient dans 0,5 à 10/1000 de toutes les grossesses,21 et est associée à une augmentation des taux de TH libre et à une suppression de la TSH dans 30 à 60 % des cas.22 Il convient de noter que le concept d’HG doit être limité aux conditions associées, au cours du premier trimestre de la grossesse, à des vomissements, une déshydratation, une perte d’au moins 5 % du poids corporel et une cétonurie.23
Dans ces cas, l’hyperthyroïdie se caractérise par la suppression des taux de TSH et une augmentation minimale de la FT4, avec des taux de FT3 généralement normaux. L’hyperfonctionnement thyroïdien, ainsi que les vomissements associés, se résolvent généralement spontanément avant la 20e semaine, et un traitement symptomatique par hydratation intraveineuse et complexe de vitamine B est suffisant pour prévenir le risque exceptionnel d’encéphalopathie de Wernicke24. Il n’existe aucune preuve que le traitement par des médicaments antithyroïdiens (ATD) apporte un quelconque bénéfice,25 et leur utilisation est donc déconseillée.6
Exceptionnellement, l’HG avec une composante d’hyperfonctionnement thyroïdien très visible ou la GD avec une intolérance gastro-intestinale associée (nausées et vomissements) peuvent suggérer la nécessité d’un diagnostic différentiel entre elles. Le tableau 4 montre les principales différences. Dans tous les cas, si l’hyperthyroïdie dure au-delà du premier trimestre de la grossesse, une cause autre que la TGT doit être suspectée.
Différences entre la maladie de Basedow et l’hyperémèse.
| Signe | Maladie de Graves | Hyperémèse |
| Symptômes d’hyperthyroïdie avant la grossesse | ++ | – |
| Symptômes d’hyperthyroïdie pendant la grossesse. | +/++ | -/+ |
| Nausea/vomissement | -/+ | +++ |
| Goitre/ophtalmopathie | + | – |
| Anticorps anti-thyroïde | ++ | – |
| T-US | Hypervasculaire | Normal |
| Antécédents familiaux d’HG | – | + |
| Symptômes similaires lors d’une grossesse antérieure | – | + |
| T4 | ||
| T3 | ||
| Ratio TT3/TT4 | >20 |
T-US : échographie thyroïdienne ; HG : hyperemesis gravidarum.
Maladie de Graves
Parmi les maladies thyroïdiennes, la MG est la cause la plus fréquente d’hyperthyroïdie pendant la grossesse, survenant dans 0,1-1% de toutes les grossesses (hyperthyroïdie clinique et subclinique dans 0,4% et 0,6% respectivement).10
L’histoire naturelle de la MG pendant la grossesse est une exacerbation des symptômes pendant le premier trimestre due à l’effet additif de la stimulation par l’HCG du récepteur de la TSH, suivie d’une amélioration pendant la seconde moitié de la grossesse due à l’effet immunomodulateur de la grossesse, et de sa réapparition après la naissance.
Maladie de Basedow pendant la grossesse
Les symptômes de la MG active pendant la grossesse ne diffèrent pas de ceux typiques de l’affection. Certains symptômes peuvent parfois être confondus avec ceux de la grossesse elle-même. La présence éventuelle de signes oculaires et d’un goitre permet de préciser l’affection, et les dosages hormonaux permettent de poser le diagnostic.
Traitement de la maladie de Basedow pendant la grossesse
Comme on le sait, il existe trois approches thérapeutiques potentielles du DG chez les femmes non enceintes : 131I, chirurgie ou traitement médical par ATD. Parmi ces trois options, l’administration de 131I est contre-indiquée pendant la grossesse en raison du risque de malformation7, et les options sont donc limitées à la thyroïdectomie ou à l’utilisation d’ATD. En ce qui concerne la chirurgie, elle ne doit être pratiquée que dans des circonstances exceptionnelles, comme discuté ci-dessous.
Traitement médical. Médicaments antithyroïdiens
Pour le traitement médical de la GD pendant la grossesse, le Propylthiouracile (PTU) était traditionnellement considéré comme le traitement de choix par rapport au Méthimazole/Carbimazole (MM/CM) jusqu’à il y a quelques années.26 Ce concept était basé sur certaines études suggérant le transfert placentaire minimal du PTU par rapport au MM/CM27 et sur les effets tératogènes du MM/CM. On sait actuellement que les deux DTA traversent le placenta et ont donc les mêmes chances d’affecter le fœtus et de provoquer une hypothyroïdie fœtale26.
En outre, le rôle du MM/CM dans l’apparition chez le fœtus d’une aplasie cutis et d’une atrésie choanale et œsophagienne, ainsi que de quelques autres malformations globalement appelées « embryopathie du méthimazole »,28 a été très controversé,29-31 et ces malformations ont été attribuées dans certains cas aux effets néfastes de l’hyperthyroïdie elle-même. Des études récentes,32,33 montrent cependant que le MM/CM a des effets tératogènes, contrairement au PTU.
D’autre part, des rapports de cas d’hépatite toxique fulminante chez des patients traités au PTU sont apparus ces dernières années,34,35 avec des taux de prévalence allant de 0,1% à 0,5% et un taux de mortalité élevé (25-50%).10,36 Des cas d’hépatite néonatale chez des nouveau-nés nés de mères ayant été traitées au PTU ont même été rapportés.37,38
Nous sommes donc confrontés à un dilemme : d’une part, il semble clairement reconnu que le MM/CM comporte un risque de malformation, et d’autre part, que le PTU peut entraîner des complications fatales.
Face à cette alternative, certains auteurs ont recommandé un traitement par ablation avant la grossesse chez les femmes atteintes de GD.39 Cependant, cette solution résout à peine le problème, car les femmes atteintes de GD ne prévoient pas de grossesse dans la plupart des cas. D’autre part, cette mesure n’empêche pas une éventuelle hyperthyroïdie fœtale (Fhyper) due à la persistance de taux élevés d’anticorps stimulant la thyroïde (TSI), qui nécessite un traitement médical, ce qui soulève à nouveau le problème.
Pour cette raison, l’ATA a établi des critères pour l’utilisation du PTU dans la population générale et chez les femmes enceintes.40 Pour la grossesse, l’ATA déconseille l’utilisation du MM/CM au cours du premier trimestre de la grossesse (période d’organogenèse) et recommande l’utilisation du PTU. Après la 12e semaine de grossesse, le PTU doit être interrompu en raison du risque de maladie hépatique, et le contrôle de la GD doit être poursuivi avec le MM/CM. En dehors de la grossesse, l’utilisation du PTU n’est recommandée que dans deux circonstances : premièrement, en cas de crise thyroïdienne, et deuxièmement, en présence d’effets indésirables induits par le MM/CM.
Pour éviter de retarder le début du traitement par le PTU, il est conseillé aux femmes atteintes de GD qui peuvent potentiellement tomber enceintes et qui n’utilisent aucune méthode contraceptive d’avoir du PTU à disposition à la maison et d’être instruites de changer de médicament (du MM/CM au PTU) dès que la grossesse est vérifiée.
Traitement médical. Prise en charge clinique
Comme nous l’avons vu plus haut, le traitement de la GD pendant la grossesse doit consister en un traitement par PTU au cours du premier trimestre et par MM/CM par la suite. La dose initiale peut varier de 50 à 300 mg/jour de PTU en trois doses divisées, de 5 à 15 mg/jour de méthimazole ou de 10 à 15 mg/jour de carbimazole en une seule dose.6 Il faut toujours essayer d’utiliser la dose la plus faible possible.
Les bêtabloquants ne doivent être utilisés que de façon transitoire, car leur utilisation à long terme a été associée à un retard de croissance intra-utérin, à une bradycardie et à une hypoglycémie néonatale.41 De plus, certains auteurs ont rapporté une augmentation des fausses couches lors d’un traitement combiné par propranolol et ATD.42
Lorsque l’on ajuste la dose d’ATD, il faut essayer de maintenir la fonction thyroïdienne de la mère près de la limite de l’hyperfonctionnement subclinique, car la glande thyroïde du fœtus est beaucoup plus sensible à l’effet bloquant des ATD. En fait, la présence d’une TSH détectable est une indication que la dose d’ATD doit être diminuée.10,43
L’évolution de l’ATD pendant la grossesse est très dynamique, de sorte que jusqu’à 20 à 30 % des patientes atteignent un degré de contrôle permettant l’arrêt de l’ATD au cours du dernier trimestre de la grossesse.44 L’utilisation d’un schéma combiné (ATD et TH) pour le traitement de la GD est absolument contre-indiquée pendant la grossesse car elle provoque une hypothyroïdie fœtale (Fhypo).6,43
Chirurgie
En ce qui concerne le recours à la chirurgie pour contrôler la GD chez les femmes enceintes, les différents consensus et directives cliniques6,7,43 s’accordent pour ne la recommander que dans les cas suivants :
- 1
Réactions indésirables aux ATD qui empêchent leur utilisation.
- 2
La nécessité de doses élevées d’ATD.
- 3
La non-conformité du patient au traitement médical.
En outre, les directives italiennes43 recommandent également la chirurgie pour les cas de goitre maternel étendu avec compression des voies aériennes.
Si elle est effectuée, le meilleur moment pour la chirurgie est à partir du deuxième trimestre. Cela justifie l’utilisation de bêta-bloquants et d’iodure de sodium (50-100mg/jour)45 pendant une courte période (10-14 jours) chez les femmes enceintes atteintes de GD comme préparation à la chirurgie. Comme nous l’avons vu plus haut, le traitement à long terme avec des bêta-bloquants doit être évité. La prudence est également de mise lorsque de l’iodure de potassium est administré pour prévenir le développement d’un goitre et/ou d’un Fhypo.
La chirurgie entraîne un profond changement de situation. D’une part, l’hyperthyroïdie est résolue chez la femme enceinte, mais une hypothyroïdie est induite chez la mère, nécessitant un remplacement rapide et un contrôle régulier de la TSH. Les niveaux de TSI doivent également être contrôlés, et l’hyperthyroïdie fœtale doit être surveillée si nécessaire.
Changements dans l’auto-immunité thyroïdienne pendant la grossesse
Certains auteurs ont montré, au moins dans certains cas, que l’activité fonctionnelle des anticorps contre le récepteur de la TSH change d’une activité stimulante à une activité inhibitrice ou bloquante.46,47 Cela signifie que la grossesse module non seulement les niveaux d’auto-anticorps, mais aussi leur profil fonctionnel. Ce concept implique que le GD pendant la grossesse peut évoluer non seulement vers une fonction normale, mais même vers une hypofonction en raison de ce changement d’activité stimulante-bloquante, comme cela a été rapporté dans certains cas48. Autrement dit, le DG pendant la grossesse est un processus évolutif qui nécessite une surveillance régulière constante, et qui ne doit pas être négligé même lorsqu’une situation de rémission apparente ne nécessitant pas d’ATD a été atteinte.
Mesure des anticorps stimulant la thyroïde pendant la grossesse
Afin de prévenir l’impact d’éventuels auto-anticorps TSI sur la thyroïde du fœtus, l’ETA a publié en 199849 des critères établissant les indications de la mesure des TSI pendant la grossesse en fonction des caractéristiques du DG chez la mère (tableau 5).
Indications pour la mesure du TSI selon l’Association européenne de la thyroïde.
(I) Femme euthéroïde avec un DG guéri par un traitement médical avant la grossesse
– Pas de mesure
(II) Femme euthéroïde avec un DG guéri après131I ou chirurgie
– Mesurer l’IST précocement : si positif, surveiller l’hyperthyroïdie fœtale
– Mesurer le TSI au troisième trimestre (si positif au premier trimestre) : si positif, surveiller l’hyperthyroïdie néonatale
(III) Femme traitée pour une MG pendant la grossesse
– Mesurer le TSI au troisième trimestre si positif, surveiller l’hyperthyroïdie néonatale
MG : maladie de Basedow.
Source : Laurberg et al.49
Dans les cas où la MG a été guérie avant la grossesse par un traitement médical, l’état immunitaire est considéré comme résolu et la mesure de l’IST n’est pas nécessaire.
Lorsque la MG est résolue par un traitement d’ablation (chirurgie ou radiothérapie), l’état immunitaire peut persister. Les niveaux de TSI deviennent généralement négatifs 12 à 18 mois après la chirurgie. Après un traitement d’ablation à l’131I, les taux augmentent initialement au cours des premiers mois et diminuent ensuite, bien qu’ils puissent rester élevés jusqu’à cinq ans.50 Cela signifie que pour prévenir un éventuel Fhyper après l’131I, il faut maintenir une contraception à long terme. Ainsi, chez les femmes qui souhaitent concevoir et qui présentent des titres élevés de TSI, la chirurgie est préférable à l’131I. Dans tous ces cas, les taux de TSI doivent être quantifiés précocement pour évaluer le risque potentiel de Fhyper, et doivent être mesurés à nouveau au troisième trimestre pour voir s’ils continuent à être positifs et si un risque d’hyperthyroïdie néonatale existe donc.
En cas de GD active pendant la grossesse, le risque potentiel de Fhyper est contrôlé par le traitement de la mère par des ATD. Il est cependant considéré comme souhaitable de tester le TSI en fin de grossesse afin d’évaluer le risque d’hyperthyroïdie néonatale.
L’ATA6 conseille un test à environ 20-24 semaines, et énonce des recommandations beaucoup plus générales :
- –
Mère présentant une hyperthyroïdie active.
- –
Histoire de traitement par 131I.
- –
Tyroïdectomie antérieure.
- –
Nouveau-né antérieur avec hyperthyroïdie.
Maladie de Graves chez le fœtus
Il faut garder à l’esprit que la glande thyroïde fœtale atteint sa maturité à partir de la 20e semaine et qu’elle est donc capable de répondre aux mêmes influences (ATD et TSI) que la glande thyroïde adulte. Pour cette raison, on peut trouver à la fois Fhypo et Fhyper dans le cadre d’une GD pendant la grossesse.
Hypothyroïdie fœtale
Fhypo se produit généralement en raison d’un surdosage relatif en ATD, qui peut maintenir une fonction normale chez la mère, mais provoque une hypofonction claire chez le fœtus.
Signes cliniques suggestifs
L’affection peut être suspectée cliniquement sur la base d’un goitre fœtal à l’échographie obstétricale et dans le développement d’un polyhydramnios chez une femme enceinte traitée par des ATD.
La présence d’un goitre fœtal, indépendamment des aspects fonctionnels, est un signal d’alarme en raison de son effet de masse51 (Fig. 1). Il faut tenir compte du fait que l’hypertrophie de la thyroïde entraîne une hyperextension de la nuque du fœtus, ce qui nuit à la mobilité intra-utérine du fœtus et, par conséquent, entraîne une présentation anormale à la naissance (dystocie des épaules, présentation du siège, etc.). Même si cette hyperextension n’empêche pas une position céphalique adéquate du fœtus, elle empêche une flexion adéquate du cou du fœtus pour l’accouchement, provoquant une présentation de face. Toutes ces situations nécessitent la réalisation d’une césarienne. Cependant, ce n’est pas la principale complication, car la compression exercée par le goitre sur les cartilages trachéaux immatures du fœtus peut provoquer une compression trachéale et œsophagienne. Il en résulte une obstruction des voies respiratoires, avec le risque d’asphyxie que cela comporte. De plus, la compression œsophagienne entrave la déglutition du liquide amniotique, ce qui entraîne une accumulation de liquide et le développement d’un polyhydramnios. Ceci favorise la naissance prématurée, principale cause de morbidité et de mortalité néonatale.
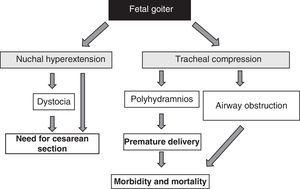
Conséquences du développement du goitre chez le fœtus.
Diagnostic
La seule procédure entièrement fiable pour confirmer une suspicion de Fhypo est la mesure des niveaux de TH fœtale par chordocentèse. Il s’agit d’une procédure qui n’est pas dénuée de complications (elle est associée à un risque de 2 % de mort fœtale52) et qui est plus complexe que la simple amniocentèse. Cependant, la mesure des taux de TH fœtaux dans le liquide amniotique n’est pas fiable et n’est pas corrélée à leur mesure dans le sang fœtal53. Il faut garder à l’esprit que des TH d’origine maternelle peuvent être retrouvés dans le liquide amniotique54. Selon les différentes directives,6,43 la chordocentèse ne doit être pratiquée que lorsqu’un goitre est détecté chez un fœtus dont la mère prend des ATD et qu’un diagnostic certain de Fhyper ou Fhypo ne peut être posé, et toujours dans un centre expérimenté.
A la place de cette approche, la mesure du composé W, résultant du métabolisme des TH fœtaux, a récemment été suggérée. Chez le fœtus, contrairement à l’adulte, le métabolisme des THs suit la voie de la sulfo-conjugaison pour former le sulfate de diiodothyronine ; ce composé est à son tour méthylé dans le placenta et la paroi utérine avant de passer dans la circulation maternelle et de former le composé W. Ce composé est retrouvé chez toutes les femmes enceintes dès le développement de la fonction thyroïdienne fœtale et augmente progressivement au cours de la grossesse pour disparaître après l’accouchement. Il a donc été proposé comme marqueur de la fonction thyroïdienne fœtale.55 Dans ce cadre, une évolution insuffisante du taux de composé W chez une femme enceinte traitée par ATD peut suggérer le développement d’un Fhypo.56 Cependant, il ne s’agit pour l’instant que d’une méthode quasi-expérimentale.
Traitement
La première mesure à prendre est l’arrêt des ATD. Cependant, en raison de la latence des effets des ATD une fois arrêtés, le remplacement des TH est également nécessaire jusqu’à la récupération complète de la glande thyroïde du fœtus. Le passage placentaire des TH est limité, et ils doivent donc être administrés par voie intra-amniotique. Cette voie, bien qu’invasive, est beaucoup plus sûre que la chordocentèse, avec un risque minime de fausse couche après la première moitié de la grossesse.57
En ce qui concerne le traitement intra-amniotique du fœtus par la T4, il n’existe pas de schéma thérapeutique établi, et les données de la littérature sont assez contradictoires.53,58,59 Une revue récente51 des cas rapportés à ce jour a conclu que la dose moyenne est d’environ 279μg de lévothyroxine une fois par semaine (pendant une à six semaines). Cela semble inverser le goitre fœtal 0,5 à 2,5 semaines après la première dose. Des mesures répétées de TH ont été effectuées dans certains cas, tandis que dans d’autres, la disparition du goitre n’a été surveillée que par échographie.
Hyperthyroïdie fœtale
L’hyper est une complication rare et peut survenir chez 1 à 2 % des bébés nés de mères ayant une GD actuelle ou antérieure, bien qu’il puisse éventuellement s’agir d’une condition sous-diagnostiquée60,61.
Le développement de Fhyper, à l’exception des très rares cas de mutations des récepteurs de la TSH,62 peut être le résultat d’un DG mal contrôlé chez une femme enceinte ou, plus fréquemment, peut survenir chez une femme enceinte ayant un DG guéri avant la grossesse par un traitement d’ablation et qui continue à avoir des niveaux élevés de TSI. Les indications pour mesurer l’IST afin de déterminer le risque de Fhyper ont déjà été discutées. Des niveaux de TSI 3 ou 5 fois supérieurs à la normale6,63 impliquent un risque de Fhyper.
Signes cliniques évocateurs
La présence d’un goitre fœtal est l’une des caractéristiques les plus précoces. On peut également observer une bradycardie fœtale, un âge osseux avancé, un retard de croissance global et une craniosynostose.64 Dans les formes plus graves, on peut observer une insuffisance cardiaque avec hydrops fœtal ou une altération de la maturation du système nerveux central avec retard mental. Un accouchement prématuré peut éventuellement se produire.65
Diagnostic
Les signes mentionnés ci-dessus ne sont pas définitifs ; la tachycardie ne se produit pas toujours, et la présence d’un goitre à l’échographie est un résultat courant avec le Fhypo. En cas de doute quant à savoir s’il s’agit d’un Fhypo dû à l’effet des ATD ou d’un Fhyper dû à un mauvais contrôle maternel, certains auteurs ont proposé un système de notation basé sur les données échographiques66 (tableau 6). Si le doute persiste, les TH fœtaux doivent être mesurés par chordocentèse, comme indiqué dans la section Fhypo. Le composé W (discuté précédemment) pourrait éventuellement être utile à cet effet dans le futur.
Score échographique pour différencier l’hyperthyroïdie de l’hypothyroïdie dans le goitre fœtal.
| Caractéristique échographique | Points |
| Fréquence cardiaque fœtale | |
| Tachycardie | 1 |
| Normale | 0 |
| Vascularisation du goitre | |
| Centrale | 1 |
| . Périphérique ou absent | 0 |
| Mouvements fœtaux | |
| Normal | 1 |
| Augmentés | 0 |
| Maturation des os maturation | |
| Accélérée | -1 |
| Normale | 0 |
| . Retardé | 1 |
| L’interprétation du score | |
| ≥2 suggère une hyperthyroïdie | |
Traitement
Le traitement doit être basé sur les DTA. Dans ce cas, contrairement au Fhypo, le traitement ne doit pas être administré par voie intra-amniotique car les ATD traversent librement le placenta. En cas de Fhyper chez une femme enceinte présentant un DG mal contrôlé, seule une adaptation du traitement chez la mère est nécessaire. En revanche, si la mère a une fonction normale grâce à un traitement d’ablation préalable, et que seul le fœtus présente une hyperfonction, le MM/CM doit être administré à la mère en commençant par des doses de 10-20mg/jour. Le traitement doit être surveillé tous les 4-5 jours en fonction de la FC du fœtus et de l’évolution du goitre afin de ne pas surdoser le fœtus et provoquer une Fhypo.10
Si la mère présente une hypothyroïdie lors de l’administration d’ATD, elle doit recevoir de la lévothyroxine, qui traverse à peine le placenta et compense donc l’hypothyroïdie sans affecter le fœtus. C’est la seule circonstance dans laquelle le schéma combiné peut être utilisé.
Maladie de Graves chez le nouveau-né
Chez les nouveau-nés, la GD pendant la grossesse peut provoquer à la fois une hyperthyroïdie et une hypothyroïdie.
Hyperthyroïdie néonatale
Elle peut survenir chez 1 à 5 % des bébés nés de femmes enceintes présentant une GD10 active et des titres élevés de TSI au cours du dernier trimestre. Le fœtus maintient une fonction normale pendant la grossesse grâce à l’effet des ATDs reçus par la mère. Les DTA ont une demi-vie de 24 à 72 heures, et après cette période, ils cessent d’agir sur la glande thyroïde du fœtus. Celle-ci devient alors exposée au TSI maternel, qui peut persister jusqu’à 12 semaines après l’accouchement.
Il apparaît alors une hyperfonction thyroïdienne, voire une insuffisance cardiaque, survenant quelques jours après l’accouchement chez un nouveau-né initialement asymptomatique.
Cette pathologie peut également survenir chez les nouveau-nés de mères ayant reçu un traitement d’ablation avant la grossesse et continuant à présenter des taux élevés de TSI, chez qui un Fhyper non diagnostiqué est apparu. Dans ces cas, l’hyperthyroïdie néonatale est une continuation de Fhyper ; les nouveau-nés présentent une atteinte sévère, un faible poids et une maturation osseuse accélérée à la naissance.
Le traitement doit consister en l’administration de MM/CM à des doses de 0,5-1mg/kg de poids corporel/jour et de propranolol 2mg/kg de poids corporel/jour36 en fonction de l’évolution clinique et en gardant à l’esprit qu’il s’agit d’une situation transitoire. Il faut noter que les IAC peuvent éventuellement modifier leur profil fonctionnel pour devenir des bloqueurs de récepteurs et développer une hypothyroïdie.
Hypothyroïdie néonatale secondaire
Chez les bébés nés de mères ayant une GD mal contrôlée, il peut être constaté que les niveaux élevés de TH auxquels ils ont été exposés pendant la grossesse ont provoqué la suppression de la sécrétion de TSH conduisant à une hypothyroïdie secondaire à la naissance67. Cette situation peut être transitoire ou définitive du fait d’une altération hypophysaire permanente de la sécrétion de TSH.
Les nouveau-nés doivent recevoir de la lévothyroxine, suivie d’une évaluation régulière jusqu’à la récupération éventuelle de la sécrétion de TSH.
On peut également observer une hypothyroïdie néonatale transitoire due à la persistance d’auto-anticorps maternels bloquant le récepteur de la TSH.68
Maladie de Graves chez les femmes du post-partum
Une GD précédemment contrôlée, avant ou après la grossesse, peut réapparaître après l’accouchement. Le taux de récidive après l’accouchement peut atteindre 84 %, contre 56 % chez les femmes sans grossesse.69 Il est donc recommandé de mesurer les TH maternelles six semaines après l’accouchement et jusqu’à un an.10
Si le DG récidive, un traitement médical par MM/CM sera nécessaire. Bien que les ATD soient sécrétés dans le lait maternel, leur administration ne comporte aucun risque pendant la lactation, et jusqu’à 20-30 mg de MM/CM peuvent être pris sans impact sur la glande thyroïde des nouveau-nés.70 Les ATD doivent être pris en doses fractionnées et toujours après la fin de la prise de lait.
Il a été suggéré que les IST dans le lait maternel pourraient atteindre la circulation générale des nouveau-nés à travers l’épithélium gastro-intestinal immature du nourrisson et provoquer ou prolonger l’hyperthyroïdie néonatale. Cependant, il n’existe pas encore de preuve concluante que cela se produise.71
Addendum
Après la soumission de ce manuscrit, la Société nord-américaine d’endocrinologie a publié de nouvelles directives de pratique clinique sur la Gestion des dysfonctionnements thyroïdiens pendant la grossesse et le post-partum (J Clin Endocrinol Metab 2012 ; 97 : 2543-2565). Les recommandations données dans la section sur l’hyperthyroïdie pendant la grossesse ne diffèrent pas substantiellement de celles discutées dans cette revue.
Conflits d’intérêts
L’auteur déclare n’avoir aucun conflit d’intérêts.