Inleiding
De prevalentie van schildklierfunctiewijzigingen bij vrouwen is zeer hoog (5/1000 voor hypothyreoïdie en 3/1000 voor hyperthyreoïdie1), en aangezien veel van deze aandoeningen zich voordoen op een vruchtbare leeftijd, is er niets vreemds aan het idee dat zwangerschap met deze ziekten in verband wordt gebracht. Bovendien, naarmate de klinische praktijk van het meten van schildklierhormoon (TH) niveaus bij zwangere vrouwen wordt uitgebreid, worden een toenemend aantal afwijkingen van de schildklierfunctie die in andere omstandigheden over het hoofd zouden zijn gezien, nu ontdekt bij zwangere vrouwen.
Aan de andere kant ondergaat de schildklierfunctie van de moeder aanzienlijke veranderingen tijdens de zwangerschap, wat leidt tot veranderingen in de verschillende laboratoriumparameters. Hierdoor moet bij zwangere vrouwen een andere aanpak worden gehanteerd dan bij niet-zwangere vrouwen bij de interpretatie van de verschillende schildklierfunctieparameters om verkeerde diagnoses en beoordelingen met mogelijk ernstige gevolgen te voorkomen.
Als gevolg van het voorgaande is er de laatste jaren belangstelling ontstaan voor de fysiologie en de mogelijke veranderingen van de schildklier tijdens de zwangerschap.2 Hiervan hebben we de aspecten in verband met hyperthyreoïdie in de zwangerschap, de uitdagingen en de mogelijke gevolgen, zowel tijdens de zwangerschap (bij de moeder en/of de foetus) als na de geboorte (bij de moeder en/of de pasgeborene) besproken.
Functionele schildklierbeoordeling tijdens de zwangerschap
Significante fysiologische veranderingen die een aanzienlijke impact hebben op de verschillende parameters van de maternale schildklierfunctie3,4 treden op tijdens de zwangerschap, waaronder de volgende:
- –
TSH. Van oudsher worden in elke zwangerschapsperiode lagere TSH-spiegels gezien dan bij niet-zwangere vrouwen,5 met minimumspiegels in het eerste trimester die vervolgens stijgen in het tweede en derde trimester. Deze veranderingen in de TSH-spiegel weerspiegelen de veranderingen in de HCG-spiegel (humaan choriongonadotrofine), die in het eerste trimester een piek vertoont en daarna geleidelijk afneemt. Daarom hebben de verschillende wetenschappelijke genootschappen normale referentiewaarden6-8 vastgesteld (tabel 1).
Tabel 1.Referentie TSH-waarden volgens verschillende genootschappen.
Samenleving TSH-spiegels (μU/ml) in zwangerschap Eerste trimester Tweede trimester Derde trimester Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spaanse Vereniging voor Endocrinologie en Voeding.
Bronnen: Stagnaro-Green e.a.,6 Abalovich e.a.7 en Galofré e.a.8
Opgemerkt moet worden dat dalingen in TSH-spiegels nog groter zijn bij meerlingzwangerschappen, en dat zwangere vrouwen die roken lagere TSH-spiegels hebben tijdens het eerste en derde trimester.9
- –
TBGT-T4. Verhoogde oestrogeenspiegels in verband met zwangerschap verhogen de TBG-spiegels en bijgevolg de TT4-waarden. De veranderingen in TT4-spiegels zijn echter zeer consistent (zij stijgen met 150%) en doen dit onafhankelijk van zowel het trimester als de gebruikte methode. Indien TT4-waarden beschikbaar zijn, kan de T4-productie bij zwangere vrouwen dus worden geschat door de referentielimieten bij niet-zwangere vrouwen met 1,5 te vermenigvuldigen.
- –
FT4. In de klinische praktijk worden de meeste metingen van vrij T4 (FT4) niet uitgevoerd met behulp van de gouden standaardevenwichtsdialyse- of ultrafiltratiemethoden. De routinematig gebruikte procedure is een immunoassaysysteem waarbij FT4 niet rechtstreeks wordt gekwantificeerd, maar geschat via een eiwitgevoelige methode (beïnvloed door TBG en albumine), en die dus sterk wordt gewijzigd door de zwangerschap, en ook varieert naargelang het trimester. Bovendien kent elke proefmethode specifieke variaties. Dit betekent dat voor een adequate interpretatie van FT4 tijdens de zwangerschap referentiewaarden beschikbaar moeten zijn die afhankelijk zijn van de zwangerschapsduur en de gebruikte methode, zoals gesteld door de American Thyroid Association (ATA).6
Invloed van hyperthyreoïdie op de moeder en de foetus
Zoals blijkt uit tabel 2, kan hyperthyreoïdie tijdens de zwangerschap ernstige gevolgen hebben voor zowel de moeder als de foetus en, na de geboorte, voor de pasgeborene.10-12 Ook moet worden opgemerkt dat onlangs een verhoogd risico op trombose, dat blijkbaar reversibel is bij controle van de hyperthyreoïdie, is gemeld bij endogene hyperthyreoïdie.13 Vanwege het verhoogde risico op diepe veneuze trombose en pulmonale trombo-embolie tijdens de zwangerschap,14 moet een hoge mate van verdenking worden gehandhaafd om een vroege opsporing van deze complicatie mogelijk te maken, en moeten mogelijk profylactische maatregelen worden overwogen.
Tabel 2.Maternale-foetale gevolgen van hyperthyreoïdie.
Maternale
Miskraam
Preeclampsie (vermenigvuldigt risico×5)7
Vroeggeboorte (vermenigvuldigt risico×10)12
Abruptio placentae
Hartfalen (vermenigvuldigt risico×20)12
Schildklierstorm (vermenigvuldigt risico×10)12
Veneuze trombose13
Foetaal
Laag laag geboortegewicht
Intra-uteriene groeivertraging
Prematuriteit
Klein voor zwangerschapsduur
Foetale sterfte
Stoornissen van de schildklier (hyperthyreoïdie of hypothyreoïdie)
Foetale struma
Neonatale
Voorbijgaande hyperthyreoïdie
Voorbijgaande of blijvende hypothyreoïdie
Bronnen: Patil-Sisodia en Mestman10 en Laurberg et al.11.Classificatie van hyperthyreoïdie tijdens de zwangerschap
Tabel 3 beschrijft de verschillende diagnostische mogelijkheden wanneer hyperthyreoïdie tijdens de zwangerschap optreedt. Enerzijds zijn er een aantal aandoeningen die rechtstreeks het gevolg zijn van de zwangerschap zelf, die kunnen worden ondergebracht onder de noemer transiënte gestationele thyrotoxicose (TGT). Anderzijds kan elke aandoening die buiten de zwangerschap tot schildklierhyperfunctie leidt, ook tijdens de zwangerschap optreden. Ten slotte kunnen verhoogde TH-niveaus ook optreden als gevolg van exogene toevoer van TH.
Tabel 3.Etiologische classificatie van hyperthyreoïdie in de zwangerschap.
Transiënte gestationele thyrotoxicose
Hyperemesis gravidarum
Meerlingzwangerschap
Trofoblastische hyperthyreoïdie (mol, choriocarcinoom)
Hyperreactio luteinalis
Familiaire gestationele thyrotoxicose
Hyperplacentose
Schildklieraandoening
Ziekte van Graves
Schildklierontsteking
Multinodulair struma
Toxisch schildklieradenoom
Iatrogeen
Overbehandeling
Onbedoelde inname van schildklierhormonen (voedselverontreiniging, enz.)
Factitious
Transientele zwangerschaps-thyrotoxicose
Dit is de meest voorkomende oorzaak van hyperthyreoïdie tijdens de zwangerschap, en kan voorkomen bij 1-3% van alle zwangerschappen.15,16 Het is gedefinieerd als een voorbijgaande hyperthyreoïdie die beperkt is tot de eerste helft van de zwangerschap en gekenmerkt wordt door verhoogde FT4 of TT4 (aangepaste) niveaus met onderdrukt of niet-detecteerbaar TSH in afwezigheid van schildklier auto-antilichamen16 of fysieke kenmerken die wijzen op de ziekte van Graves (GD).17 Dit is meestal het gevolg van verhoogde HCG niveaus of van een grotere affiniteit voor TSH receptoren.
De meest kenmerkende aandoening binnen deze groep (tabel 3) is hyperemesis gravidarum (HG), maar er zijn ook andere aandoeningen die geassocieerd worden met verhoogde HCG-spiegels, zoals meerlingzwangerschap of trofoblastische ziekte (hydatide mol of choriocarcinoom) met een TGT-prevalentie die kan oplopen tot 50%.17 Er zijn ook andere, minder vaak voorkomende oorzaken zoals hyperreactio luteinalis,18 gekenmerkt door de vorming van theca-luteïne cysten in de setting van een zwangerschap, of hyperplacentose,19 waarbij een verhoogd placentagewicht en een verhoogde HCG-productie worden gezien. Er is ook een familiaire aandoening (familial gestational thyrotoxicosis20) waarbij overgevoeligheid van de TSH-receptor voor fysiologische HCG-niveaus optreedt als gevolg van een dominante autosomale mutatie; dit wordt klinisch gekenmerkt door de ontwikkeling van TGT in alle zwangerschappen en bij alle vrouwen in de familie met normale HCG-spiegels.
Hyperemesis gravidarum
De meest voorkomende oorzaak van TGT is HG. HG komt voor bij 0,5-10/1000 van alle zwangerschappen,21 en wordt in 30-60% van de gevallen geassocieerd met verhoogde vrije TH-spiegels en TSH-suppressie.22 Opgemerkt moet worden dat het begrip HG moet worden beperkt tot aandoeningen die in het eerste trimester van de zwangerschap gepaard gaan met braken, dehydratie, verlies van ten minste 5% van het lichaamsgewicht en ketonurie.23
In deze gevallen wordt hyperthyreoïdie gekenmerkt door de onderdrukking van TSH-spiegels en minimale FT4-verhogingen, met meestal normale FT3-spiegels. De hyperfunctie van de schildklier en het daarmee gepaard gaande braken verdwijnen gewoonlijk spontaan vóór week 20, en symptomatische behandeling met intraveneuze hydratatie en vitamine B-complex is voldoende om het uitzonderlijke risico van encefalopathie van Wernicke te voorkomen.24 Er is geen bewijs dat behandeling met anti-thyroïd medicijnen (ATD) enig voordeel oplevert,25 en het gebruik ervan is daarom af te raden.6
Bij wijze van uitzondering kunnen HG met een zeer opvallende schildklierhyperfunctiecomponent of GD met geassocieerde gastro-intestinale intolerantie (misselijkheid en braken) wijzen op de noodzaak van differentiële diagnose tussen beide. Tabel 4 toont de belangrijkste verschillen. Als de hyperthyreoïdie langer duurt dan het eerste trimester van de zwangerschap, moet in elk geval een andere oorzaak dan TGT worden vermoed.
Tabel 4.Verschillen tussen de ziekte van Graves en hyperemesis.
Symptomen Ziekte van Graves Hyperemesis Symptomen van hyperthyreoïdie vóór de zwangerschap ++ – Symptomen van hyperthyreoïdie tijdens de zwangerschap +/++ -/+ Nausea/vomiting -/+ +++ Goiter/ophthalmopathie + – Antistoffen tegen schildklier ++ – T-US Hypervasculair Normaal Familiegeschiedenis van HG – + Gelijkaardige symptomen bij vorige zwangerschap – + T4 T3 TT3/TT4 verhouding >20 T-US: Echografie van de schildklier; HG: hyperemesis gravidarum.
De ziekte van Graves
Onder de schildklieraandoeningen is GD de meest voorkomende oorzaak van hyperthyreoïdie in de zwangerschap, die bij 0,1-1% van alle zwangerschappen voorkomt (klinische en subklinische hyperthyreoïdie bij respectievelijk 0,4% en 0,6%).10
De natuurlijke geschiedenis van GD tijdens de zwangerschap is een verergering van de symptomen tijdens het eerste trimester als gevolg van het additieve effect van stimulatie door HCG van de TSH-receptor, gevolgd door een verbetering tijdens de tweede helft van de zwangerschap als gevolg van het immunomodulerende effect van de zwangerschap, en het terugkeren na de geboorte.
De ziekte van Graves in de zwangerschap
De symptomen van actieve GD tijdens de zwangerschap verschillen niet van de typische symptomen van de aandoening. Sommige symptomen kunnen soms verward worden met die van de zwangerschap zelf. De eventuele aanwezigheid van oculaire verschijnselen en struma helpt de aandoening te verduidelijken, en hormoonmetingen maken de diagnose mogelijk.
Behandeling van de ziekte van Graves in de zwangerschap
Zoals bekend zijn er drie mogelijke therapeutische benaderingen van GD bij niet-zwangere vrouwen: 131I, chirurgie, of medische behandeling met ATD’s. Van deze drie opties is de toediening van 131I gecontra-indiceerd bij zwangerschap vanwege het risico op misvorming,7 en de opties zijn daarom beperkt tot thyreoïdectomie of het gebruik van ATD’s. Chirurgie mag alleen in uitzonderlijke omstandigheden worden uitgevoerd, zoals hieronder wordt besproken.
Medische behandeling. Antithyroïdica
Voor de medische behandeling van GD in de zwangerschap werd Propylthiouracil (PTU) tot enkele jaren geleden traditioneel beschouwd als de behandeling bij uitstek in vergelijking met Methimazole/Carbimazole (MM/CM).26 Dit concept was gebaseerd op enkele studies die suggereerden dat de placentatransfer van PTU minimaal was in vergelijking met MM/CM27 en op de teratogene effecten van MM/CM. Thans is bekend dat beide ATD’s de placenta passeren en derhalve evenveel kans hebben om de foetus te treffen en foetale hypothyreoïdie te veroorzaken.26
Bovendien is de rol van MM/CM in het optreden in de foetus van aplasia cutis en choanale en oesofageale atresie, samen met enkele andere misvormingen die globaal “methimazole embryopathie” worden genoemd,28 zeer controversieel geweest,29-31 en deze misvormingen zijn in sommige gevallen toegeschreven aan de schadelijke effecten van hyperthyreoïdie zelf. Recente studies,32,33 tonen echter aan dat MM/CM teratogene effecten heeft, in tegenstelling tot PTU.
Anderzijds zijn er de laatste jaren meldingen van gevallen van fulminante toxische hepatitis bij patiënten die met PTU werden behandeld,34,35 met prevalentiecijfers variërend van 0,1% tot 0,5% en een hoog sterftecijfer (25-50%).10,36 Er zijn zelfs gevallen van neonatale hepatitis gemeld bij pasgeborenen van moeders die met PTU waren behandeld.37,38
We staan dus voor een dilemma: enerzijds lijkt het duidelijk erkend dat MM/CM een risico op misvorming inhoudt, en anderzijds dat PTU fatale complicaties kan veroorzaken.
Voor dit alternatief hebben sommige auteurs ablatietherapie aanbevolen vóór de zwangerschap bij vrouwen met GD.39 Deze oplossing lost het probleem echter nauwelijks op, omdat vrouwen met GD in de meeste gevallen geen zwangerschap plannen. Anderzijds voorkomt deze maatregel niet dat er uiteindelijk foetale hyperthyreoïdie (Fhyper) optreedt als gevolg van de persistentie van hoge niveaus van thyroïd-stimulerende antilichamen (TSI), die medische behandeling vereisen, waardoor het probleem opnieuw de kop opsteekt.
Om deze reden heeft de ATA criteria opgesteld voor het gebruik van PTU in de algemene bevolking en bij zwangere vrouwen.40 Voor de zwangerschap raadt de ATA het gebruik van MM/CM in het eerste trimester van de zwangerschap (de organogenese periode) af en beveelt het gebruik van PTU aan. Na week 12 van de zwangerschap moet PTU worden gestaakt vanwege het risico op leveraandoeningen, en moet de GD-controle worden voortgezet met MM/CM. Buiten de zwangerschap wordt het gebruik van PTU slechts in twee omstandigheden aanbevolen: ten eerste, als schildklierstorm optreedt, en ten tweede, in aanwezigheid van bijwerkingen geïnduceerd door MM/CM.
Om vertraging van de start van de behandeling met PTU te voorkomen, is het raadzaam dat vrouwen met GD die mogelijk zwanger kunnen worden en die geen anticonceptiemethode gebruiken, PTU thuis beschikbaar hebben en geïnstrueerd worden om van medicatie te wisselen (van MM/CM naar PTU) zodra zwangerschap wordt geverifieerd.
Medische behandeling. Klinische behandeling
Zoals hierboven besproken, moet de behandeling van GD tijdens de zwangerschap bestaan uit PTU in het eerste trimester en MM/CM daarna. De startdosis kan variëren van 50 tot 300mg/dag PTU in drie verdeelde doses, 5 tot 15mg/dag methimazol, of 10 tot 15mg/dag carbimazol als eenmalige dosis.6 Er moet altijd worden geprobeerd de laagst mogelijke dosis te gebruiken.
Bètablokkers mogen alleen tijdelijk worden gebruikt, omdat het gebruik ervan op lange termijn in verband is gebracht met intra-uteriene groeivertraging, bradycardie en neonatale hypoglykemie.41 Bovendien hebben sommige auteurs een verhoogde miskraam gerapporteerd met een gecombineerde propranolol- en ATD-behandeling.42
Bij het aanpassen van de ATD-dosis moet worden geprobeerd om de schildklierfunctie van de moeder in de buurt van de grens van subklinische hyperfunctie te houden, omdat de foetale schildklier veel gevoeliger is voor het blokkerende effect van ATD’s. In feite is de aanwezigheid van detecteerbaar TSH een indicatie dat de ATD-dosis moet worden verlaagd.10,43
GD tijdens de zwangerschap vertoont een zeer dynamisch verloop, zodat tot 20%-30% van de patiënten een mate van controle bereikt die stopzetting van de ATD in het laatste trimester van de zwangerschap mogelijk maakt.44 Het gebruik van een gecombineerd schema (ATD’s en TH’s) voor de behandeling van GD is absoluut gecontra-indiceerd in de zwangerschap omdat het foetale hypothyreoïdie (Fhypo) veroorzaakt.6,43
chirurgie
Wat betreft het gebruik van chirurgie voor de controle van GD bij zwangere vrouwen, zijn de verschillende consensussen en klinische richtlijnen6,7,43 het erover eens dat dit alleen wordt aanbevolen als het volgende zich voordoet:
- 1
Gewenste reacties op ATD’s die het gebruik ervan verhinderen.
- 2
De noodzaak van hoge ATD doses.
- 3
De patiënt houdt zich niet aan de medische behandeling.
Daarnaast bevelen Italiaanse richtlijnen43 ook chirurgie aan in gevallen van uitgebreide maternale goiter met luchtwegcompressie.
Indien uitgevoerd, is de beste tijd voor chirurgie vanaf het tweede trimester. Dit rechtvaardigt het gebruik van bètablokkers en natriumjodide (50-100mg/dag)45 gedurende een korte periode (10-14 dagen) bij zwangere vrouwen met GD als voorbereiding op de operatie. Zoals hierboven besproken, moet langdurige behandeling met bètablokkers worden vermeden. Voorzichtigheid is ook geboden wanneer kaliumjodide wordt toegediend om de ontwikkeling van struma en/of Fhypo te voorkomen.
Een operatie veroorzaakt een ingrijpende verandering in de situatie. Enerzijds wordt hyperthyreoïdie opgelost bij zwangere vrouwen, maar hypothyreoïdie wordt geïnduceerd bij de moeder, wat snelle vervanging en regelmatige controle van TSH vereist. TSI-niveaus moeten ook worden gecontroleerd, en foetale hyperthyreoïdie moet indien nodig worden gecontroleerd.
Verschuivingen in schildklierauto-immuniteit tijdens zwangerschap
Enkele auteurs hebben aangetoond, althans in sommige gevallen, dat de functionele activiteit van antilichamen tegen de TSH-receptor verandert van een stimulerende naar een remmende of blokkerende activiteit.46,47 Dit betekent dat zwangerschap niet alleen de auto-antilichaamniveaus wijzigt, maar ook hun functionele profiel. Dit concept impliceert dat GD in de zwangerschap niet alleen kan evolueren naar een normale functie, maar zelfs naar een hypofunctie als gevolg van deze verandering in stimulerende-blokkerende activiteit, zoals in sommige gevallen werd gerapporteerd.48 Dat wil zeggen dat GD in de zwangerschap een veranderlijk proces is dat een voortdurende regelmatige controle vereist, en dat niet mag worden verwaarloosd, zelfs wanneer een situatie van schijnbare remissie is bereikt waarbij geen ATD’s nodig zijn.
Meting van schildklierstimulerende antilichamen in de zwangerschap
Om de invloed van mogelijke TSI-autoantilichamen op de foetale schildklier te voorkomen, heeft de ETA in 199849 criteria gepubliceerd waarin de indicaties voor TSI-meting in de zwangerschap worden vastgesteld, afhankelijk van de kenmerken van GD bij de moeder (tabel 5).
Tabel 5.Indicaties voor de meting van TSI volgens de European Thyroid Association.
(I) Euthyroïde vrouw met GD genezen met medische behandeling vóór de zwangerschap
– Geen meting
(II) Euthyroïde vrouw met GD genezen na131I of operatie
– TSI vroegtijdig meten: indien positief, controleer foetale hyperthyreoïdie
– Meet TSI in het derde trimester (indien positief in het eerste trimester): indien positief, controleer neonatale hyperthyreoïdie
(III) Vrouw behandeld voor GD tijdens zwangerschap
– Meet TSI in het derde trimester indien positief, controleer neonatale hyperthyreoïdie
GD: ziekte van Graves.
Bron: Laurberg et al.49
In gevallen waarin GD vóór de zwangerschap met medische behandeling is genezen, wordt de immuuntoestand als opgelost beschouwd en is TSI-meting niet nodig.
Wanneer GD met ablatie-therapie (chirurgie of radiotherapie) is opgelost, kan de immuuntoestand blijven bestaan. TSI-niveaus worden gewoonlijk 12-18 maanden na de operatie negatief. Na 131I-ablatietherapie stijgen de spiegels aanvankelijk in de eerste maanden en dalen vervolgens, hoewel ze tot vijf jaar lang hoog kunnen blijven.50 Dit betekent dat, om potentiële Fyper na 131I te voorkomen, langdurige anticonceptie moet worden gehandhaafd. Bij vrouwen die zwanger willen worden en hoge TSI-titers hebben, wordt dus de voorkeur gegeven aan chirurgie boven 131I. In al deze gevallen moeten de TSI-spiegels vroegtijdig worden gekwantificeerd om het potentiële risico van HF te beoordelen, en moeten ze in het derde trimester opnieuw worden gemeten om te zien of ze positief blijven en of er dus een risico van neonatale hyperthyreoïdie bestaat.
In geval van actieve GD tijdens de zwangerschap wordt het potentiële risico van Fhyper onder controle gehouden door behandeling van de moeder met ATD’s. Het wordt echter raadzaam geacht TSI aan het eind van de zwangerschap te testen om het risico van neonatale hyperthyreoïdie te beoordelen.
De ATA6 adviseert te testen bij ongeveer 20-24 weken, en geeft veel algemenere aanbevelingen:
- –
Moeder met actieve hyperthyreoïdie.
- –
Geschiedenis van behandeling met 131I.
- –
Prior thyreoidectomie.
- –
Prior pasgeborene met hyperthyreoïdie.
Gravesziekte bij de foetus
Er moet rekening mee worden gehouden dat de foetale schildklier vanaf week 20 tot rijpheid komt en dus op dezelfde invloeden (ATD’s en TSI) kan reageren als de volwassen schildklier. Daarom kunnen zowel Fhypo als Fhyper worden aangetroffen in de setting van GD in de zwangerschap.
Foetale hypothyreoïdie
Fhypo treedt meestal op als gevolg van een relatieve ATD-overdosering, die de normale functie bij de moeder in stand kan houden, maar een duidelijke hypofunctie bij de foetus veroorzaakt.
Suggestieve klinische verschijnselen
De aandoening kan klinisch worden vermoed op basis van foetale goiter bij obstetrische echografie en bij de ontwikkeling van polyhydramnios bij een zwangere vrouw die met ATD’s wordt behandeld.
De aanwezigheid van foetale goiter, ongeacht de functionele aspecten, is een alarmsignaal vanwege het massa-effect51 (Fig. 1). Men moet er rekening mee houden dat een vergroting van de schildklier hyperextensie van de achterkant van de nek van de foetus veroorzaakt, wat op zijn beurt de intra-uteriene beweeglijkheid van de foetus belemmert en, bijgevolg, leidt tot een abnormale presentatie bij de geboorte (schouderdystocie, stuitligging, enz.). Zelfs als deze hyperextensie een adequate cephalische positie van de foetus niet verhindert, verhindert zij een adequate flexie van de foetale hals voor de bevalling, wat een presentatie in het gezicht veroorzaakt. Al deze situaties vereisen de uitvoering van een keizersnede. Dit is echter niet de belangrijkste complicatie, aangezien de compressie die door de struma op het onrijpe tracheale kraakbeen van de foetus wordt uitgeoefend, compressie van de trachea en de slokdarm kan veroorzaken. Dit leidt tot obstructie van de luchtwegen, met het daarmee gepaard gaande risico van asfyxie. Bovendien belemmert slokdarmcompressie het inslikken van vruchtwater, wat leidt tot vochtophoping en de ontwikkeling van polyhydramnios. Dit bevordert vroeggeboorte, de belangrijkste oorzaak van neonatale morbiditeit en mortaliteit.
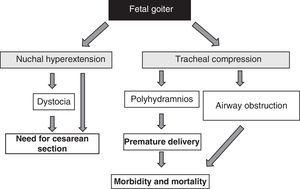 Figuur 1.
Figuur 1.Gevolgen van de ontwikkeling van struma bij de foetus.
(0.1MB).Diagnose
De enige volledig betrouwbare procedure voor de bevestiging van een vermoeden van Fhypo is de meting van het foetale TH-gehalte met behulp van een chordocentese. Deze procedure is niet vrij van complicaties (er is een risico van 2% op foetale sterfte52) en is complexer dan een eenvoudige vruchtwaterpunctie. De meting van het foetale TH-gehalte in vruchtwater is echter niet betrouwbaar en correleert niet met de meting in foetaal bloed.53 Er moet rekening mee worden gehouden dat in vruchtwater ook TH’s van maternale oorsprong kunnen worden aangetroffen.54 Volgens de verschillende richtlijnen,6,43 moet een chordocentese alleen worden uitgevoerd wanneer bij een foetus bij wie de moeder ATD’s inneemt, een struma wordt vastgesteld en de diagnose Fhyper of Fhypo niet met zekerheid kan worden gesteld, en altijd in een ervaren centrum.
In plaats van deze aanpak is onlangs de meting van verbinding W, die het resultaat is van het metabolisme van foetale TH’s, gesuggereerd. In de foetus verloopt het metabolisme van TH’s, anders dan bij volwassenen, via de sulfo-conjugatie-route om diiodothyroninesulfaat te vormen; deze verbinding wordt op haar beurt in de placenta en de baarmoederwand gemethyleerd alvorens in de circulatie van de moeder over te gaan en verbinding W te vormen. Deze verbinding wordt bij alle zwangere vrouwen aangetroffen vanaf de ontwikkeling van de foetale schildklierfunctie en neemt tijdens de zwangerschap geleidelijk toe, waarna zij na de bevalling verdwijnt. Het is daarom voorgesteld als een marker van de foetale schildklierfunctie.55 In deze setting kan een onvoldoende progressie van het gehalte aan verbinding W bij een zwangere vrouw die met ATD’s wordt behandeld, wijzen op de ontwikkeling van Fhypo.56 Voorlopig is dit echter niet meer dan een quasi-experimentele methode.
Behandeling
De eerste maatregel die moet worden genomen, is het staken van ATD’s. Wegens de latentie van de ATD-effecten na stopzetting is echter ook vervanging van TH nodig totdat de schildklier van de foetus zich volledig heeft hersteld. De placentale passage van TH’s is beperkt, en zij moeten daarom worden toegediend via de intra-amniotische route. Deze route is, hoewel invasief, veel veiliger dan chordocentese, met een minimaal risico op miskraam na de eerste helft van de zwangerschap.57
Wat betreft intra-amniotische behandeling van de foetus met T4, is er geen vastgesteld behandelingsschema, en de literatuurgegevens zijn nogal tegenstrijdig.53,58,59 Een recente review51 van tot nu toe gerapporteerde gevallen concludeerde dat de gemiddelde dosis ongeveer 279μg levothyroxine eenmaal per week is (gedurende één tot zes weken). Dit lijkt foetaal struma 0,5-2,5 week na de eerste dosis om te keren. Herhaalde TH-metingen werden in sommige gevallen uitgevoerd, terwijl in andere gevallen het verdwijnen van de struma alleen werd gecontroleerd door middel van echografie.
Foetale hyperthyreoïdie
Fyper is een zeldzame complicatie en kan voorkomen bij maximaal 1-2% van de baby’s geboren uit moeders met huidige of eerdere GD, hoewel het mogelijk een ondergediagnosticeerde aandoening is.60,61
De ontwikkeling van Fhyper kan, met uitzondering van de zeer zeldzame gevallen van TSH-receptormutaties,62 het gevolg zijn van slecht gecontroleerde GD bij een zwangere vrouw of, wat vaker voorkomt, ontstaan bij een zwangere vrouw met GD die voor de zwangerschap is genezen met ablatietherapie en die hoge TSI-spiegels blijft hebben. De indicaties voor het meten van TSI om het risico op Fhyper vast te stellen zijn reeds besproken. TSI-spiegels die 3 tot 5 maal hoger zijn dan normaal6,63 brengen een risico op Fhyper met zich mee.
Suggestieve klinische verschijnselen
Het optreden van foetale goiter is een van de vroegste kenmerken. Foetale bradycardie, gevorderde botleeftijd, algehele groeiachterstand en craniosynostose kunnen ook worden gezien.64 In ernstiger vormen kan hartfalen met foetale hydrops of verminderde rijping van het centrale zenuwstelsel met mentale retardatie optreden. Uiteindelijk kan een premature bevalling optreden.65
Diagnose
De bovengenoemde verschijnselen zijn niet definitief; tachycardie komt niet altijd voor, en de aanwezigheid van struma bij echografie is een veel voorkomende bevinding bij Fhypo. Bij twijfel of de aandoening Fhypo is ten gevolge van het effect van ATD’s of Fhyper ten gevolge van slechte maternale controle, hebben sommige auteurs een scoringssysteem voorgesteld op basis van echografische gegevens66 (tabel 6). Bij blijvende twijfel moeten de foetale TH’s worden gemeten met behulp van chordocentese, zoals vermeld in het hoofdstuk Fhypo. Compound W (eerder besproken) kan hiervoor in de toekomst mogelijk nuttig zijn.
Tabel 6.Ultrasound scoring om hyperthyreoïdie van hypothyreoïdie te onderscheiden bij foetale struma.
Ultrasound kenmerk Punten Foetale hartslag Tachycardie 1 Normaal 0 Goiter vascularization Centraal 1 Perifeer of afwezig 0 Foetale bewegingen Normaal 1 Verhoogd 0 Botontwikkeling >
rijping Versneld -1 Normaal 0 Vertraagd 1 Score interpretatie ≥2 suggereert hyperthyreoïdie Aangepast van Huel et al.66Behandeling
Behandeling moet gebaseerd zijn op ATD’s. In dit geval moet de behandeling, anders dan bij Fhypo, niet via de intra-amnionale route worden toegediend omdat ATD’s vrij de placenta passeren. In het geval van Fhyper bij een zwangere vrouw met een slecht gecontroleerde GD is alleen een aanpassing van de behandeling bij de moeder nodig. Als de moeder daarentegen een normale functie heeft dankzij een eerdere ablatietherapie, en alleen de foetus een hyperfunctie vertoont, moet MM/CM aan de moeder worden toegediend, te beginnen met doses van 10-20mg/dag. De behandeling moet om de 4-5 dagen worden gecontroleerd op basis van de foetale HR en het verloop van de struma om de foetus niet te overdoseren en Fhypo te veroorzaken.10
Als de moeder hypothyreoïdie ervaart wanneer ATD’s worden toegediend, moet zij levothyroxine krijgen, dat nauwelijks de placenta passeert en daarom de hypothyreoïdie compenseert zonder de foetus te beïnvloeden. Dit is de enige omstandigheid waarin het gecombineerde schema kan worden toegepast.
Gravesziekte bij de pasgeborene
Bij pasgeborenen kan GD tijdens de zwangerschap zowel hyperthyreoïdie als hypothyreoïdie veroorzaken.
Neonatale hyperthyreoïdie
Dit kan voorkomen bij 1-5% van de baby’s geboren bij zwangere vrouwen met actieve GD10 en hoge TSI-titers in het laatste trimester. De foetus behoudt zijn normale functie tijdens de zwangerschap dankzij het effect van de ATD’s die de moeder heeft ontvangen. ATD’s hebben een halfwaardetijd van 24-72 uur, en na deze periode houdt de werking op de foetale schildklier op. Deze wordt blootgesteld aan TSI van de moeder, die tot 12 weken na de bevalling kan aanhouden.
Hyroïde hyperfunctie en zelfs hartfalen, die enkele dagen na de bevalling optreden bij een aanvankelijk asymptomatische pasgeborene, zijn het gevolg.
Deze aandoening kan ook optreden bij pasgeborenen van moeders die vóór de zwangerschap een ablatietherapie hebben ondergaan en verhoogde TSI-niveaus blijven vertonen, bij wie ongediagnosticeerde Fhyper is opgetreden. In deze gevallen is neonatale hyperthyreoïdie een voortzetting van Fhyper; pasgeborenen vertonen ernstige betrokkenheid, een laag gewicht en versnelde botrijping bij de geboorte.
De behandeling moet bestaan uit de toediening van MM/CM in doses van 0,5-1mg/kg lichaamsgewicht/dag en propranolol 2mg/kg lichaamsgewicht/dag36 , afhankelijk van het klinische beloop en in gedachten houdend dat dit een voorbijgaande situatie is. Opgemerkt moet worden dat TSI’s uiteindelijk hun functionele profiel kunnen veranderen in receptorblokkers en hypothyreoïdie kunnen ontwikkelen.
Secundaire neonatale hypothyreoïdie
Bij baby’s die geboren zijn uit moeders met een slecht gecontroleerde GD, kan blijken dat verhoogde niveaus van TH’s waaraan zij tijdens de zwangerschap zijn blootgesteld, de onderdrukking van de TSH-secretie hebben veroorzaakt, wat bij de geboorte tot secundaire hypothyreoïdie leidt.67 Deze situatie kan van voorbijgaande aard zijn of definitief als gevolg van een permanente hypofysestoornis in de TSH-secretie.
Newborns should be administered levothyroxine, followed by regular assessment until the eventual recovery of TSH secretion.
Transient neonatal hypothyroidism due to the persistence of maternal autoantibodies blocking the RSH receptor may also be seen.68
Graves-ziekte bij postpartumvrouwen
Voorheen gecontroleerde GD, hetzij voor of na de zwangerschap, kan na de bevalling terugkomen. Het recidiefpercentage na de bevalling kan oplopen tot 84%, vergeleken met 56% bij vrouwen zonder zwangerschap.69 Daarom wordt aanbevolen de maternale TH’s zes weken na de bevalling en tot één jaar na de bevalling te meten.10
Als GD opnieuw optreedt, zal medische behandeling met MM/CM nodig zijn. Hoewel ATD’s in de moedermelk worden uitgescheiden, houdt de toediening ervan tijdens de lactatie geen risico in en kan tot 20-30 mg MM/CM worden ingenomen zonder gevolgen voor de schildklier van pasgeborenen.70 ATD’s moeten in verdeelde doses worden ingenomen en altijd na het einde van de melkinname.
Er is gesuggereerd dat TSI in moedermelk de algemene circulatie van pasgeborenen zou kunnen bereiken via het onrijpe maag-darmepitheel van de zuigeling en neonatale hyperthyreoïdie zou kunnen veroorzaken of verlengen. Er is echter nog geen afdoend bewijs dat dit zich voordoet.71
Addendum
Na het indienen van dit manuscript heeft de North American Society of Endocrinology nieuwe richtlijnen voor de klinische praktijk uitgebracht over het beheer van schildklierdisfunctie tijdens de zwangerschap en postpartum (J Clin Endocrinol Metab 2012; 97: 2543-2565). De aanbevelingen die in het hoofdstuk over hyperthyreoïdie in de zwangerschap worden gegeven, verschillen niet wezenlijk van de aanbevelingen die in deze review worden besproken.
Belangenconflicten
De auteur verklaart dat hij geen belangenconflicten heeft.
- –