Introducción
La prevalencia de las alteraciones de la función tiroidea en la mujer es muy elevada (5/1000 para el hipotiroidismo y 3/1000 para el hipertiroidismo1), y dado que muchas de estas afecciones se producen en edad fértil, no es nada extraña la idea de que el embarazo se asocie a estas enfermedades. Además, a medida que se extiende la práctica clínica de medir los niveles de la hormona tiroidea (TH) en las mujeres embarazadas, se está detectando en ellas un número cada vez mayor de anomalías de la función tiroidea que se habrían pasado por alto en otras circunstancias.
Por otra parte, la función tiroidea materna experimenta cambios significativos durante el embarazo, lo que da lugar a cambios en los diferentes parámetros de laboratorio. Por ello, en la interpretación de los diferentes parámetros de la función tiroidea debe utilizarse un enfoque diferente en las mujeres embarazadas que en las no embarazadas, con el fin de evitar diagnósticos y valoraciones erróneas con consecuencias potencialmente graves.
Como consecuencia de lo anterior, en los últimos años ha surgido un interés por la fisiología y los posibles cambios de la glándula tiroidea durante el embarazo.2 Entre ellos, hemos revisado los aspectos relacionados con el hipertiroidismo en el embarazo, sus retos y sus potenciales consecuencias, tanto durante la gestación (en la madre y/o en el feto) como después del parto (en la madre y/o en el recién nacido).
Evaluación de la función tiroidea durante el embarazo
Durante la gestación se producen importantes cambios fisiológicos que repercuten considerablemente en los diferentes parámetros de la función tiroidea materna3,4, entre los que destacan los siguientes:
- –
TSH. Tradicionalmente se ha observado una disminución de los niveles de TSH en cualquier periodo del embarazo en comparación con los niveles encontrados en mujeres no embarazadas,5 con niveles mínimos en el primer trimestre que posteriormente aumentan en el segundo y tercer trimestre. Estos cambios en los niveles de TSH reflejan los cambios en los niveles de gonadotropina coriónica humana (HCG), que alcanzan su máximo en el primer trimestre y disminuyen gradualmente después. Por ello, las diferentes sociedades científicas han establecido valores normales de referencia6-8 (Tabla 1).
Tabla 1.Valores de referencia de TSH según diferentes sociedades.
Sociedad Niveles de TSH (μU/ml) en el embarazo Primer trimestre Segundo trimestre Tercer trimestre Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Sociedad Española de Endocrinología y Nutrición.
Fuentes: Stagnaro-Green y cols,6 Abalovich y cols.7 y Galofré y cols.8
Hay que tener en cuenta que los descensos en los niveles de TSH son aún mayores en los embarazos múltiples, y que las mujeres embarazadas que fuman tienen niveles más bajos de TSH durante el primer y tercer trimestre.9
- –
TBGT-T4. El aumento de los niveles de estrógeno asociado al embarazo incrementa los niveles de TBG y, en consecuencia, los valores de TT4. Sin embargo, los cambios en los niveles de TT4 son muy consistentes (aumentan en un 150%) y lo hacen independientemente tanto del trimestre como del método utilizado. Así, si se dispone de los niveles de TT4, la producción de T4 por parte de las mujeres embarazadas puede estimarse multiplicando por 1,5 los límites de referencia en las mujeres no embarazadas.
- –
FT4. En la práctica clínica, la mayoría de las mediciones de T4 libre (FT4) no se realizan utilizando los métodos de diálisis de equilibrio o de ultrafiltración, que son el patrón de oro. El procedimiento que se utiliza de forma rutinaria es un sistema de inmunoensayo en el que la FT4 no es un valor cuantificado directamente, sino que se estima a través de un método sensible a las proteínas (influenciado por la TBG y la albúmina), y que por lo tanto se ve fuertemente modificado por el embarazo, y también varía en función del trimestre. Además, cada método de ensayo tiene variaciones específicas. Esto significa que, para una adecuada interpretación de la FT4 durante el embarazo, se debe disponer de valores de referencia en función de la edad gestacional y del método utilizado, tal y como indica la American Thyroid Association (ATA).6
Impacto del hipertiroidismo en la madre y el feto
Como se muestra en la tabla 2, el hipertiroidismo durante el embarazo puede tener graves consecuencias tanto para la madre como para el feto y, tras el nacimiento, para el recién nacido.10-12 También hay que tener en cuenta que recientemente se ha informado de un mayor riesgo de trombosis, aparentemente reversible con el control del hipertiroidismo, en el hipertiroidismo endógeno.13 Debido al mayor riesgo de trombosis venosa profunda y tromboembolismo pulmonar durante el embarazo,14 debe mantenerse un alto nivel de sospecha para permitir la detección precoz de esta complicación, y puede ser necesario considerar medidas profilácticas.
Impacto materno-fetal del hipertiroidismo.
Aborto espontáneo materno
Preeclampsia (multiplica el riesgo×5)7
Parto prematuro (multiplica el riesgo×10)12
. Desprendimiento de placenta
Insuficiencia cardíaca (multiplica el riesgo×20)12
Tormenta tiroidea (multiplica el riesgo×10)12
Trombosis venosa13
Feto
Bajo peso al nacer
Retraso del crecimiento intrauterino
Prematuridad
Pequeño para la edad gestacional
Muerte fetal
Disfunción tiroidea (hipertiroidismo o hipotiroidismo)
Bocio fetal
Hipertiroidismo transitorio
Hipotiroidismo transitorio o permanente
Clasificación del hipertiroidismo durante el embarazo
En la tabla 3 se describen las diferentes posibilidades diagnósticas cuando se produce hipertiroidismo durante el embarazo. Por un lado, hay una serie de afecciones directamente derivadas del propio embarazo, que pueden englobarse bajo el epígrafe de tirotoxicosis gestacional transitoria (TGT). Por otro lado, cualquier condición que conduzca a una hiperfunción tiroidea fuera del embarazo también puede ocurrir durante el mismo. Por último, el aumento de los niveles de TH también puede producirse debido al suministro exógeno de TH.
Clasificación etiológica del hipertiroidismo en el embarazo.
Tirotoxicosis gestacional transitoria
Hiperémesis gravídica
Embarazo múltiple
Hipertiroidismo trofoblástico (mola, coriocarcinoma)
Hiperreactio luteinalis
Tirotoxicosis gestacional familiar
Hiperplacentosis
Enfermedad tiroidea
Enfermedad de Graves
Tiroiditis
Bocio multinodular
Adenoma tiroideo tóxico
Iatrogénico
Sobretratamiento
Ingesta inadvertida de hormonas tiroideas (contaminación alimentaria, etc.)
Facticia
Tirotoxicosis gestacional transitoria
Es la causa más común de hipertiroidismo durante el embarazo, y puede ocurrir en el 1-3% de todos los embarazos.15,16 Se ha definido como un hipertiroidismo transitorio que se limita a la primera mitad del embarazo y que se caracteriza por un aumento de los niveles de FT4 o TT4 (ajustados) con TSH suprimida o indetectable en ausencia de autoanticuerpos tiroideos16 o de rasgos físicos que sugieran una enfermedad de Graves (EG).17 Suele ser el resultado de un aumento de los niveles de GCH o de una mayor afinidad por los receptores de TSH.
La afección más característica dentro de este grupo (Tabla 3) es la hiperémesis gravídica (HG), pero hay otras afecciones que también se asocian a un aumento de los niveles de GCH como el embarazo múltiple o la enfermedad trofoblástica (mola hidatídica o coriocarcinoma) con una prevalencia de TGT de hasta el 50%.17 También existen otras causas menos comunes como la hiperreactio luteinalis,18 caracterizada por la formación de quistes de teca-luteína en el marco del embarazo, o la hiperplacentosis,19 donde se observa un aumento del peso de la placenta y de la producción de HCG. También existe una afección familiar (tirotoxicosis gestacional familiar20) en la que se produce una hipersensibilidad del receptor de TSH a los niveles fisiológicos de HCG debido a una mutación autosómica dominante; esto se caracteriza clínicamente por el desarrollo de TGT en todos los embarazos y en todas las mujeres de la familia con niveles normales de HCG.
Hiperémesis gravídica
La causa más común de TGT es la HG. La HG se produce en el 0,5-10/1000 de todos los embarazos,21 y se asocia a un aumento de los niveles de TH libre y a la supresión de la TSH en el 30-60% de los casos.22 Debe tenerse en cuenta que el concepto de HG debe restringirse a las condiciones asociadas en el primer trimestre del embarazo con vómitos, deshidratación, pérdida de al menos el 5% del peso corporal y cetonuria.23
En estos casos, el hipertiroidismo se caracteriza por la supresión de los niveles de TSH y el aumento mínimo de la FT4, con niveles comúnmente normales de FT3. La hiperfunción tiroidea, así como los vómitos asociados, suelen resolverse espontáneamente antes de la semana 20, y el tratamiento sintomático con hidratación intravenosa y complejo de vitamina B es suficiente para prevenir el riesgo excepcional de encefalopatía de Wernicke.24 No hay pruebas de que el tratamiento con fármacos antitiroideos (ATD) aporte ningún beneficio25, por lo que su uso está desaconsejado.6
Excepcionalmente, la HG con un componente de hiperfunción tiroidea muy llamativo o la EG con intolerancia gastrointestinal asociada (náuseas y vómitos) pueden sugerir la necesidad de un diagnóstico diferencial entre ambas. La tabla 4 muestra las principales diferencias. En cualquier caso, si el hipertiroidismo se prolonga más allá del primer trimestre del embarazo, debe sospecharse una causa distinta a la TGT.
Diferencias entre enfermedad de Graves e hiperémesis.
| Signo | Enfermedad de Graves | Hiperémesis |
| Síntomas de hipertiroidismo antes del embarazo | ++ | – |
| Síntomas de hipertiroidismo durante el embarazo | +/++ | -/+ |
| Náuseas/vómitos | -/+ | +++ |
| Bitre/ftalmopatía | + | – |
| Anticuerpos tiroideos | ++ | – |
| T-US | Hipervascular | Normal |
| Antecedentes familiares de HG | – | + |
| Síntomas similares en un embarazo anterior | – | + |
| T4 | ||
| T3 | ||
| Relación TT3/TT4 | >20 |
T-US: ecografía tiroidea; HG: hiperémesis gravídica.
Enfermedad de Graves
Entre las enfermedades tiroideas, la EG es la causa más común de hipertiroidismo en el embarazo, ocurriendo en el 0,1-1% de todos los embarazos (hipertiroidismo clínico y subclínico en el 0,4% y 0,6% respectivamente).10
La historia natural de la EG durante el embarazo es una exacerbación de los síntomas durante el primer trimestre debido al efecto aditivo de la estimulación por la HCG del receptor de la TSH, seguida de una mejoría durante la segunda mitad del embarazo debido al efecto inmunomodulador del mismo, y su reaparición tras el parto.
La enfermedad de Graves en el embarazo
Los síntomas de la EG activa en el embarazo no difieren de los típicos de la enfermedad. Algunos síntomas pueden confundirse a veces con los del propio embarazo. La posible presencia de signos oculares y bocio ayuda a clarificar la afección, y las mediciones hormonales permiten el diagnóstico.
Tratamiento de la enfermedad de Graves en el embarazo
Como es bien sabido, existen tres enfoques terapéuticos potenciales para la EG en mujeres no embarazadas: 131I, cirugía o tratamiento médico con TCA. De estas tres opciones, la administración de 131I está contraindicada en el embarazo por el riesgo de malformaciones,7 por lo que las opciones se limitan a la tiroidectomía o al uso de TCA. En cuanto a la cirugía, sólo debe realizarse en circunstancias excepcionales, como se comenta más adelante.
Tratamiento médico. Fármacos antitiroideos
Para el tratamiento médico de la EG en el embarazo, el propiltiouracilo (PTU) se consideraba tradicionalmente como el tratamiento de elección frente al metimazol/carbimazol (MM/CM) hasta hace unos años.26 Este concepto se basaba en algunos estudios que sugerían la mínima transferencia placentaria del PTU frente al MM/CM27 y en los efectos teratogénicos del MM/CM. Actualmente se sabe que ambos TCA atraviesan la placenta y tienen, por tanto, la misma posibilidad de afectar al feto y causar hipotiroidismo fetal26.
Además, el papel del MM/CM en la aparición en el feto de aplasia cutis y atresia coanal y esofágica, junto con algunas otras malformaciones denominadas globalmente «embriopatía por metimazol»,28 ha sido muy controvertido,29-31 y estas malformaciones se han atribuido en algunos casos a los efectos nocivos del propio hipertiroidismo. Sin embargo, estudios recientes,32,33 demuestran que el MM/CM tiene efectos teratogénicos, a diferencia del PTU.
Por otra parte, en los últimos años han aparecido informes de casos de hepatitis tóxica fulminante en pacientes tratados con PTU,34,35 con tasas de prevalencia que oscilan entre el 0,1% y el 0,5% y una elevada tasa de mortalidad (25-50%).10,36 Incluso se han notificado casos de hepatitis neonatal en recién nacidos de madres que habían sido tratadas con PTU.37,38
Por lo tanto, nos encontramos ante un dilema: por un lado, parece estar claramente reconocido que el MM/CM implica un riesgo de malformaciones y, por otro, que el PTU puede provocar complicaciones mortales.
Ante esta alternativa, algunos autores han recomendado la terapia de ablación antes del embarazo en mujeres con EG.39 Sin embargo, esta solución apenas resuelve el problema, ya que las mujeres con EG no planean el embarazo en la mayoría de los casos. Por otra parte, esta medida no evita un eventual hipertiroidismo fetal (Fhyper) debido a la persistencia de niveles elevados de anticuerpos estimulantes de la tiroides (TSI), que requieren tratamiento médico, con lo que se vuelve a plantear el problema.
Por este motivo, la ATA estableció criterios para el uso de PTU en la población general y en las mujeres embarazadas.40 En el caso del embarazo, la ATA desaconseja el uso de MM/CM en el primer trimestre de la gestación (periodo de organogénesis) y recomienda el uso de PTU. Después de la semana 12 de embarazo, debe suspenderse el uso de PTU debido al riesgo de enfermedad hepática, y el control de la DG debe continuarse con MM/CM. Fuera del embarazo, el uso de PTU sólo se recomienda en dos circunstancias: en primer lugar, si se produce una tormenta tiroidea, y en segundo lugar, en presencia de efectos adversos inducidos por MM/CM.
Para evitar un retraso en el inicio del tratamiento con PTU, es aconsejable que las mujeres con EG que puedan quedar potencialmente embarazadas y que no utilicen ningún método anticonceptivo tengan PTU disponible en casa y que se les indique que cambien la medicación (de MM/CM a PTU) tan pronto como se verifique el embarazo.
Tratamiento médico. Manejo clínico
Como se ha comentado anteriormente, el tratamiento de la EG durante el embarazo debe consistir en PTU en el primer trimestre y MM/CM a partir de entonces. La dosis inicial puede oscilar entre 50 y 300 mg/día de PTU en tres dosis divididas, entre 5 y 15 mg/día de metimazol, o entre 10 y 15 mg/día de carbimazol como dosis única.6 Se debe intentar utilizar siempre la menor dosis posible.
Los betabloqueantes sólo deben utilizarse de forma transitoria, ya que su uso a largo plazo se ha asociado con retraso del crecimiento intrauterino, bradicardia e hipoglucemia neonatal.41 Además, algunos autores han informado de un aumento de los abortos espontáneos con el tratamiento combinado de propranolol y TCA.42
Al ajustar la dosis de TCA, debe intentarse mantener la función tiroidea de la madre cerca del límite de la hiperfunción subclínica, porque la glándula tiroidea del feto es mucho más sensible al efecto bloqueante de los TCA. De hecho, la presencia de TSH detectable es una indicación de que la dosis de ATD debe ser disminuida.10,43
La DG durante el embarazo muestra un curso muy dinámico, de manera que hasta un 20%-30% de las pacientes alcanzan un grado de control que permite la interrupción de los ATD en el último trimestre del embarazo.44 El uso de un esquema combinado (ATDs y THs) para el tratamiento de la DG está absolutamente contraindicado en el embarazo porque provoca hipotiroidismo fetal (Fhypo).6,43
Cirugía
En cuanto al uso de la cirugía para el control de la DG en la embarazada, los diferentes consensos y guías clínicas6,7,43 coinciden en recomendarla sólo si se dan los siguientes casos:
- 1
Reacciones adversas a los ATDs que impidan su uso.
- 2
La necesidad de dosis altas de TCA.
- 3
El incumplimiento del tratamiento médico por parte del paciente.
Además, las guías italianas43 también recomiendan la cirugía para los casos de bocio materno extenso con compresión de las vías respiratorias.
Si se realiza, el mejor momento para la cirugía es a partir del segundo trimestre. Esto justifica el uso de betabloqueantes y yoduro sódico (50-100 mg/día)45 durante un periodo corto (10-14 días) en mujeres embarazadas con DG como preparación para la cirugía. Como se ha comentado anteriormente, debe evitarse el tratamiento a largo plazo con betabloqueantes. También se debe tener precaución cuando se administre yoduro de potasio para evitar el desarrollo de bocio y/o Fhypo.
La cirugía provoca un profundo cambio en la situación. Por un lado, el hipertiroidismo se resuelve en las embarazadas, pero se induce un hipotiroidismo en la madre, que requiere una rápida reposición y un control regular de la TSH. También deben controlarse los niveles de IST y, si es necesario, vigilar el hipertiroidismo fetal.
Cambios en la autoinmunidad tiroidea durante el embarazo
Algunos autores han demostrado, al menos en algunos casos, que la actividad funcional de los anticuerpos contra el receptor de TSH cambia de una actividad estimulante a una inhibidora o bloqueante.46,47 Esto significa que el embarazo no sólo modula los niveles de autoanticuerpos, sino también su perfil funcional. Este concepto implica que la EG en el embarazo puede evolucionar no sólo a una función normal, sino incluso a una hipofunción debido a este cambio en la actividad estimulante-bloqueante, como se ha informado en algunos casos.48 Es decir, la DG en el embarazo es un proceso cambiante que requiere una vigilancia periódica constante, y que no debe descuidarse aunque se haya alcanzado una situación de aparente remisión que no requiera TCA.
Medición de anticuerpos estimulantes del tiroides en el embarazo
Con el fin de prevenir la repercusión de los posibles autoanticuerpos de la ETI en la glándula tiroidea del feto, la ETA publicó en 199849 los criterios que establecen las indicaciones de la medición de la ETI en el embarazo en función de las características de la EG de la madre (Tabla 5).
Indicaciones para la medición de la ETI según la Asociación Europea del Tiroides.
(I) Mujer eutiroidea con EG curada con tratamiento médico antes del embarazo
– No medir
(II) Mujer eutiroidea con EG curada tras131I o cirugía
– Medir precozmente la ETI: si es positiva, vigilar el hipertiroidismo fetal
– Medir la IST en el tercer trimestre (si es positiva en el primer trimestre): si es positivo, vigilar el hipertiroidismo neonatal
(III) Mujer tratada por DG durante el embarazo
– Medir la ETI en el tercer trimestre si es positiva, vigilar el hipertiroidismo neonatal
Enfermedad de Graves.
Fuente: Laurberg et al.49
En los casos en los que la EG se ha curado antes del embarazo con tratamiento médico, se considera que la condición inmunitaria se ha resuelto, y no se requiere la medición del IST.
Cuando la EG se resuelve mediante terapia de ablación (cirugía o radioterapia), la condición inmunitaria puede persistir. Los niveles de IST suelen ser negativos entre 12 y 18 meses después de la cirugía. Después de la terapia de ablación con 131I, los niveles aumentan inicialmente en los primeros meses y posteriormente disminuyen, aunque pueden permanecer elevados hasta cinco años.50 Esto significa que para prevenir un posible Fhyper después de 131I, hay que mantener la anticoncepción a largo plazo. Así pues, en las mujeres que desean concebir y tienen títulos de IST elevados, se prefiere la cirugía al 131I. En todos estos casos, los niveles de IST deben cuantificarse precozmente para evaluar el riesgo potencial de Fhyper, y deben medirse de nuevo en el tercer trimestre para ver si continúan siendo positivos y si, por lo tanto, existe un riesgo de hipertiroidismo neonatal.
En caso de DG activa durante el embarazo, el riesgo potencial de Fhyper se controla mediante el tratamiento de la madre con DTA. No obstante, se considera aconsejable realizar una prueba de IAT al final del embarazo para evaluar el riesgo de hipertiroidismo neonatal.
La ATA6 aconseja realizar la prueba aproximadamente a las 20-24 semanas, y establece recomendaciones mucho más generales:
- –
Madre con hipertiroidismo activo.
- –
Historia de tratamiento con 131I.
- –
Tiroidectomía previa.
- –
Recién nacido con hipertiroidismo previo.
Enfermedad de Graves en el feto
Hay que tener en cuenta que la glándula tiroidea fetal alcanza la madurez a partir de la semana 20, por lo que es capaz de responder a las mismas influencias (DTA y ETI) que la glándula tiroidea adulta. Debido a esto, tanto la hipo como la hipo pueden encontrarse en el contexto de la DG en el embarazo.
El hipotiroidismo fetal
La hipo suele producirse debido a una sobredosis relativa de TCA, que puede mantener una función normal en la madre, pero provoca una hipofunción clara en el feto.
Signos clínicos sugestivos
La afección puede sospecharse clínicamente a partir del bocio fetal en la ecografía obstétrica y en el desarrollo de polihidramnios en una embarazada tratada con TCA.
La presencia de bocio fetal, independientemente de los aspectos funcionales, es una señal de alarma por su efecto de masa51 (Fig. 1). Hay que tener en cuenta que el aumento de tamaño del tiroides provoca una hiperextensión de la nuca del feto, lo que a su vez perjudica la movilidad fetal intrauterina y, como consecuencia, da lugar a una presentación anormal al nacimiento (distocia de hombros, presentación de nalgas, etc.). Aunque esta hiperextensión no impida una adecuada posición cefálica del feto, impide una adecuada flexión del cuello fetal para el parto, provocando una presentación de cara. Todas estas situaciones requieren la realización de una cesárea. Sin embargo, ésta no es la principal complicación, ya que la compresión ejercida por el bocio sobre los cartílagos traqueales inmaduros del feto puede provocar una compresión traqueal y esofágica. Esto provoca una obstrucción de las vías respiratorias, con el consiguiente riesgo de asfixia. Además, la compresión esofágica dificulta la deglución del líquido amniótico, lo que provoca la acumulación de líquido y el desarrollo de polihidramnios. Esto favorece el nacimiento prematuro, principal causa de morbilidad y mortalidad neonatal.
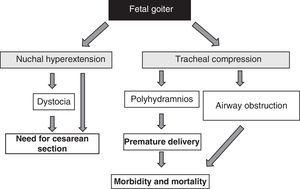
Consecuencias del desarrollo del bocio en el feto.
Diagnóstico
El único procedimiento totalmente fiable para confirmar una sospecha de Fhypo es la medición de los niveles de TH fetal mediante cordocentesis. Se trata de un procedimiento no exento de complicaciones (se asocia a un 2% de riesgo de muerte fetal52) y más complejo que la simple amniocentesis. Sin embargo, la medición de los niveles de TH fetales en el líquido amniótico no es fiable y no se correlaciona con su medición en la sangre fetal.53 Hay que tener en cuenta que en el líquido amniótico pueden encontrarse TH de origen materno.54 Según las diferentes guías,6,43 la cordocentesis sólo debe realizarse cuando se detecta bocio en un feto cuya madre está tomando TCA y no se puede hacer un diagnóstico seguro de Fhyper o Fhypo, y siempre en un centro con experiencia.
En lugar de este enfoque, recientemente se ha sugerido la medición del compuesto W, resultante del metabolismo de los TH fetales. En el feto, a diferencia de los adultos, el metabolismo de las THs sigue la vía de la sulfo-conjugación para formar diyodotironina sulfato; este compuesto es a su vez metilado en la placenta y en la pared uterina antes de pasar a la circulación materna y formar el compuesto W. Este compuesto se encuentra en todas las embarazadas desde el desarrollo de la función tiroidea fetal y aumenta gradualmente durante el embarazo, desapareciendo después del parto. Por lo tanto, se ha propuesto como marcador de la función tiroidea fetal.55 En este contexto, una progresión inadecuada de los niveles de compuesto W en una mujer embarazada tratada con TCA puede sugerir el desarrollo de Fhypo.56 Sin embargo, por el momento esto no es más que un método cuasi-experimental.
Tratamiento
La primera medida a tomar es la interrupción de los TCA. Sin embargo, debido a la latencia de los efectos de los TCA una vez suspendidos, también es necesario el reemplazo de TH hasta que la glándula tiroidea del feto se recupere completamente. El paso placentario de los TH es limitado, por lo que deben administrarse por vía intraamniótica. Esta vía, aunque invasiva, es mucho más segura que la cordocentesis, con un riesgo mínimo de aborto después de la primera mitad del embarazo.57
En cuanto al tratamiento intraamniótico del feto con T4, no existe un esquema de tratamiento establecido, y los datos de la literatura son bastante contradictorios.53,58,59 Una revisión reciente51 de los casos reportados hasta la fecha concluyó que la dosis media es de aproximadamente 279μg de levotiroxina una vez por semana (durante una a seis semanas). Esto parece revertir el bocio fetal entre 0,5 y 2,5 semanas después de la primera dosis. En algunos casos se repitieron las mediciones de TH, mientras que en otros la desaparición del bocio sólo se controló mediante ecografía.
Hipertiroidismo fetal
El bocio es una complicación poco frecuente y puede ocurrir hasta en el 1-2% de los bebés nacidos de madres con DG actual o previa, aunque posiblemente sea una condición infradiagnosticada.60,61
El desarrollo de Fhyper, excepto en los casos muy raros de mutaciones del receptor de TSH,62 puede ser el resultado de una DG mal controlada en una mujer embarazada o, más comúnmente, puede surgir en una mujer embarazada con DG curada antes del embarazo con terapia de ablación que sigue teniendo niveles elevados de IST. Las indicaciones para medir la IST para determinar el riesgo de Fhyper ya se han discutido. Los niveles de IST 3 ó 5 veces superiores a los normales6,63 implican un riesgo de Fhyper.
Signos clínicos sugestivos
La aparición de bocio fetal es una de las características más tempranas. También puede observarse bradicardia fetal, edad ósea avanzada, retraso del crecimiento general y craneosinostosis.64 En las formas más graves, puede producirse insuficiencia cardíaca con hidropesía fetal o alteración de la maduración del sistema nervioso central con retraso mental. Finalmente, puede producirse un parto prematuro.65
Diagnóstico
Los signos mencionados no son definitivos; no siempre se produce taquicardia, y la presencia de bocio en la ecografía es un hallazgo común en la Fhypo. Si surge la duda de si se trata de Fhypo por efecto de los TCA o de Fhyper por mal control materno, algunos autores han propuesto un sistema de puntuación basado en los datos ecográficos66 (Tabla 6). Si persiste la duda, deben medirse los TH fetales mediante cordocentesis, como se ha indicado en el apartado de Fhypo. El compuesto W (discutido previamente) podría ser útil para este propósito en el futuro.
Puntuación ecográfica para diferenciar el hipertiroidismo del hipotiroidismo en el bocio fetal.
| Característica ecográfica | Puntos |
| Ritmo cardíaco fetal | |
| Taquicardia | 1 |
| Normal | 0 |
| Vascularización del bocio | |
| Central | 1 |
| Periférico o ausente | 0 |
| Movimientos fetales | |
| Normal | 1 |
| Aumentados | 0 |
| Maduración ósea maduración | |
| Acelerada | -1 |
| Normal | 0 |
| Retrasado | 1 |
| La interpretación de la puntuación | |
| ≥2 sugiere hipertiroidismo | |
Tratamiento
El tratamiento debe basarse en los TCA. En este caso, a diferencia del Fhypo, el tratamiento no debe administrarse por vía intraamniótica porque los TCA atraviesan libremente la placenta. En caso de Fhyper en una mujer embarazada con DG mal controlada, sólo es necesario ajustar el tratamiento en la madre. Por el contrario, si la madre tiene una función normal gracias a la terapia de ablación previa, y sólo el feto muestra hiperfunción, debe administrarse MM/CM a la madre comenzando con dosis de 10-20mg/día. El tratamiento debe ser monitorizado cada 4-5 días en función de la FC fetal y de la evolución del bocio para no sobredosificar al feto y provocar Fhypo.10
Si la madre experimenta hipotiroidismo cuando se administran los TCA, se le debe administrar levotiroxina, que apenas atraviesa la placenta y por tanto compensa el hipotiroidismo sin afectar al feto. Esta es la única circunstancia en la que puede utilizarse el esquema combinado.
Enfermedad de Graves en el recién nacido
En los recién nacidos, la EG durante el embarazo puede causar tanto hipertiroidismo como hipotiroidismo.
Hipertiroidismo neonatal
Puede ocurrir en el 1-5% de los bebés nacidos de mujeres embarazadas con EG10 activa y títulos elevados de IST en el último trimestre. El feto mantiene una función normal durante el embarazo debido al efecto de los TCA recibidos por la madre. Los TCA tienen una vida media de 24-72h, y tras este periodo dejan de actuar sobre la glándula tiroidea fetal. Éste queda expuesto a la ETI materna, que puede persistir hasta 12 semanas después del parto.
En consecuencia, aparece la hiperfunción tiroidea e incluso la insuficiencia cardíaca, que se produce un par de días después del parto en un recién nacido inicialmente asintomático.
Esta afección también puede producirse en los recién nacidos de madres que han recibido terapia de ablación antes del embarazo y siguen teniendo niveles elevados de ETI, en los que se produjo un Fhyper no diagnosticado. En estos casos, el hipertiroidismo neonatal es una continuación del Fhyper; los recién nacidos muestran una afectación grave, bajo peso y una maduración ósea acelerada al nacer.
El tratamiento debe consistir en la administración de MM/CM a dosis de 0,5-1mg/kg de peso corporal/día y propranolol 2mg/kg de peso corporal/día36 según la evolución clínica y teniendo en cuenta que se trata de una situación transitoria. Hay que tener en cuenta que los ETI pueden acabar cambiando su perfil funcional para convertirse en bloqueadores de los receptores y desarrollar hipotiroidismo.
Hipotiroidismo neonatal secundario
En los bebés nacidos de madres con DG mal controlada, se puede encontrar que los niveles elevados de THs a los que han estado expuestos durante el embarazo han provocado la supresión de la secreción de TSH dando lugar a un hipotiroidismo secundario al nacer67. Esta situación puede ser transitoria o definitiva como resultado de una alteración hipofisaria permanente en la secreción de TSH.
Los recién nacidos deben recibir levotiroxina, seguida de una evaluación periódica hasta la eventual recuperación de la secreción de TSH.
También puede observarse hipotiroidismo neonatal transitorio debido a la persistencia de autoanticuerpos maternos que bloquean el receptor de RSH.68
Enfermedad de Graves en mujeres posparto
La EG previamente controlada, antes o después del embarazo, puede reaparecer después del parto. La tasa de recurrencia después del parto puede ser de hasta el 84%, en comparación con el 56% en las mujeres sin embarazo.69 Por lo tanto, se recomienda medir los TH maternos seis semanas después del parto y hasta un año.10
Si la EG se repite, será necesario un tratamiento médico con MM/CM. Aunque los TCA se segregan en la leche materna, su administración no entraña ningún riesgo durante la lactancia, y pueden tomarse hasta 20-30 mg de MM/CM sin que ello repercuta en la glándula tiroides de los recién nacidos.70 Los TCA deben tomarse en dosis divididas y siempre después de finalizar la ingesta de leche.
Se ha sugerido que las ETI de la leche materna podrían llegar a la circulación general de los recién nacidos a través del epitelio gastrointestinal inmaduro del lactante y causar o prolongar el hipertiroidismo neonatal. Sin embargo, todavía no hay pruebas concluyentes de que esto ocurra.71
Addendum
Después de la presentación de este manuscrito, la Sociedad Norteamericana de Endocrinología publicó nuevas guías de práctica clínica sobre el Manejo de la disfunción tiroidea durante el embarazo y el posparto (J Clin Endocrinol Metab 2012; 97: 2543-2565). Las recomendaciones dadas en la sección sobre hipertiroidismo en el embarazo no difieren sustancialmente de las discutidas en esta revisión.
Conflictos de intereses
El autor declara no tener conflictos de intereses.