Introduction
A prevalência de alterações da função tireoidiana nas mulheres é muito alta (5/1000 para hipotiroidismo e 3/1000 para hipertiroidismo1), e como muitas destas condições ocorrem em idade fértil, não há nada de estranho na ideia de que a gravidez esteja associada a estas doenças. Além disso, como a prática clínica de medir os níveis de hormônio tiroidiano (TH) em mulheres grávidas é prolongada, um número crescente de anormalidades da função tireoidiana que teriam sido negligenciadas em outras circunstâncias estão agora sendo detectadas em mulheres grávidas.
Por outro lado, a função tireoidiana materna sofre alterações significativas durante a gravidez, resultando em mudanças nos diferentes parâmetros laboratoriais. Por isso, uma abordagem diferente deve ser usada em mulheres grávidas em comparação com mulheres não grávidas ao interpretar os diferentes parâmetros da função tireoidiana, a fim de evitar diagnósticos e avaliações erradas com consequências potencialmente graves.
Como consequência do acima exposto, nos últimos anos surgiu interesse na fisiologia e nas potenciais alterações da glândula tireoidiana durante a gravidez.2 Entre estes, revisamos aspectos relacionados ao hipertireoidismo na gravidez, seus desafios e suas potenciais conseqüências, tanto durante a gravidez (na mãe e/ou no feto) quanto após o nascimento (na mãe e/ou no recém-nascido).
Avaliação funcional da tireóide durante a gravidez
Alterações fisiológicas significativas que têm um impacto considerável nos diferentes parâmetros da função tireoidiana materna3,4 ocorrem durante a gravidez, incluindo os seguintes:
- –
TSH. Os níveis de TSH diminuídos têm sido tradicionalmente observados em qualquer período de gravidez, em comparação com os níveis encontrados em mulheres não grávidas5 , com níveis mínimos no primeiro trimestre, que posteriormente aumentam no segundo e terceiro trimestres. Estas alterações nos níveis de TSH reflectem as alterações nos níveis de gonadotropina coriónica humana (HCG), que atingem o seu pico no primeiro trimestre e diminuem gradualmente a partir daí. É por isso que as diferentes sociedades científicas estabeleceram valores de referência normais6-8 (Tabela 1).
>Quadro 1.Referência de valores de TSH de acordo com as diferentes sociedades.
Sociedade Níveis de TSH (μU/ml) na gravidez Primeiro trimestre Segundo trimestre Terceiro trimestre Endo 2007/SEEN 2009 ATA 2011 0.1-2,5 0,2-3 0,3-3 ATA: American Thyroid Association; Endo: Sociedade Endócrina; SEEN: Sociedade Espanhola de Endocrinologia e Nutrição.
Fontes: Stagnaro-Green et al.,6 Abalovich et al.7 e Galofré et al.8
Deve-se notar que as diminuições nos níveis de TSH são ainda maiores em gravidezes múltiplas, e que as mulheres grávidas que fumam têm níveis mais baixos de TSH durante o primeiro e terceiro trimestres.9
- –
TBGT-T4. O aumento dos níveis de estrogênio associado à gravidez aumenta os níveis de TBG e, consequentemente, os valores de TT4. Entretanto, as mudanças nos níveis de TT4 são muito consistentes (aumentam em 150%) e o fazem independentemente tanto do trimestre quanto do método utilizado. Assim, se os níveis de TT4 estiverem disponíveis, a produção de T4 por mulheres grávidas pode ser estimada multiplicando por 1,5 os limites de referência em mulheres não grávidas.
- –
FT4. Na prática clínica, a maioria das medidas de T4 livres (FT4) não são realizadas utilizando os métodos de diálise de equilíbrio padrão-ouro ou de ultrafiltração. O procedimento rotineiramente utilizado é um sistema de imunoensaio onde a FT4 não é um valor directamente quantitativo, mas sim estimado através de um método sensível à proteína (influenciado pelo TBG e albumina), e que por isso é fortemente modificado pela gravidez, e também varia dependendo do trimestre. Além disso, cada método de ensaio tem variações específicas. Isso significa que, para uma interpretação adequada da FT4 durante a gravidez, valores de referência dependendo da idade gestacional e do método utilizado devem estar disponíveis, conforme declarado pela American Thyroid Association (ATA).6
Impacto do hipertireoidismo na mãe e no feto
Como mostrado na Tabela 2, o hipertireoidismo durante a gravidez pode ter consequências graves tanto para a mãe e para o feto e, após o nascimento, para o recém-nascido.10-12 Também deve ser observado que um risco aumentado de trombose, aparentemente reversível com o controle do hipertireoidismo, tem sido relatado recentemente no hipertireoidismo endógeno.13 Devido ao risco aumentado de trombose venosa profunda e tromboembolismo pulmonar durante a gravidez,14 um alto nível de suspeita deve ser mantido para permitir a detecção precoce desta complicação, e medidas profiláticas podem ter que ser consideradas.
Impacto materno-fetal do hipertireoidismo.
>
Materno
Aborto espontâneo
Pré-eclâmpsia (multiplica risco×5)7
Parto prematuro (multiplica risco×10)12
Abruptio placentae
Insuficiência cardíaca (multiplica risco×20)12
Tempestade tiróide (multiplica risco×10)12
Trombose venosa13
Fetal
Baixo peso ao nascer
Retardo de crescimento intra-uterino
Prematuridade
Pequeno para a idade gestacional
Morte fetal
Disfunção tireoidiana (hipertiroidismo ou hipotiroidismo)
Bócio fetal
Neonatal
Hipotiroidismo transitório
Hipotiroidismo transitório ou permanente
Classificação do hipertireoidismo durante a gravidez
Tabela 3 descreve as diferentes possibilidades diagnósticas quando o hipertireoidismo ocorre durante a gravidez. Por um lado, há uma série de condições directamente resultantes da própria gravidez, que podem ser englobadas sob o título de tirotoxicose gestacional transitória (TGT). Por outro lado, qualquer condição que leve à hiperfunção tireoidiana fora da gravidez também pode ocorrer durante a gravidez. Finalmente, níveis elevados de TH também podem ocorrer devido ao fornecimento exógeno de TH.
Classificação etiológica do hipertiroidismo na gravidez.
>
Tirotoxicose gestacional transitória
Hiperemese gravídica
Gravidez múltipla
Hipertiroidismo Trophoblástico (mol, chorocarcinoma)
Hiperreactio luteinalis
Tirotoxicose gestacional familiar
Hiperplacentose
Doença da tiróide
Doença de Graves
Tiroidite
Bócio multinodular
Adenoma tóxico da tiróide
Iatrogênico
Sobretratamento
Inadvertente ingestão de hormônios da tiróide (contaminação de alimentos, etc.)
Faccioso
Tirotoxicose gestacional transitória
Esta é a causa mais comum de hipertiroidismo durante a gravidez, e pode ocorrer em 1-3% de todas as gestações.15,16 Tem sido definido como um hipertireoidismo transitório que é limitado à primeira metade da gravidez e caracterizado por níveis aumentados de FT4 ou TT4 (ajustado) com TSH suprimida ou indetectável na ausência de autoanticorpos da tiróide16 ou características físicas sugestivas de doença de Graves (GD).17 Isto é geralmente o resultado de níveis aumentados de HCG ou de uma maior afinidade para os receptores de TSH.
A condição mais característica dentro deste grupo (Tabela 3) é a hiperemese gravídica (HG), mas existem outras condições também associadas com aumento dos níveis de HCG, como gravidez múltipla ou doença trofoblástica (molécula hidatida ou coriocarcinoma) com prevalência de TGT de até 50%.Existem também outras causas menos comuns, como a hiper-reação luteinalis,18 caracterizada pela formação de cistos de theca-luteína no início da gravidez, ou hiperplacentese,19 onde se observa aumento do peso placentário e da produção de HCG. Há também uma condição familiar (tireotoxicose gestacional familiar20) onde ocorre hipersensibilidade do receptor TSH aos níveis fisiológicos de HCG devido a uma mutação autossômica dominante; esta é clinicamente caracterizada pelo desenvolvimento da TGT em todas as gestações e em todas as mulheres da família com níveis normais de HCG.
Hyperemesis gravidarum
A causa mais comum da TGT é a HG. A HG ocorre em 0,5-10/1000 de todas as gestações,21 e está associada ao aumento dos níveis de TH livre e supressão de TSH em 30-60% dos casos.22 Deve-se notar que o conceito de HG deve ser restrito às condições associadas no primeiro trimestre de gravidez com vômitos, desidratação, perda de pelo menos 5% do peso corporal e cetonúria.23
Nestes casos, o hipertireoidismo é caracterizado pela supressão dos níveis de TSH e aumentos mínimos de FT4, com níveis de FT3 comumente normais. A hiperfunção tireoidiana, assim como o vômito associado, geralmente se resolve espontaneamente antes da semana 20, e o tratamento sintomático com hidratação intravenosa e complexo de vitamina B é suficiente para prevenir o risco excepcional de encefalopatia de Wernicke.24 Não há evidências de que o tratamento com drogas anti-tiróides (DTA) proporcione qualquer benefício25 e, portanto, o seu uso é desaconselhável.6
Excepcionalmente, HG com um componente de hiperfunção tireoidiana altamente conspícua ou GD com intolerância gastrointestinal associada (náuseas e vômitos) pode sugerir a necessidade de diagnóstico diferencial entre eles. A Tabela 4 mostra as principais diferenças. Em qualquer caso, se o hipertireoidismo durar além do primeiro trimestre de gravidez, uma causa diferente da TGT deve ser suspeita.
Diferenças entre a doença de Graves e a hiperemese.
| Sinal | Doença de Graves | Hiperemese |
| Sintomas de hipertiroidismo antes da gravidez | +++ | – |
| Sintomas de hipertiroidismo durante a gravidez | +/++ | -/+ |
| Nausea/vómito | -/+ | ++++ |
| Goiter/oftalmopatia | + | – |
| Anticorposhyroid | +++ | – |
| T-US | Hipervascular | Normal |
| Histo familiar do HG | – | + |
| Sintomas semelhantes na gravidez anterior | – | + |
| T4 | ||
| T3 | ||
| TT3/TTT4 proporção | >20 |
T-EUA: ultra-som da tiróide; HG: hiperemesis gravidarum.
Doença de Graves
Doenças da tiróide, GD é a causa mais comum de hipertireoidismo na gravidez, ocorrendo em 0,1-1% de todas as gestações (hipertireoidismo clínico e subclínico em 0,4% e 0,6% respectivamente).10
A história natural do GD durante a gravidez é uma exacerbação dos sintomas durante o primeiro trimestre devido ao efeito aditivo da estimulação pelo HCG do receptor TSH, seguido por uma melhora durante a segunda metade da gravidez devido ao efeito imunomodulador da gravidez, e sua recorrência após o nascimento.
Doença de Graves na gravidez
Os sintomas do GD ativo na gravidez não diferem daqueles típicos da condição. Alguns sintomas podem por vezes ser confundidos com os da própria gravidez. A possível presença de sinais oculares e bócio ajuda a esclarecer a condição, e as medidas hormonais permitem o diagnóstico.
Tratamento da doença de Graves na gravidez
Como é bem conhecido, há três abordagens terapêuticas potenciais para a DE em mulheres não grávidas: 131I, cirurgia, ou tratamento médico com DTA. Dessas três opções, a administração do 131I está contra-indicada na gravidez devido ao risco de malformação7 e, portanto, as opções estão limitadas à tireoidectomia ou ao uso de DTA. Quanto à cirurgia, ela só deve ser realizada em circunstâncias excepcionais, como discutido abaixo.
Tratamento médico. Antitiróides
Para o tratamento médico da DE na gravidez, o Propylthiouracil (PTU) era tradicionalmente considerado como o tratamento de escolha em relação ao Methimazole/Carbimazole (MM/CM) até alguns anos atrás.26 Este conceito foi baseado em alguns estudos sugerindo a transferência placentária mínima da PTU em relação ao MM/CM27 e nos efeitos teratogênicos do MM/CM. Sabe-se atualmente que ambas as ATDs cruzam a placenta e têm, portanto, a mesma chance de afetar o feto e causar hipotireoidismo fetal.26
Por outro lado, relatos de casos de hepatite tóxica fulminante em pacientes tratados com UTP têm surgido nos últimos anos,34,35 com taxas de prevalência variando de 0,1% a 0,5% e uma alta taxa de mortalidade (25-50%).10,36 Casos de hepatite neonatal em recém-nascidos de mães que haviam sido tratadas com UTP têm sido relatados.37,38
Enfrentamos, portanto, um dilema: por um lado, parece ser claramente reconhecido que a MM/CM envolve risco de malformação e, por outro, que a PTU pode causar complicações fatais.
Quando confrontados com esta alternativa, alguns autores recomendaram a terapia de ablação antes da gravidez em mulheres com GD.39 No entanto, esta solução mal resolve o problema, pois as mulheres com GD não planejam a gravidez na maioria dos casos. Por outro lado, essa medida não impede o eventual hipertireoidismo fetal (Fhyper) devido à persistência de altos níveis de anticorpos estimulantes da tireóide (ETI), o que requer tratamento médico, levantando assim o problema novamente.
Por este motivo, a ATA estabeleceu critérios para o uso de PTU na população em geral e em mulheres grávidas.40 Para a gravidez, a ATA aconselha contra o uso de MM/CM no primeiro trimestre de gravidez (período organogênese) e recomenda o uso de PTU. Após a semana 12 de gravidez, a PTU deve ser descontinuada devido ao risco de doença hepática, e o controle de GD deve ser continuado com MM/CM. Fora da gravidez, o uso da PTU só é recomendado em duas circunstâncias: primeiro, se ocorrer uma tempestade na tiróide, e segundo, na presença de efeitos adversos induzidos pela MM/CM.
Para evitar um atraso no início do tratamento com a PTU, é aconselhável para as mulheres com GD que podem potencialmente engravidar e que não usam nenhum método contraceptivo, ter a PTU disponível em casa e ser instruídas a trocar a medicação (de MM/CM para PTU) assim que a gravidez for verificada.
Tratamento medicamentoso. Manejo clínico
Como discutido acima, o tratamento de GD durante a gravidez deve consistir de UTP no primeiro trimestre e MM/CM a partir daí. A dose inicial pode variar de 50 a 300mg/dia de PTU em três doses divididas, 5 a 15mg/dia de methimazol, ou 10 a 15mg/dia de carbimazol como dose única.6 Deve-se sempre tentar usar a dose mais baixa possível.
Beta-bloqueadores só devem ser usados transitoriamente, pois seu uso a longo prazo tem sido associado com retardo de crescimento intra-uterino, bradicardia e hipoglicemia neonatal.41 Além disso, alguns autores relataram aumento do aborto espontâneo com propranolol e ATD combinados.42
Ao ajustar a dose de ATD, deve-se tentar manter a função tireoidiana da mãe próxima ao limite da hiperfunção subclínica, pois a glândula tireoide fetal é muito mais sensível ao efeito bloqueador das ATDs. De fato, a presença de TSH detectável é uma indicação de que a dose de ATD deve ser diminuída.10,43
GD durante a gravidez mostra um curso altamente dinâmico, de modo que até 20%-30% das pacientes atingem um grau de controle que permite a descontinuação da ATD no último trimestre de gravidez.44 O uso de um esquema combinado (ATDs e THs) para o tratamento da DE é absolutamente contra-indicado na gravidez, pois causa hipotireoidismo fetal (Fhypo).6,43
Surgery
As regards the use of surgery to control GD in pregnant women, the different consensuses and clinical guidelines6,7,43 agree in recommending it only if the following occur:
- 1
Adverse reactions to ATDs which prevent their use.
- 2
A necessidade de altas doses de ATD.
- 3
Não cumprimento do tratamento médico.
Além disso, as diretrizes italianas43 também recomendam a cirurgia para casos de bócio materno extensivo com compressão das vias aéreas.
Se realizada, o melhor momento para a cirurgia é a partir do segundo trimestre. Isso justifica o uso de beta-bloqueadores e iodeto de sódio (50-100mg/dia)45 por um curto período de tempo (10-14 dias) em gestantes com GD como preparação para a cirurgia. Como discutido acima, o tratamento a longo prazo com beta-bloqueadores deve ser evitado. Deve-se tomar cuidado também quando se administra iodeto de potássio para prevenir o desenvolvimento de bócio e/ou Fhypo.
A cirurgia causa uma mudança profunda na situação. Por um lado, o hipertireoidismo é resolvido em mulheres grávidas, mas o hipotireoidismo é induzido na mãe, requerendo reposição rápida e monitoramento regular da TSH. Os níveis de TSH também devem ser controlados, e o hipertireoidismo fetal deve ser monitorado se necessário.
Alterações na auto-imunidade tireoidiana durante a gravidez
Alguns autores demonstraram, pelo menos em alguns casos, que a atividade funcional dos anticorpos contra o receptor de TSH muda de uma atividade estimulante para uma inibitória ou bloqueadora.46,47 Isto significa que a gravidez não só modula os níveis de auto-anticorpos, mas também o seu perfil funcional. Este conceito implica que a DC na gravidez pode evoluir não apenas para a função normal, mas até mesmo para a hipofunção devido a esta mudança na atividade estimuladora-bloqueadora, como tem sido relatado em alguns casos.48 Ou seja, a DE na gravidez é um processo mutável que requer monitoramento constante e regular, e que não deve ser negligenciado mesmo quando se atinge uma situação de aparente remissão que não requer DTA.
Medição de anticorpos estimulantes da tireóide na gravidez
Para evitar o impacto de potenciais autoanticorpos TSI na glândula tireóide fetal, em 1998 a ETA publicou49 critérios estabelecendo as indicações para a medida TSI na gravidez, dependendo das características de GD na mãe (Tabela 5).
Indicações para a medição de TSI de acordo com a Associação Européia de Tiróide.
(I) Mulher eutóide com GD curada com tratamento médico antes da gravidez
– Sem medida
>
(II) Mulher eutóide com GD curada após131I ou cirurgia
– Medir TSI cedo: se positivo, monitorar hipertireoidismo fetal
– Medir TSI no terceiro trimestre (se positivo no primeiro trimestre): se positivo, monitorar hipertireoidismo neonatal
(III) Mulher tratada para GD durante a gravidez
– Medir TSI no terceiro trimestre se positivo, monitorar hipertireoidismo neonatal
GD: doença de Graves.
Fonte: Laurberg et al.49
Nos casos em que o GD foi curado antes da gravidez com tratamento médico, a condição imunológica é considerada resolvida, e a medida TSI não é necessária.
Quando o GD é resolvido usando terapia de ablação (cirurgia ou radioterapia), a condição imunológica pode persistir. Os níveis de TSI geralmente se tornam negativos 12-18 meses após a cirurgia. Após a terapia de ablação com 131I, os níveis inicialmente aumentam nos primeiros meses e subsequentemente diminuem, embora possam permanecer altos por até cinco anos.50 Isso significa que, para prevenir a potencial Fhyper após 131I, a contracepção a longo prazo tem que ser mantida. Assim, em mulheres que querem engravidar e têm altos títulos TSI, a cirurgia é preferida ao 131I. Em todos esses casos, os níveis de TSI devem ser quantificados antecipadamente para avaliar o risco potencial de IC, e devem ser medidos novamente no terceiro trimestre para ver se continuam positivos e se, portanto, existe um risco de hipertireoidismo neonatal.
No caso de GD ativa durante a gravidez, o risco potencial de Fhyper é controlado pelo tratamento da mãe com ATDs. No entanto, é considerado aconselhável testar TSI no final da gravidez para avaliar o risco de hipertireoidismo neonatal.
A ATA6 aconselha o teste em aproximadamente 20-24 semanas, e estabelece recomendações muito mais gerais:
- –
Mãe com hipertireoidismo ativo.
- –
História do tratamento com 131I.
- –
Prior thyroidectomy.
- –
Prior newborn with hyperthyroidism.
Doença de Graves no feto
Deve-se ter em mente que a glândula tireóide fetal atinge a maturidade a partir da semana 20, e é portanto capaz de responder às mesmas influências (ATDs e TSI) que a glândula tireóide adulta. Devido a isso, tanto Fhypo como Fhyper podem ser encontrados no ajuste de GD na gravidez.
Hipotiroidismo fetal
Fhypo geralmente ocorre devido à superdosagem relativa da ATD, que pode manter a função normal na mãe, mas causa uma clara hipofunção no feto.
Sinais clínicos sugestivos
A condição pode clinicamente ser suspeita com base no bócio fetal na ultrassonografia obstétrica e no desenvolvimento de polidrâmnio em uma gestante tratada com DTA.
A presença do bócio fetal, independentemente dos aspectos funcionais, é um sinal de alarme devido ao seu efeito de massa51 (Fig. 1). Deve-se levar em conta que o aumento da tireóide causa hiperextensão da parte posterior do colo do feto, o que, por sua vez, prejudica a mobilidade intra-uterina do feto e, como conseqüência, leva a uma apresentação anormal ao nascimento (distócia do ombro, apresentação pélvica, etc.). Mesmo que esta hiperextensão não impeça uma posição cefálica adequada do feto, impede uma flexão adequada do colo do feto para o parto, provocando uma apresentação facial. Todas estas situações requerem a realização de uma cesárea. Entretanto, esta não é a principal complicação, pois a compressão exercida pelo bócio sobre as cartilagens traqueais imaturas do feto pode causar compressão traqueal e esofágica. Isto resulta em obstrução das vias aéreas, com o consequente risco de asfixia. Além disso, a compressão esofágica prejudica a deglutição do líquido amniótico, levando à acumulação de líquidos e ao desenvolvimento de polidrâmnios. Isso favorece o nascimento prematuro, principal causa de morbidade e mortalidade neonatal.
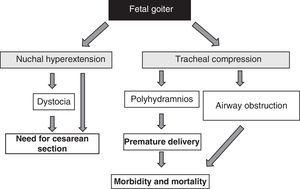
Consequências do desenvolvimento do bócio no feto.
Diagnóstico
O único procedimento totalmente fiável para confirmar uma suspeita de Fhypo é a medição dos níveis de TH fetal usando a cordocentese. Este é um procedimento que não é desprovido de complicações (está associado a um risco de 2% de morte fetal52) e é mais complexo que a simples amniocentese. Entretanto, a medida dos níveis de TH fetal no líquido amniótico não é confiável e não se correlaciona com sua medida no sangue fetal.53 Deve-se levar em conta que THs de origem materna podem ser encontradas no líquido amniótico.54 De acordo com as diferentes diretrizes,6,43 a cordocentese só deve ser realizada quando for detectado bócio em um feto cuja mãe esteja tomando TTA e não for possível fazer um certo diagnóstico de Fhyper ou Fhypo, e sempre em um centro experiente.
Em vez desta abordagem, a medida do composto W, resultante do metabolismo das THs fetais, tem sido sugerida recentemente. No feto, ao contrário dos adultos, o metabolismo das THs segue a via da conjugação sulfo-hidratada para formar sulfato de diiodotonina; este composto é, por sua vez, metilado na placenta e parede uterina antes de passar para a circulação materna e formar o composto W. Este composto é encontrado em todas as mulheres grávidas a partir do desenvolvimento da função tiroideia fetal e aumenta gradualmente durante a gravidez, desaparecendo após o parto. Portanto, tem sido proposto como um marcador da função tireoidiana fetal.55 Neste cenário, uma progressão inadequada dos níveis de composto W em uma gestante tratada com ATDs pode sugerir o desenvolvimento de Fhypo.56 No entanto, por enquanto isto não é mais do que um método quase experimental.
Tratamento
A primeira medida a ser tomada é a descontinuação das ATDs. Entretanto, devido à latência dos efeitos das ATDs uma vez descontinuadas, a substituição da TH também é necessária até que a glândula tireóide fetal se recupere completamente. A passagem da placenta de TH é limitada, pelo que devem ser administradas por via intra-amniótica. Esta via, embora invasiva, é muito mais segura que a cordocentese, com um risco mínimo de aborto espontâneo após a primeira metade da gravidez.57
As regards intra-amniotic treatment of the fetus with T4, there is no established treatment scheme, and the literature data are quite conflicting.53,58,59 A recent review51 of cases reported to date concluded that the mean dose is approximately 279μg of levothyroxine once weekly (for one to six weeks). Isto parece reverter o bócio fetal 0,5-2,5 semanas após a primeira dose. Medidas repetidas de TH foram feitas em alguns casos, enquanto em outros o desaparecimento do bócio só foi monitorado por ultra-som.
Hertireoidismo fetal
Fhyper é uma complicação rara e pode ocorrer em até 1-2% dos bebês nascidos de mães com GD atual ou anterior, embora possivelmente seja uma condição subdiagnosticada.60,61
O desenvolvimento de Fhyper, exceto nos casos muito raros de mutações do receptor TSH,62 pode ser o resultado de GD mal controlado em uma gestante ou, mais comumente, pode surgir em uma gestante com GD curada antes da gravidez com terapia de ablação que continua a ter níveis altos de TSI. As indicações para medir o TSI para determinar o risco de Fhyper já foram discutidas. Os níveis de TSI 3 ou 5 vezes superiores ao normal6,63 envolvem um risco de Fhyper.
Sinais clínicos sugestivos
A ocorrência de bócio fetal é uma das características mais precoces. Bradicardia fetal, idade óssea avançada, retardo geral do crescimento e craniosinostose também podem ser observados.64 Em formas mais graves, pode ocorrer insuficiência cardíaca com hidropisia fetal ou comprometimento da maturação do sistema nervoso central com retardo mental. O parto prematuro pode eventualmente ocorrer.65
Diagnóstico
Os sinais acima não são definitivos; nem sempre ocorre taquicardia, e a presença de bócio na ultrassonografia é um achado comum com Fhypo. Em caso de dúvida sobre se a condição é Fhypo devido ao efeito das DTA ou Fhyper devido ao controle materno deficiente, alguns autores propuseram um sistema de pontuação baseado em dados ultra-sonográficos66 (Tabela 6). Se a dúvida persistir, os THs fetais devem ser medidos por cordocentese, como indicado na seção Fhypo. O composto W (discutido anteriormente) pode ser útil para este propósito no futuro.
Pontuação ultra-sonográfica para diferenciar o hipertireoidismo do hipotireoidismo no bócio fetal.
| Função de ultra-som | Pontos |
| Ritmo cardíaco fetal | |
| Taquicardia | 1 |
| Normal | 0 |
| Vascularização de Goiter | |
| Central | 1 |
| Periférico ou ausente | 0 |
| Movimentos fetais | |
| Normal | 1 |
| Aumentado | 0 |
| Bone maturação | |
| Acelerado | -1 |
| Normal | 0 |
| Atrasado | 1 |
| Interpretação do resultado | |
| ≥2 sugere hipertiroidismo | |
Tratamento
Tratamento deve ser baseado em ATDs. Neste caso, ao contrário do Fhypo, o tratamento não deve ser administrado por via intra-amniótica porque as ATDs atravessam livremente a placenta. No caso da Fhyper numa mulher grávida com GD mal controlado, só é necessário um ajuste de tratamento na mãe. Em contraste, se a mãe tiver uma função normal graças à terapia de ablação prévia, e apenas o feto mostrar hiperfunção, MM/CM deve ser administrado à mãe começando com doses de 10-20mg/dia. O tratamento deve ser monitorado a cada 4-5 dias com base na FC fetal e no curso do bócio, a fim de não sobredosar o feto e causar Fhypo.10
Se a mãe experimentar hipotiroidismo quando as ATDs são administradas, ela deve receber levotiroxina, que mal atravessa a placenta e, portanto, compensa o hipotiroidismo sem afetar o feto. Esta é a única circunstância em que o esquema combinado pode ser usado.
Doença de Graves no recém-nascido
Em recém-nascidos, GD durante a gravidez pode causar tanto hipertiroidismo quanto hipotiroidismo.
Hipertiroidismo neonatal
Isso pode ocorrer em 1-5% dos bebês nascidos de mulheres grávidas com GD10 ativo e títulos TSI altos no trimestre final. O feto mantém a função normal durante a gravidez devido ao efeito das ATDs recebidas pela mãe. As ATDs têm uma meia-vida de 24-72h, e após este período deixam de agir sobre a glândula tireóide fetal. Isto se torna exposto ao TSI materno, que pode persistir por até 12 semanas após o parto.
Hiperfunção tireoidiana e até insuficiência cardíaca, ocorrendo alguns dias após o parto em um recém-nascido inicialmente assintomático, aparecem como resultado.
Esta condição também pode ocorrer em recém-nascidos de mães que receberam terapia de ablação antes da gravidez e continuam a ter níveis elevados de TSI, em que ocorreu Fhyper não diagnosticado. Nesses casos, o hipertireoidismo neonatal é uma continuação do Fhyper; recém-nascidos apresentam comprometimento grave, baixo peso e maturação óssea acelerada ao nascimento.
O tratamento deve consistir na administração de MM/CM nas doses de 0,5-1mg/kg de peso corporal/dia e propranolol 2mg/kg de peso corporal/dia36 dependendo do curso clínico e tendo em mente que essa é uma situação transitória. Deve-se notar que as ETIs podem eventualmente mudar seu perfil funcional para se tornarem bloqueadores receptores e desenvolver hipotiroidismo.
Secundário hipotiroidismo neonatal
Em bebês nascidos de mães com GD mal controlado, pode-se descobrir que níveis elevados de THs aos quais eles foram expostos durante a gravidez causaram a supressão da secreção de TSH levando ao hipotiroidismo secundário ao nascimento.67 Esta situação pode ser transitória ou definitiva como resultado de um comprometimento permanente da hipófise na secreção de TSH.
Netos recém-nascidos devem receber levotiroxina, seguida de avaliação regular até a eventual recuperação da secreção de TSH.
Hipotiroidismo neonatal transitório devido à persistência de autoanticorpos maternos bloqueando o receptor de RSH também pode ser observado.68
Doença de Graves em mulheres pós-parto
DGD previamente controlada, antes ou depois do parto, pode voltar a ocorrer após o parto. A taxa de recorrência após o parto pode ser de até 84%, em comparação com 56% em mulheres sem gravidez.69 Recomenda-se, portanto, que o TH materno seja medido seis semanas após o parto e por até um ano.10
Se houver recorrência de GD, será necessário tratamento médico com MM/CM. Embora as ATDs sejam secretadas no leite materno, sua administração não envolve risco durante a lactação, e até 20-30mg de MM/CM podem ser tomados sem impacto na glândula tireóide dos recém-nascidos.70 As ATDs devem ser tomadas em doses divididas e sempre após o final da ingestão de leite.
Tem sido sugerido que TSI no leite materno poderia alcançar a circulação geral dos recém-nascidos através do epitélio gastrointestinal imaturo do bebê e causar ou prolongar o hipertireoidismo neonatal. Entretanto, ainda não há evidências conclusivas de que isto ocorra.71
Addendum
Após a submissão deste manuscrito, a Sociedade Norte-Americana de Endocrinologia emitiu novas diretrizes clínicas sobre o manejo da disfunção tireoidiana durante a gravidez e pós-parto (J Clin Endocrinol Metab 2012; 97: 2543-2565). As recomendações dadas na seção sobre hipertireoidismo na gravidez não diferem substancialmente daquelas discutidas nesta revisão.
Conflitos de interesse
O autor afirma que não tem conflitos de interesse.