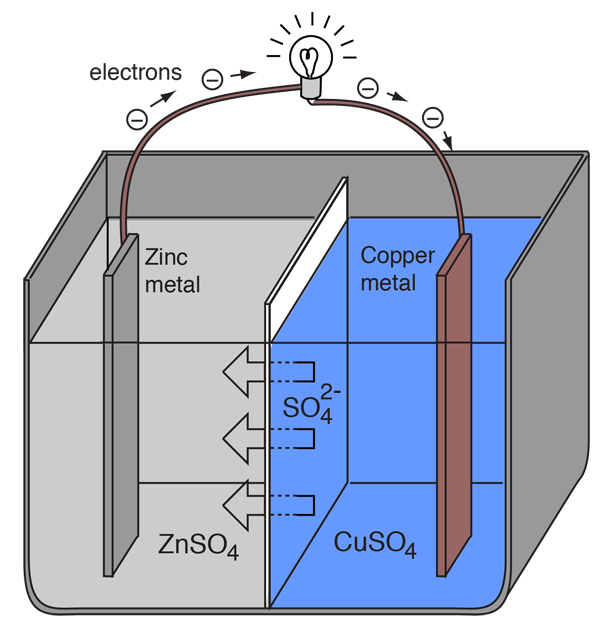
Een elektrochemische cel die uitwendige elektrische stroom veroorzaakt kan worden gemaakt met twee verschillende metalen, aangezien metalen verschillen in hun neiging om elektronen te verliezen. Zink verliest gemakkelijker elektronen dan koper, zodat het plaatsen van zink- en kopermetaal in oplossingen van hun zouten elektronen kan doen stromen door een externe draad die van het zink naar het koper leidt.
Aantekening toevoegen aan illustratie
Omdat een zinkatoom de elektronen levert, wordt het een positief ion en gaat het in een waterige oplossing, waardoor de massa van de zinkelektrode afneemt. Aan de koperzijde zorgen de twee ontvangen elektronen ervoor dat een koperion uit de oplossing wordt omgezet in een ongeladen koperatoom dat zich afzet op de koperelektrode, waardoor de massa van de elektrode toeneemt. De twee reacties worden typisch geschreven
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
De letters tussen haakjes herinneren er slechts aan dat het zink van een vaste stof (s) in een wateroplossing (aq) overgaat en vice versa voor het koper. Het is gebruikelijk in de elektrochemie om deze twee processen “halfreacties” te noemen, die aan de twee elektroden plaatsvinden.
Zn(s) -> Zn2+(aq) + 2e- |
De “halfreactie” van zink wordt geclassificeerd als oxidatie omdat het elektronen verliest. De aansluiting waar de oxidatie plaatsvindt, wordt de “anode” genoemd. Voor een batterij is dit de negatieve pool. |
|
De “halfreactie” met koper wordt geclassificeerd als reductie, omdat het elektronen wint. De aansluiting waar de reductie plaatsvindt, wordt de “kathode” genoemd. Voor een batterij is dit de positieve pool. |
Cu2+(aq) + 2e- -> Cu(s) |
Om ervoor te zorgen dat de voltaïsche cel een externe elektrische stroom blijft produceren, moet er een beweging zijn van de sulfaationen in oplossing van rechts naar links om de elektronenstroom in het externe circuit in evenwicht te houden. De metaalionen zelf moeten worden verhinderd zich tussen de elektroden te bewegen, zodat moet één of ander soort poreus membraan of ander mechanisme voor de selectieve beweging van de negatieve ionen in de elektrolyt van rechts naar links zorgen.
Energie is nodig om de elektronen te dwingen zich van de zink- naar de koperelektrode te verplaatsen, en de hoeveelheid energie per eenheid lading die in de voltaïsche cel beschikbaar is, wordt de elektromotorische kracht (emf) van de cel genoemd. De energie per ladingseenheid wordt uitgedrukt in volt (1 volt = 1 joule/coulomb).
Het is duidelijk dat je, om energie uit de cel te halen, meer energie uit de oxidatie van het zink moet halen dan er nodig is om het koper te reduceren. De cel kan een eindige hoeveelheid energie uit dit proces halen, waarbij het proces wordt beperkt door de hoeveelheid materiaal die beschikbaar is in de elektrolyt of in de metalen elektroden. Indien er bijvoorbeeld één mol sulfaat-ionen SO42- aan de koperzijde zou zijn, dan is het proces beperkt tot het overbrengen van twee mol elektronen door het externe circuit. De hoeveelheid elektrische lading in een mol elektronen wordt de constante van Faraday genoemd, en is gelijk aan het getal van Avogadro maal de elektronlading:
De energieopbrengst van een voltaïsche cel wordt gegeven door de celspanning maal het aantal mol overgedragen elektronen maal de Faraday-constante.
Elektrische energieopbrengst = nFEcell
De cel-emf Ecell kan worden voorspeld uit de standaard elektrodepotentialen voor de twee metalen. Voor de zink/koper-cel onder de standaardomstandigheden bedraagt de berekende celpotentiaal 1,1 volt.
| Droge cellen | Lood-zuur batterijen |