Generiskt namn: halobetasol propionate
Doseringsform: kräm
Medicinskt granskad av Drugs.com. Senast uppdaterad den 21 april 2020.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Interaktioner
- Mer
- Ultravatkräm Beskrivning
- Ultravate Cream – klinisk farmakologi
- Farmakokinetik
- Indikationer och användning för Ultravate Cream
- Kontraindikationer
- Försiktighetsåtgärder
- Allmänt
- Information till patienter
- Laboratorietester
- Carcinogenes, mutagenes och försämrad fertilitet
- Graviditet
- Sjuksköterskor
- Pediatrisk användning
- Geriatrisk användning
- Biverkningar
- Överdosering
- Ultravate Cream Dosering och administrering
- Hur levereras Ultravate Cream
- LAGERING
- Packningsetikett.PRINCIPAL DISPLAY PANEL
- Fler ställda frågor
- Mer om Ultravate (halobetasol topikalt)
- Konsumentresurser
- Professionella resurser
- Relaterade behandlingsguider
Ultravatkräm Beskrivning
Ultravatkräm (halobetasolpropionatkräm), 0.05 % innehåller halobetasolpropionat, en syntetisk kortikosteroid för topisk dermatologisk användning. Kortikosteroiderna utgör en klass av främst syntetiska steroider som används topiskt som ett antiinflammatoriskt och antipruritiskt medel.
Kemiskt sett är halobetasolpropionat 21-kloro-6α, 9-difluoro-11β, 17-dihydroxi-16β-metylpregna-1, 4-dien-3-20-dion, 17-propionat, C25H31ClF2O5. Den har följande strukturformel:
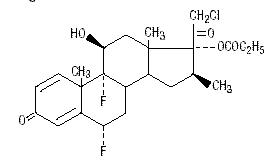
Halobetasolpropionat har molekylvikten 485. Det är ett vitt kristallint pulver olösligt i vatten.
Varje gram Ultravate Cream innehåller 0,5 mg/g halobetasolpropionat i en krämbas av cetylalkohol, glycerin, isopropylisostearat, isopropylpalmitat, steareth-21, diazolidinylurea, metylklorisothiazolinon (och) metylisothiazolinon och vatten.
Ultravate Cream – klinisk farmakologi
Likt andra topiska kortikosteroider har halobetasolpropionat antiinflammatoriska, antipruritiska och vasokonstriktiva effekter. Mekanismen för den antiinflammatoriska aktiviteten hos de topiska kortikosteroiderna är i allmänhet oklar. Kortikosteroider tros dock verka genom induktion av fosfolipas A2-hämmande proteiner, kollektivt kallade lipocortiner. Det antas att dessa proteiner kontrollerar biosyntesen av potenta inflammationsmediatorer som prostaglandiner och leukotriener genom att hämma frisättningen av deras gemensamma prekursor arakidonsyra. Arakidonsyra frigörs från membranfosfolipider av fosfolipas A2.
Farmakokinetik
Omfattningen av den perkutana absorptionen av topiska kortikosteroider bestäms av många faktorer, inklusive vätskan och den epidermala barriärens integritet. Ocklusiva förband med hydrokortison i upp till 24 timmar har inte visat sig öka penetrationen; ocklusion av hydrokortison i 96 timmar ökar dock markant penetrationen. Topiska kortikosteroider kan absorberas från normal intakt hud. Inflammation och/eller andra sjukdomsprocesser i huden kan öka den perkutana absorptionen.
Human- och djurstudier visar att mindre än 6 % av den applicerade dosen halobetasolpropionat kommer in i cirkulationen inom 96 timmar efter topisk administrering av krämen.
Studier som utförts med Ultravate Cream visar att den ligger i det superhöga potensområdet jämfört med andra topiska kortikosteroider.
Indikationer och användning för Ultravate Cream
Ultravate Cream 0,05% är en kortikosteroid med superhög potens som är indicerad för lindring av inflammatoriska och pruritiska manifestationer av kortikosteroidresponsiva dermatoser. Behandling längre än två på varandra följande veckor rekommenderas inte, och den totala dosen bör inte överstiga 50 g/vecka på grund av läkemedlets potential att undertrycka hypotalamus-hypofys-binjureaxeln (HPA-axeln). Användning hos barn under 12 år rekommenderas inte.
Som med andra högaktiva kortikosteroider ska behandlingen avbrytas när kontroll har uppnåtts. Om ingen förbättring ses inom 2 veckor kan en förnyad bedömning av diagnosen vara nödvändig.
Kontraindikationer
Ultravate Cream är kontraindicerat hos de patienter som har en historia av överkänslighet mot någon av preparatets komponenter.
Försiktighetsåtgärder
Allmänt
Systemisk absorption av topiska kortikosteroider kan ge reversibel suppression av hypotalamus-hypofysen-binjureaxeln (HPA) med risk för glukokortikosteroidinsufficiens efter avslutad behandling. Manifestationer av Cushings syndrom, hyperglykemi och glukosuri kan också produceras hos vissa patienter genom systemisk absorption av topiska kortikosteroider under behandling.
Patienter som applicerar en topisk steroid på en stor yta eller på områden som är ocklusionerade bör utvärderas med jämna mellanrum för att se om det finns tecken på suppression av HPA-axeln. Detta kan göras med hjälp av ACTH-stimulering, A.M. plasmakortisol och test av fritt kortisol i urinen. Patienter som får superpotenta kortikosteroider bör inte behandlas i mer än 2 veckor i taget och endast små områden bör behandlas åt gången på grund av den ökade risken för HPA-suppression.
Ultravate Cream gav HPA-axel-suppression när det användes i delade doser på 7 gram per dag i en vecka hos patienter med psoriasis. Dessa effekter var reversibla när behandlingen avbröts.
Om HPA-axelsuppression noteras bör man försöka dra tillbaka läkemedlet, minska appliceringsfrekvensen eller byta ut en mindre potent kortikosteroid. Återhämtning av HPA-axelns funktion sker i allmänhet snabbt när topiska kortikosteroider avbryts. I sällsynta fall kan tecken och symtom på glukokortikosteroidinsufficiens uppträda och kräva kompletterande systemiska kortikosteroider. För information om systemiskt tillskott, se förskrivningsinformation för dessa produkter.
Pediatriska patienter kan vara mer mottagliga för systemisk toxicitet från ekvivalenta doser på grund av deras större förhållande mellan hudyta och kroppsmassa (se PRECAUTIONSANVISNINGAR: Pediatrisk användning).
Om irritation utvecklas ska Ultravate Cream avbrytas och lämplig terapi sättas in. Allergisk kontaktdermatit med kortikosteroider diagnostiseras vanligen genom att observera utebliven läkning snarare än att notera en klinisk exacerbation som med de flesta topiska produkter som inte innehåller kortikosteroider. En sådan observation bör bekräftas med lämpligt diagnostiskt lapptest.
Om samtidiga hudinfektioner föreligger eller utvecklas bör ett lämpligt svampbekämpande eller antibakteriellt medel användas. Om ett gynnsamt svar inte inträffar omedelbart ska användningen av Ultravate Cream avbrytas tills infektionen är adekvat kontrollerad.
Ultravate Cream ska inte användas vid behandling av rosacea eller perioral dermatit, och den ska inte användas i ansiktet, i ljumskarna eller i axillerna.
Information till patienter
Patienter som använder topiska kortikosteroider ska få följande information och instruktioner:
- Läkemedlet ska användas enligt läkarens anvisningar. Det är endast avsett för utvärtes bruk. Undvik kontakt med ögonen.
- Läkemedlet ska inte användas för någon annan sjukdom än den för vilken det förskrivits.
- Det behandlade hudområdet ska inte bandageras, på annat sätt täckas eller lindas så att det blir ocklusivt, såvida det inte har anvisats av läkaren.
- Patienterna ska rapportera till sin läkare alla tecken på lokala biverkningar.
Laboratorietester
Följande tester kan vara till hjälp vid utvärdering av patienter för HPA-axelsuppression: ACTH-stimuleringstest; A.M. plasmakortisoltest; Test av fritt kortisol i urin.
Carcinogenes, mutagenes och försämrad fertilitet
Långsiktiga djurstudier har inte utförts för att utvärdera den karcinogena potentialen hos halobetasolpropionat. Positiva mutagena effekter observerades i två genotoxicitetsanalyser. Halobetasolpropionat var positivt i ett kinesiskt hamstermikronukleustest och i ett muslymfomgenmutationstest in vitro.
Studier på råtta efter oral administrering i dosnivåer upp till 50 µg/kg/dag visade inte på någon försämring av fertilitet eller allmän reproduktionsförmåga.
I andra genotoxicitetstester visade sig halobetasolpropionat inte vara genotoxiskt i Ames/Salmonella-assayet, i systerkromatidutbytestet i somatiska celler hos kinesisk hamster, i kromosomaberrationsstudier av groddjur och somatiska celler hos gnagare och i ett däggdjursspot-test för att bestämma punktmutationer.
Graviditet
Teratogena effekter: Graviditetskategori C
Kortikosteroider har visat sig vara teratogena hos försöksdjur när de administreras systemiskt vid relativt låga dosnivåer. Vissa kortikosteroider har visat sig vara teratogena efter dermal applicering hos försöksdjur.
Halobetasolpropionat har visat sig vara teratogent hos SPF-råttor och kaniner av chinchillatyp när det gavs systemiskt under dräktigheten i doser på 0,04 till 0,1 mg/kg hos råttor och 0,01 mg/kg hos kaniner. Dessa doser är ungefär 13, 33 respektive 3 gånger den humana topiska dosen av Ultravate Cream. Halobetasolpropionat var embryotoxiskt hos kaniner men inte hos råttor.
Gomspalt observerades hos både råttor och kaniner. Omphalocele sågs hos råttor, men inte hos kaniner.
Det finns inga adekvata och välkontrollerade studier av den teratogena potentialen hos halobetasolpropionat hos gravida kvinnor. Ultravate Cream ska användas under graviditet endast om den potentiella nyttan motiverar den potentiella risken för fostret.
Sjuksköterskor
Systemiskt administrerade kortikosteroider förekommer i humanmjölk och kan undertrycka tillväxten, störa den endogena kortikosteroidproduktionen eller orsaka andra oönskade effekter. Det är inte känt om topisk administrering av kortikosteroider skulle kunna resultera i tillräcklig systemisk absorption för att producera detekterbara mängder i humanmjölk. Eftersom många läkemedel utsöndras i mänsklig mjölk bör försiktighet iakttas när Ultravate Cream administreras till en ammande kvinna.
Pediatrisk användning
Säkerheten och effekten av Ultravate Cream hos pediatriska patienter har inte fastställts och användning hos pediatriska patienter under 12 år rekommenderas inte. På grund av ett högre förhållande mellan hudyta och kroppsmassa löper pediatriska patienter större risk än vuxna att drabbas av suppression av HPA-axeln och Cushings syndrom när de behandlas med topiska kortikosteroider. De löper därför också större risk att drabbas av binjurebarksinsufficiens under eller efter avslutad behandling. Biverkningar inklusive striae har rapporterats vid olämplig användning av topiska kortikosteroider hos spädbarn och barn.
HPA-axelsuppression, Cushings syndrom, linjär tillväxthämning, försenad viktökning och intrakraniell hypertension har rapporterats hos barn som får topiska kortikosteroider. Manifestationer av binjuresuppression hos barn inkluderar låga plasmakortisolnivåer och avsaknad av svar på ACTH-stimulering. Manifestationer av intrakraniell hypertension inkluderar utbuktande fontaneller, huvudvärk och bilateralt papillödem.
Geriatrisk användning
Av cirka 400 patienter som behandlades med Ultravate Cream i kliniska studier var 25 % 61 år och äldre och 6 % var 71 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa patienter och yngre patienter; och andra rapporterade kliniska erfarenheter har inte identifierat skillnader i svar mellan äldre och yngre patienter, men en större känslighet hos vissa äldre individer kan inte uteslutas.
Biverkningar
I kontrollerade kliniska studier var de vanligaste biverkningarna som rapporterades för Ultravate Cream stickande, brännande eller klåda hos 4,4 % av patienterna. Mindre ofta rapporterade biverkningar var torr hud, erytem, hudatrofi, leukodermi, vesiklar och utslag.
Följande ytterligare lokala biverkningar rapporteras sällan med lokala kortikosteroider, och de kan förekomma oftare med högpotenta kortikosteroider, såsom Ultravate Cream. Dessa reaktioner listas i ungefärlig fallande ordning efter förekomst: follikulit, hypertrikos, akneformiga eruptioner, hypopigmentering, perioral dermatit, allergisk kontaktdermatit, sekundärinfektion, striae och miliaria.
Överdosering
Topiskt applicerad Ultravate Cream kan absorberas i tillräckliga mängder för att ge systemiska effekter (seVARNINGAR).
Ultravate Cream Dosering och administrering
Applicera ett tunt lager Ultravate Cream på den drabbade huden en eller två gånger dagligen, enligt läkarens anvisningar, och gnugga in försiktigt och helt.
Ultravate (halobetasolpropionatkräm) Cream är en superhög potens av topisk kortikosteroid; därför bör behandlingen begränsas till två veckor och mängder större än 50 g/vecka bör inte användas. Liksom med andra kortikosteroider ska behandlingen avbrytas när kontroll har uppnåtts. Om ingen förbättring ses inom 2 veckor kan en förnyad bedömning av diagnosen vara nödvändig.
Ultravate Cream ska inte användas med ocklusiva förband.
Hur levereras Ultravate Cream
Ultravate® (halobetasolpropionat kräm) Cream, 0.05% levereras i följande tubstorlekar:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
LAGERING
Lagra mellan 15°C och 30°C (59°F och 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (platt), 09-0086 (veckad)
Reviderad maj 2010
Packningsetikett.PRINCIPAL DISPLAY PANEL

15 grams behållaretikett

15 grams kartonetikett

50 grams behållaretikett

50 grams kartonetikett
| ULTRAVATE halobetasol propionat kräm |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Etiketterare – Ranbaxy Laboratories Inc. (169932519)
Registrant – Ranbaxy Laboratories Inc. (169932519)
| Etablering | |||
| Namn | Adress | ID/FEI | Operationer |
| Contract Pharmaceuticals Limited | 248761249 | tillverkning | |
Fler ställda frågor
- Halobetasol vs. clobetasol – hur förhåller de sig till varandra?
- Kan detta användas mot murgröna?
- Kan det användas i hårbotten?
Mer om Ultravate (halobetasol topikalt)
- Biverkningar
- Under graviditet eller amning
- Dosering Information
- Läkemedelsinteraktioner
- Prissättning & Kuponger
- En Español
- 6 Recensioner
- Generisk tillgänglighet
- Läkemedelsklass: Topiska steroider
Konsumentresurser
- Patientinformation
- Ultravate (Avancerad läsning)
Professionella resurser
- Förskrivarinformation
Andra varumärken Lexette, Bryhali, Halonate
Relaterade behandlingsguider
- Psoriasis
- Atopisk dermatit
- Dermatit
- Eksem
Medicinsk ansvarsfriskrivning