Kromě toho, že je l-laktát prekurzorem glukózy v játrech a ledvinách, je nyní ve většině buněk považován také za energetický substrát prostřednictvím jeho oxidace na pyruvát. Tato oxidace, o níž se předpokládá, že probíhá v cytosolu, je katalyzována l-laktátdehydrogenázou, přičemž pyruvát je následně katabolizován v mitochondriích. Nedávno však bylo uznáno, že mitochondrie hrají v metabolismu l-laktátu určitou roli: existenci mitochondriální l-laktátdehydrogenázy (m-l-LDH) navrhl Dianzani (1) a později Baba a Sharma (2) prokázali, že se nachází v mitochondriální matrix (3). Transport a metabolismus l-laktátu byl skutečně prokázán v různých mitochondriích, včetně kosterního svalu (4), srdce potkana (5), jater (6), mozku (7-9), cerebelárních granulových buněk (10), králičího gastrocnemia (11), spermatických buněk (12), prasečích jater (13), a dokonce i rostlin (14). Existence m-l-LDH, jak ji přezkoumali Passarella et al. (3), Brooks (15) a Schurr (16), byla tedy uznána jeho zařazením do MitoCarty (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Jak se dalo očekávat, vzhledem k přítomnosti l-LDH v matrici byl ve funkčních studiích s purifikovanými spřaženými mitochondriemi prokázán výskyt přenašečů pro l-laktát. Patří mezi ně l-laktát/H+ symportér a l-laktát/pyruvát a l-laktát/oxaloacetát antiportéry (3). Překvapivě přesvědčivé důkazy o existenci m-l-LDH umístěného uvnitř mitochondrie nejsou všeobecně přijímány, někteří vědci jsou k existenci m-l-LDH stále skeptičtí, zatímco jiní lokalizují m-l-LDH v mezimembránovém prostoru (17). Domníváme se, že tento skepticismus může pramenit z obtíží při izolaci spřažených mitochondrií, což není snadný úkol, zejména u vzorků kosterního svalstva, nebo z nedostatečné opatrnosti při výběru reakčního média a při použití inhibitorů ve správné koncentraci (11). To, že je m-l-LDH lokalizován uvnitř mitochondrií, bude ukázáno níže.
Je l-Laktát transportován a metabolizován v mitochondriích nádorových buněk?
Ano, je. Ačkoli ve 20. letech 20. století Warburg zjistil, že rakovinné buňky dávají přednost produkci ATP pomocí glykolýzy s produkcí l-laktátu, podle našich nejlepších znalostí nebyl mitochondriální metabolismus l-laktátu v rakovinných buňkách zkoumán až do roku 2010, kdy byly publikovány první důkazy o mitochondriálním metabolismu l-laktátu v těchto buňkách (již v roce 2008 je uvedla Gabriella Chieppa ve své doktorské práci na univerzitě v Molise) (18). V tomto případě byly ke studiu transportu a metabolismu l-laktátu v mitochondriích izolovaných z normálních i nádorových buněk prostaty použity spektroskopické a polarografické techniky, při nichž byla sledována buď reakce m-l-LDH, nebo spotřeba kyslíku mitochondriemi, kterým byl dodán externě přidaný l-laktát (19), a nikoliv použití náročnějších postupů, dostupných v laboratořích molekulární biologie, genetiky a chemie. První dvě techniky byly zvoleny proto, že umožňují kontinuální sledování kinetiky zkoumaných procesů v experimentech trvajících několik minut, kdy mitochondrie zůstávají spojeny. Naproti tomu měření pomocí druhých metod se obvykle provádějí, jakmile jsou procesy již ukončeny. V souladu s tím zvýšení redoxního stavu intramitochondriálních pyridinových nukleotidů, jak bylo prokázáno fluorimetrickými měřeními, po přidání l-laktátu do mitochondrií naznačuje, že metabolismus l-laktátu probíhá uvnitř organel prostřednictvím NAD+-dependentního m-l-LDH; bohužel výskyt mitochondriálního metabolismu l-laktátu v nádorových buňkách nebyl ve Ferguson et al. (17) pravděpodobně proto, že autoři přehledu považují spektroskopické a polarografické techniky za „problematické“, přestože je řada vědců široce používá. To, že jejich názor je menšinový, lze ilustrovat citací z přehledu Mayevského a Rogatského (20), kde se uvádí, že „velké množství publikací různých skupin svědčí o cenných informacích získaných v různých experimentálních podmínkách. Sledování hladin NADH ve tkáni poskytuje nejdůležitější informace o metabolickém stavu mitochondrií“. Existenci m-l-LDH lze rovněž imunologicky potvrdit v mitochondriích, které jsou prokazatelně bez cytosolické kontaminace.
Všimněte si, že v případě, kdy se navrhuje, aby byl m-l-LDH lokalizován v mezimembránovém prostoru, se zvýšení intramitochondriální fluorescence pyridinových nukleotidů vysvětluje takto: l-laktát vstupuje do mitochondriálního mezimembránového prostoru, kde je oxidován na pyruvát, který zase přechází přes vnitřní membránu mitochondrie, aby byl oxidován uvnitř mitochondrie prostřednictvím pyruvátdehydrogenázového komplexu . Takový mechanismus není podpořen různými experimentálními nálezy. Například de Bari et al. (18) ukázali, že redukce NAD+ probíhá i přes přítomnost arsenitu, inhibitoru pyruvátdehydrogenázy, ale je inhibována oxamátem, inhibitorem l-LDH. Další důkaz proti přítomnosti m-l-LDH v mezimembránovém prostoru vyplývá z experimentálních výsledků, které ukazují, že l-laktát vstupuje do mitochondrií za podmínek, kdy je pyruvát neprostupnou sloučeninou (21) nebo kdy je pyruvát/H+ symportér blokován inhibitorem (6). Tyto experimentální přístupy lze v budoucnu použít i pro měření spotřeby kyslíku (v přítomnosti nebo nepřítomnosti ADP), protonového efluxu a generování membránového potenciálu. Použitím kritéria síly kontroly s různými nepenetrujícími inhibitory (19) lze zjistit, zda rychlost výše uvedených procesů odráží rychlost transportu l-laktátu přes mitochondriální membránu. Transport l-laktátu tak lze zkoumat kvantitativně, včetně výskytu hyperbolické kinetiky, profilu pH atd. Navíc porovnání provedené mezi profily inhibice mitochondriálních procesů závislých na pyruvátu a l-laktátu pomocí sloučenin, které nejsou schopny vstoupit do mitochondrií, umožňuje rozlišit mezi l-laktátovými a pyruvátovými přenašeči.
Krátce bylo také prokázáno, že zvenčí přidaný l-laktát může vstoupit do normálních i nádorových buněk prostaty a zejména přenašečovým způsobem vstupuje do jejich mitochondrií, kde existuje l-LDH a nachází se ve vnitřním kompartmentu. Bylo prokázáno, že m-l-LDH se liší od cytosolických enzymů, které se samy od sebe liší. Normální a nádorové buňky vykazují rozdíly, pokud jde o hladinu a aktivitu proteinu m-l-LDH, přičemž exprese i aktivita enzymu jsou vyšší u nádorových buněk.
V roce 2011 byla prokázána existence monokarboxylátového transportéru (MCT) a proteinů LDH v mitochondriálních retikulích buněčných linií karcinomu prsu (22). V tomto případě byla měřena exprese MCT i l-LDH a jejich mitochondriální lokalizace byla určena pomocí imunofluorescence, což je technika, která neumožňuje identifikovat submitochondriální lokalizaci.
Širší zkoumání transportu a metabolismu l-laktátu v mitochondriích nádorových buněk bylo provedeno u buněk lidského hepatocelulárního karcinomu (Hep G2) (21), ve kterých probíhá glukoneogeneze (23). Mitochondrie buněk Hep G2 (Hep G2-M) mají m-l-LDH omezený na vnitřní mitochondriální kompartment. Bylo také zjištěno, že cytosolová a mitochondriální l-LDH se od sebe liší kinetikou nasycení. Byl také prokázán výskyt transportu l-laktátu zprostředkovaného nosičem v těchto mitochondriích. Důležité je, že byl poprvé prokázán eflux různých metabolitů, včetně pyruvátu, oxaloacetátu, malátu a citrátu, v důsledku přidání l-laktátu do mitochondrií, což umožnilo poprvé nahlédnout do úlohy mitochondriálního metabolismu l-laktátu; v souladu s tím byl také prokázán výskyt l-laktát/pyruvátového člunu věnovaného oxidaci cytosolového NADH. Nakonec odstranění oxidačního produktu transportem zprostředkovaným přenašečem a mitochondriálním metabolismem překonává veškeré teoretické termodynamické obtíže, které byly považovány za vylučující jakoukoli oxidaci l-laktátu v mitochondriích.
Tyto výsledky silně naznačují, že je třeba revidovat dogmatický pohled na metabolismus glukózy se zvláštním zaměřením na úlohu l-laktátu a m-l-LDH v glukoneogenezi. Proto Coriho cyklus (formulovaný v roce 1929 jako energeticky náročná metabolická dráha u živočichů, kde atomy uhlíku glukózy procházejí po kruhové trase: svalový glykogen → krevní laktát → játra (kde probíhá glukoneogeneze) → krevní glukóza → svalová glukóza → svalový glykogen) vyžaduje rovněž revizi. V tomto ohledu se tradičně postuluje, že buněčná oxidace l-laktátu, která je nezbytná pro tvorbu glukózy v Coriho cyklu, probíhá v cytosolu, ale je tomu tak? Cytosolová l-LDH (c-l-LDH) je redukční enzym, závěrečný krok glykolytické dráhy, který přeměňuje pyruvát na l-laktát, a zajišťuje tak regeneraci NAD+. Tato reakce by měla probíhat bez omezení, nezávisle na přítomnosti nebo nepřítomnosti kyslíku, protože standardní změna volné energie (ΔG0′) přeměny pyruvátu na l-laktát je přibližně -6 kcal/mol. Kromě toho by vysoká afinita pyruvátu k c-l-LDH vysvětlovala skutečnost, že normální poměr / v krvi a jiných tkáních je >10, což je hodnota, která nemůže odpovídat návrhu pyruvátu jako konečného produktu glykolýzy za normálních podmínek. Proto je dogmatické líčení této reakce jako obousměrné zavádějící a bylo dosud přijímáno z důvodu neexistence možné alternativy. Tvrdíme, že oxidace l-laktátu zpět na pyruvát neprobíhá v cytosolu, ale že k ní dochází v mitochondriích. Ve skutečnosti existují pouze dvě možnosti, jak zabránit hromadění l-laktátu v cytosolu, buď je l-laktát transportován ven z buňky (za anaerobních podmínek) a/nebo je oxidován prostřednictvím m-l-LDH při jeho transportu do mitochondrie (za aerobních podmínek). Proto i kdybychom souhlasili s Lu et al. (24), že „většina pyruvátu získaného glykolýzou je odkloněna k laktátové fermentaci“, nemůžeme souhlasit s tím, že l-laktát je „držen stranou od mitochondriálního oxidativního metabolismu“.
Zvlášť zajímavá je skutečnost, že pyruvát nemůže vstoupit do Hep G2-M . Na rozdíl od malátu + glutamátu a l-laktátu totiž externě přidaný pyruvát nezpůsobuje ani spotřebu kyslíku, ani tvorbu membránového potenciálu . Všimněte si, že poruchu transportu pyruvátu v nádorových buňkách zaznamenali Paradies et al (25). Proto nezávisle na teoretické neuskutečnitelnosti oxidace l-laktátu v cytosolu, jak bylo vysvětleno výše, nemůže v buňkách Hep G2 probíhat klasický Coriho cyklus. Proto nabízíme revidovaný Coriho cyklus (obr. 1), který zahrnuje jak mitochondriální přenašeče, které zprostředkovávají provoz závislý na l-laktátu, tak m-l-LDH, který zajišťuje pyruvát uvnitř mitochondrií. V souladu s tím výskyt oxaloacetátu a malátu mimo mitochondrie, které pocházejí z vychytávání a metabolismu l-laktátu prostřednictvím m-l-LDH, pyruvátdehydrogenázy, pyruvátkarboxylázy a malátdehydrogenázy a výměnou, pravděpodobně díky antiportérům l-laktát/oxaloacetát a l-laktát/malát, potvrzuje anaplerotickou úlohu l-laktátu v glukoneogenezi, v níž hrají mitochondrie jedinečnou roli. Důležité je, že přídavek l-laktátu do Hep G2-M vede ke vzniku citrátu, prekurzoru mastných kyselin, mimo mitochondrie. V souladu s tím bylo pomocí hmotnostní spektrometrie s vysokým rozlišením zjištěno vychytávání l-laktátu do mitochondrií buněk HeLa a H460 a prokázáno, že vede k syntéze lipidů; transmisní elektronová mikroskopie navíc potvrdila, že LDH je lokalizována v mitochondriích (26). Je překvapivé, že při „přešetřování“ metabolismu rakoviny nebyla vzata v úvahu anaplerotická úloha mitochondriálního metabolismu l-laktátu (27).
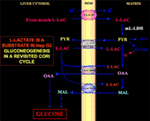
Obrázek 1. Coriho cyklus přehodnocený v buňkách Hep G2. Vzhledem k tomu, že pyruvát nemůže vstoupit do Hep G2-M, jak ukázali Pizzuto et al. (21), l-laktát produkovaný ve svalech se do jater dostává krevním řečištěm a z cytosolu vstupuje do mitochondrií; v matrix metabolismus l-laktátu dává vzniknout pyruvátu (PYR) prostřednictvím m-L-LDH a následně oxaloacetátu (OAA) a malátu (MAL), které jsou exportovány z mitochondrií do cytosolu prostřednictvím tří předpokládaných přenašečů, aby byly využity pro l-laktát pyruvátový shuttle a aby došlo ke glukoneogenezi mechanismem podobným tomu, který již prokázali de Bari et al. (6).
Domníváme se, že navrhovaná revize Coriho cyklu, která je nezbytná pro buňky Hep G2, by měla být zvážena i u všech ostatních typů buněk, kde je aktivní mitochondriální metabolismus l-laktátu. Například částečná rekonstrukce glukoneogeneze in vitro vznikající z mitochondriálního vychytávání/metabolismu l-laktátu byla prokázána v nepřítomnosti LDH mimo mitochondrie (6).
Úloha mitochondriálního metabolismu l-laktátu si zaslouží další pozornost: Vzhledem k tomu, že produkce peroxidu vodíku v nádorovém mikroprostředí podporuje anabolický růst nádorových buněk (28), měla by být prozkoumána možná úloha předpokládané mitochondriální l-laktát oxidázy (LOX), která vytváří peroxid vodíku v mitochondriích jater potkanů (29); existence LOX v Hep G2-M se zdá být v souladu s důkazy, že rotenon, který blokuje spotřebu kyslíku vyvolanou přídavkem malátu + glutamátu, nedokáže inhibovat spotřebu kyslíku vyvolanou přídavkem l-laktátu.
Příspěvky autorů
SP tento názor vymyslel, sdílel ho a napsal společně s AS.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Recenzent prohlásil zpracovávajícímu redaktorovi společnou afiliaci bez spolupráce s jedním z autorů
1. Dianzani MU. Distribuce oxidázy kyseliny mléčné v jaterních a ledvinových buňkách normálních potkanů a potkanů s tukovou degenerací jater. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Vytrvalostní trénink, exprese a fyziologie LDH, MCT1 a MCT4 v lidském kosterním svalu. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. Transport L-laktátu do mitochondrií srdce potkana a rekonstrukce kyvadlové dopravy L-laktátu/pyruvátu. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Částečná rekonstrukce glukoneogeneze in vitro vyplývající z mitochondriálního příjmu/metabolismu L-laktátu a exportu oxaloacetátu prostřednictvím nových L-laktátových translokátorů. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Laktát: konečný substrát mozkové oxidativní energie? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Laktát, nikoli pyruvát, je konečným produktem neuronální aerobní glykolýzy: elektrofyziologická studie in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Důkaz o existenci mitochondriálního komplexu oxidace laktátu v neuronech potkanů: klíčová složka pro kyvadlovou dopravu laktátu mozkem. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport a metabolismus L-laktátu probíhají v mitochondriích z buněk mozečkových granulí a jsou modifikovány v buňkách procházejících apoptózou závislou na nízkém obsahu draslíku. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. The mitochondrial L-lactate dehydrogenase affair. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Při kapacitaci kančích spermií přispívají L-laktát a sukcinát, ale ne pyruvát a citrát, ke zvýšení mitochondriálního membránového potenciálu sledovaného pomocí fluorescence safraninu O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. Výskyt L-laktátdehydrogenázy ve vnitřním mitochondriálním kompartmentu prasečích jater. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-laktátový metabolismus v mitochondriích bramborových hlíz. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Cell-cell and intracellular lactate shuttles (Přesuny laktátu mezi buňkami a uvnitř buněk). J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Mozková glykolýza: století přetrvávajících nedorozumění a mylných představ. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolismus laktátu: historické souvislosti, dřívější chybné interpretace a současné poznatky. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. Metabolismus L-laktátu může probíhat v normálních a nádorových buňkách prostaty prostřednictvím nové mitochondriální L-laktátdehydrogenázy. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Úloha mitochondriálního transportu v energetickém metabolismu. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitochondriální funkce in vivo hodnocená pomocí fluorescence NADH: od zvířecích modelů ke studiím na lidech. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Metabolismus L-laktátu v mitochondriích buněk HEP G2 díky L-laktátdehydrogenáze určuje výskyt kyvadlové dopravy laktátu/pyruvátu a výskyt oxaloacetátu, malátu a citrátu mimo mitochondrie. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. září 2012. Hussien R, Brooks GA. Exprese mitochondriálního a plazmatického membránového laktátového transportéru a izoforem laktátdehydrogenázy v buněčných liniích karcinomu prsu. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Establishment and characterization of a novel method for evaluating gluconeogenesis using hepatic cell lines, H4IIE and HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstrakt | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. The Warburg effect in tumor progression: mitochondrial oxidative metabolism as an anti-metastasis mechanism. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Srov. např. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport pyruvátu v mitochondriích z různých nádorových buněk. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Laktátový metabolismus je spojen s mitochondriemi savců. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Opětovné zkoumání metabolismu rakoviny: produkce laktátu pro karcinogenezi by mohla být účelem a vysvětlením Warburgova efektu. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Plný text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically „fertilize“ the tumor microenvironment with hydrogen peroxid, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-laktát generuje peroxid vodíku v purifikovaných jaterních mitochondriích potkana díky předpokládané L-laktát oxidáze lokalizované v intermembránovém prostoru. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar
.