肝臓や腎臓でグルコース前駆体となるほか、ほとんどの細胞でピルビン酸に酸化されてエネルギー基質になると認識されているl-Lactate。 この酸化は細胞質で起こり、乳酸デヒドロゲナーゼによって触媒され、ピルビン酸はその後ミトコンドリアで異化されると考えられている。 Dianzaniによりミトコンドリア型乳酸脱水素酵素(m-l-LDH)の存在が示唆され(1)、その後BabaとSharmaによりミトコンドリア基質に存在することが示された(2)(3)。 実際、骨格筋(4)ラット心臓(5)、肝臓(6)、脳(7-9)、小脳顆粒細胞(10)、ウサギ腓腹筋(11)、精子細胞(12)、豚肝臓(13)、さらには植物(14)など様々なミトコンドリアにおいて l-lactate 輸送と代謝が示された。 こうして、Passarellaら(3)、Brooks(15)、Schurr(16)がレビューしたm-l-LDHの存在は、MitoCarta(http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl)に収録されて認識されるようになったのです。 予想されるように、マトリックス中のl-LDHの存在に照らして、l-乳酸のためのキャリアの出現が、精製された結合ミトコンドリアを用いた機能的研究において示されている。 その中には、乳酸/H+シンポータ、乳酸/ピルビン酸および乳酸/オキサロ酢酸アンチポータが含まれている(3)。 しかし、ミトコンドリア内にm-l-LDHが存在するという圧倒的な証拠は、意外にも万人に受け入れられるものではなく、m-l-LDHの存在に懐疑的な研究者もいれば、膜間隙に局在しているとする研究者もいる(17)。 このような懐疑的な見解は、特に骨格筋のサンプルでは簡単ではない結合ミトコンドリアの単離が困難であることや、反応液の選択と適切な濃度の阻害剤の使用が十分でないことに起因していると我々は考えている(11)。 m-l-LDHがミトコンドリア内部に局在していることは、以下に示すとおりです。
がん細胞のミトコンドリアでl-乳酸が輸送され代謝されているか
はい、されています。 1920年代にウォーバーグは、がん細胞はl-乳酸の産生を伴う解糖によるATP生産を好むことを発見したが、我々の知る限り、がん細胞におけるl-乳酸のミトコンドリア代謝については、2010年に初めて(2008年にGabriella Chieppaがモリーゼ大学の博士論文で既に報告)発表するまで調査されていなかった(18)。 この研究では、正常および癌の前立腺細胞から分離したミトコンドリアにおけるl-乳酸の輸送と代謝を研究するために、分子生物学、遺伝学、化学の研究室で利用できるより複雑な手順ではなく、外部からl-乳酸を添加したミトコンドリアによる酸素消費とm-l-LDH反応をそれぞれモニターする分光法とポーラログラフィー法が使用されました(19)。 前者2つの方法は、ミトコンドリアが結合したまま数分間続く実験において、研究対象プロセスの動態を連続的にモニターすることができるため、選択された。 一方、後者の方法は、通常、プロセスが完了した後に測定される。 したがって、ミトコンドリアに l-lactate を添加すると、蛍光測定によってミトコンドリア内のピリジンヌクレオチドの酸化還元状態が上昇することから、NAD+依存性の m-l-LDH を介して細胞内で l-lactate の代謝が起こっていることがわかる。残念ながら Ferguson らは癌細胞におけるミトコンドリアの l-lactate 代謝の発生を引用していない。 (17)は、おそらく、このレビューの著者が、多くの科学者によって広く使われているにもかかわらず、分光学的およびポーラログラフィック技術を「問題がある」とみなしているためと思われる。 彼らの意見が少数派であることは、Mayevsky and Rogatsky (20)のレビューから引用することで例証できるかもしれない。 組織中のNADHレベルのモニタリングは、ミトコンドリアの代謝状態に関する最も重要な情報を提供する。”と述べている。 m-l-LDHの存在は、細胞質汚染がないことが証明されたミトコンドリアにおいて、免疫学的に確認することもできる。
m-l-LDHが膜間隙に局在することが提案されている場合、ミトコンドリア内のピリジンヌクレオチド蛍光の増加は、l-乳酸がミトコンドリア膜間隙に入り、そこでピルビン酸に酸化され、それがミトコンドリア内膜を横断してピルビン酸脱水素酵素複合体を介してミトコンドリア内で酸化されるというように説明されていることに注意する。 このようなメカニズムは、様々な実験結果からは支持されていない。 例えば、de Bariら(18)は、ピルビン酸脱水素酵素の阻害剤である亜砒酸が存在してもNAD+の還元は進行するが、l-LDHの阻害剤であるオキサミン酸では阻害されることを示している。 また、ピルビン酸が非浸透性化合物である場合(21)、あるいはピルビン酸/H+シンポータが阻害剤で阻害された場合(6)、乳酸がミトコンドリアに入るという実験結果から、膜間隙にm-l-LDHが存在しないことが示唆される。 これらの実験的アプローチは、将来的には酸素消費量(ADP存在下または非存在下)、プロトン流出量、膜電位発生量の測定にも応用可能である。 様々な非貫通阻害剤による制御強度基準(19)を適用することにより、上記のプロセスの速度がミトコンドリア膜を横切るl-乳酸輸送の速度を反映しているか否かを確立することができる。 したがって、l-乳酸輸送は、双曲線的な動力学の発生、pHプロファイルなどを含む定量的な調査が可能である。 さらに、ミトコンドリアに入ることができない化合物の使用を通じて、ピルビン酸およびl-乳酸依存性ミトコンドリアプロセスの阻害プロファイルの間で行われる比較は、l-乳酸およびピルビン酸キャリアを区別することを可能にする<995><2080>簡潔に言えば、外部から加えたl-乳酸が正常および癌前立腺細胞の両方に入り、特に、キャリア媒介様式で、そのミトコンドリアに入って、l-LDHが存在して内部区画に存在することも明らかにされている。 m-l-LDHは、それ自体が細胞質酵素とは異なることが実証されている。 正常細胞と癌細胞では、m-l-LDHのタンパク質量と活性に関して違いが見られ、癌細胞では酵素の発現と活性の両方が高い。
2011年に、乳癌細胞株のミトコンドリア網様体にモノカルボン酸トランスポーター(MCT)とLDHタンパク質が存在することが実証された(22)。 その際、MCTとl-LDHの両方の発現を測定し、それらのミトコンドリア局在を免疫蛍光法によって決定したが、この手法ではサブトコンドリア局在を特定することはできない。
がん細胞のミトコンドリアにおけるl-乳酸の輸送と代謝について、より幅広い調査が、グルコネーゼが行われるヒト肝細胞がん(Hep G2)細胞(21)で行われた(23). Hep G2 細胞のミトコンドリア(Hep G2-M)は、内側のミトコンドリアコンパートメントに限定された m-l-LDH を有している。 細胞質L-LDHとミトコンドリアL-LDHは、その飽和速度が互いに異なることも明らかになった。 これらのミトコンドリアでは、キャリアーを介したl-乳酸輸送の発生も示されている。 また、乳酸のミトコンドリアへの添加により、ピルビン酸、オキサロ酢酸、リンゴ酸、クエン酸などの代謝物が排出されることが初めて示され、乳酸のミトコンドリア代謝の役割が初めて明らかにされ、細胞質NADHの酸化に伴う乳酸/ピルビン酸シャトルの発生が示された。 これらの知見は、グルコース代謝に関する独断的な見解の見直しが必要であることを強く示唆しており、特にグルコネーゼにおける乳酸とm-l-LDHの役割に焦点が当てられている。 したがって、コリサイクル(1929年、動物のエネルギー要求型代謝経路として定式化された。グルコースの炭素原子が、筋グリコーゲン→血中乳酸→肝臓(ここで糖新生が起こる)→血糖→筋グルコース→筋グリコーゲンという循環経路を通る)も、見直しが必要である。 この点、コリサイクルでのグルコース生成に必要な細胞内l-乳酸酸化は、従来、細胞質で行われると想定されてきたが、果たしてそうだろうか? 細胞質L-LDH(c-l-LDH)は、解糖系経路の最終段階である還元酵素で、ピルビン酸をL-乳酸に変換し、NAD+を再生する役割を担っている。 この反応は、ピルビン酸からl-乳酸への変換の標準自由エネルギー(ΔG0′)変化が約-6 kcal/molであることから、酸素の有無に関係なく、衰えることなく進行するはずである。 また、ピルビン酸のc-l-LDHに対する親和性が高いことは、血液や他の組織における正常な/比が>10であることの説明になる。この値は、通常の条件下では解糖の最終生成物としてピルビン酸を提案することと一致し得ない値である。 したがって、この反応を双方向性とする独断的な描写は誤解を招くものであり、代替となりうるものがないために今日まで受け入れられてきたのである。 我々は、乳酸が酸化されてピルビン酸に戻るのは細胞質ではなく、ミトコンドリア内で起こることを主張する。 実際、乳酸が細胞質に蓄積するのを防ぐには、乳酸が細胞外に輸送されるか(嫌気性条件下)、ミトコンドリア内に輸送される際にm-l-LDHを介して酸化されるか(好気性条件下)の2つの選択肢しかないのである。 したがって、「解糖由来のピルビン酸の大部分は乳酸発酵に転用される」というLuら(24)の意見に同意するとしても、l-乳酸が「ミトコンドリアの酸化代謝から遠ざけられる」ことは認められない。
特に興味深いのは、ピルビン酸がHep G2-Mに入ることができない点である。 実際、リンゴ酸+グルタミン酸やl-乳酸とは逆に、外部から加えたピルビン酸は酸素消費も膜電位発生も起こさない. 癌細胞におけるピルビン酸輸送の障害は、Paradiesらによって報告されている(25)ことに注目されたい。 したがって、細胞質での乳酸酸化が理論的に不可能であることとは別に、先に説明したように、Hep G2細胞では古典的なCoriサイクルは起こり得ないのである。 そこで、我々は、l-乳酸依存的な輸送を媒介するミトコンドリア担体と、ミトコンドリア内でピルビン酸を供給するm-l-LDHの両方を含む修正Coriサイクル(図1)を提案する。 したがって、m-l-LDH、ピルビン酸デヒドロゲナーゼ、ピルビン酸カルボキシラーゼ、リンゴ酸デヒドロゲナーゼによるl-乳酸の取り込みと代謝、およびl-乳酸/オキサロ酢酸およびl-乳酸/リンゴ酸アンチポーターによる交換によって生じるオキサロ酢酸およびリンゴ酸がミトコンドリア外に出現し、糖新生におけるl-乳酸のアナプラーゼ的役割がミトコンドリア独自の役割として確認されることになる。 重要なことは、Hep G2-Mにl-乳酸を添加すると、脂肪酸前駆体であるクエン酸がミトコンドリアの外側に出現することである。 また、HeLa 細胞および H460 細胞のミトコンドリアへの l-lactate の取り込みを高分解能質量分析計で確認し、脂質合成が起こることを証明した。さらに、透過電子顕微鏡で LDH がミトコンドリア内に局在していることを確認した(26)。 驚くべきことに、癌の代謝が「再検討」されたとき、l-乳酸ミトコンドリア代謝のアポトーシス的役割は考慮されなかった(27)
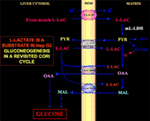
Figure 1. Hep G2細胞におけるコリサイクルの再検討。 ピルビン酸がHep G2-Mに入ることができないことを考えると、Pizzutoらで示されたように、ピルビン酸はHep G2-Mに入ることができない。 (21)で示したように、筋肉で産生されたl-乳酸は血流を介して肝臓に達し、サイトゾルからミトコンドリアに入る。 マトリックスでは、乳酸代謝はm-L-LDHを介してピルビン酸(PYR)を生じ、次にオキサロ酢酸(OAA)とリンゴ酸(MAL)を生じ、これらは3つの推定キャリアを介してミトコンドリアから細胞質へ輸送され、de Bariらがすでに示したものと同様の機構で乳酸ピルビン酸シャトルとグルコネーゼに使用されている。 (6).
我々は、Hep G2細胞に必要なCoriサイクルの修正案は、l-乳酸のミトコンドリア代謝が活発な他のすべての種類の細胞でも考慮されるべきであると考える。 例えば、ミトコンドリアのl-乳酸の取り込み/代謝から生じるin vitroの糖新生の部分的な再構成は、ミトコンドリア外のLDHの非存在下で示された(6)。
ミトコンドリアのl-乳酸代謝の役割は、さらに注目されるべきである。 腫瘍の微小環境における過酸化水素の産生が癌細胞の同化成長を促進することを考えると(28)、ラット肝ミトコンドリアにおいて過酸化水素を生成する推定ミトコンドリアL-乳酸酸化酵素(LOX)の役割を調査すべきである(29)。Hep G2-M におけるLOXの存在は、リンゴ酸+グルタミン酸添加による酸素消費を阻害するロテノンが、L-乳酸添加による酸素消費を阻害しない証拠と一致するようである。
著者貢献
SPはこの意見を考案し、ASと共有し、論文を書いた。
利益相反声明
著者は、潜在的利益相反と解釈できるいかなる商業または金銭的関係もない状態で研究を実施したことを宣言した。
査読者は、ハンドリングエディターに対して、著者の一人と共同研究を行わず、共有の所属を宣言した。
1. Dianzani MU. 正常ラットおよび肝脂肪変性症ラットの肝および腎細胞における乳酸オキシダーゼの分布。 Arch Fisiol (1951) 50:181-6.
Google Scholar
2. 馬場N、シャルマHM.M.S. (1951) 50:181-6.
Google Scholar
2. このような状況下において、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一つとして、「ミトコンドリアとL-乳酸代謝」を取り上げました。 FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H、バターフィールドGE、ウォルフェルEE、ベルグマンBC、ブルックスGA. ヒト骨格筋におけるLDH、MCT1、MCT4の持久力トレーニング、発現、生理機能。 Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5.邦題:「邦題:邦題:邦題をつけられたら」、「邦題をつけられたら」、「邦題をつけられたら」。 このような状況下において、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」を実施した。 また、”Biochem J” (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6.de Bari L, Atlante A, Valenti D, Passarella S. このように、ミトコンドリアによるL-乳酸の取り込み/代謝と新規L-乳酸トランスロケーターによるオキサロ酢酸の輸出から生じるin vitroでの糖新生の部分的再構築。 また、このような研究成果をもとに、「糖新生」、「糖鎖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖新生」、「糖質」、「乳酸」「乳酸」「酸化性乳酸菌」の4つをキーワードとした研究を進めている。 J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8.Schurr A, Payne RS.(以下Schurr Aとする):(以下Schurr RSとする):(以下SCHとする):(以下SCHとする):(以下SCHとする):(以下SCHとする): 1. 神経細胞の好気性解糖最終生成物はピルビン酸ではなく乳酸である:in vitro電気生理的研究。 Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9.神経細胞における好気性解糖の最終生成物はピルビン酸ではなく乳酸である。 Hashimoto T, Hussien R, Cho H-S, Kaufer D, ブルックスGA. ラット神経細胞におけるミトコンドリア乳酸酸化複合体の証拠:脳内乳酸シャトルの重要な構成要素である。 PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. その結果、L-乳酸の輸送と代謝は小脳顆粒細胞のミトコンドリアで起こり、低カリウム依存性アポトーシスを受けた細胞では修飾されることを明らかにした。 Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. The mitochondrial L-lactate dehydrogenase affair(ミトコンドリアL-乳酸デヒドロゲナーゼの情況。 Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. In boar spacitation L-lactate and succinate, but not pyruvate and citrate, contribute to the mitochondrial membrane potential increase as monitored via safranine O fluorescence.ブタの精子の受精能において、ピルビン酸やクエン酸ではなく、L-乳酸とコハク酸がミトコンドリア膜電位の上昇に寄与している。 Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver.(ブタ肝臓の内部ミトコンドリアコンパートメントにおけるL-乳酸デヒドロゲナーゼの存在)。 Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14.ブタ肝のミトコンドリア内コンパートメントに存在するL-乳酸デヒドロゲナーゼの存在(Biochem Biophys Res Commun) 489:255-61. Paventi G, Pizzuto R, Chieppa G, Passarella S. ジャガイモ塊茎のミトコンドリアにおけるL-乳酸代謝. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. 細胞-細胞間の乳酸シャトルと細胞内の乳酸シャトル。 J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Cerebral glycolysis: a century of persistent misunderstanding and misconception. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ファーガソンBS、ロガツキMJ、グッドウィンML、ケインDA、ライトマイアZ、グラッデンLB.BS、ロガツキMJ、グッドウィンML、ケインDA、ライトマイアZ、グラッデンLB. 乳酸代謝:歴史的背景、事前の誤認識、および現在の理解。 Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-lactate metabolism can occur in normal and cancer prostate cells via the novel mitochondrial L-lactate dehydrogenase.L-L-乳酸代謝は、正常および癌の前立腺細胞で起こる。 Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. The role of mitochondrial transport in energy metabolism. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. メイエフスキーA、ロガツキーGG. NADH蛍光で評価する生体内ミトコンドリア機能:動物モデルからヒト研究まで。 Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-lactate dehydrogenaseによるHEP G2細胞ミトコンドリアでのL-乳酸代謝は、乳酸/ピルビン酸シャトルの発生とミトコンドリア外でのオキサロ酢酸、リンゴ酸、クエン酸の出現を決定している。 Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. 乳がん細胞株におけるミトコンドリアおよび細胞膜の乳酸トランスポーターと乳酸脱水素酵素のアイソフォームの発現。 Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. 肝細胞株H4IIEとHepG2を用いた新規糖新生評価法の確立とその特性評価.岡本太郎, 金本直樹, 伴哲也, 須藤崇, 長野和彦, 仁木勇夫. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. The Warburg effect in tumor progression: Mitochondrial oxidative metabolism as an anti-metastasis mechanism.腫瘍の進行におけるワールブルグ効果:抗転移メカニズムとしてのミトコンドリア酸化代謝。 Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport of pyruvate in mitochondria from different tumor cells. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26.Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. がん代謝の再検討:発がんのための乳酸産生は、ワールブルグ効果の目的と説明になり得る。 Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. がん細胞は代謝的に過酸化水素で腫瘍微小環境を「肥やし」、ウォーバーグ効果を駆動する:ヒト腫瘍のPETイメージングへの示唆。 Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactate generates peroxide in purified rat liver mitochondria due to the Putative L-lactate oxidase localized in the interembembrane space. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar