Inom att vara en glukosprekursor i lever och njure erkänns l-laktat nu också som ett energisubstrat i de flesta celler via dess oxidation till pyruvat. Denna oxidation, som antas ske i cytosolen, katalyseras av l-laktatdehydrogenas med pyruvat som därefter kataboliseras i mitokondrierna. Nyligen erkändes dock att mitokondrier spelar en roll i l-laktatmetabolismen: förekomsten av ett mitokondriskt l-laktatdehydrogenas (m-l-LDH) föreslogs av Dianzani (1) och senare visades av Baba och Sharma (2) att det fanns i mitokondriernas matris (3). Transport och metabolism av l-laktat har faktiskt visats i olika mitokondrier, inklusive skelettmuskulatur (4), råtthjärta (5), lever (6), hjärna (7-9), cerebellära granuleceller (10), gastrocnemius hos kanin (11), spermaceller (12), grislever (13) och till och med växter (14). Existensen av m-l-LDH, som granskats av Passarella et al. (3), Brooks (15) och Schurr (16), erkändes således genom att den inkluderades i MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Som förväntat, mot bakgrund av närvaron av l-LDH i matrisen, har förekomsten av bärare för l-laktat visats i funktionella studier med renade, kopplade mitokondrier. Dessa inkluderar l-laktat/H+-symportören och l-laktat/pyruvat- och l-laktat/oxaloacetat-antiportörerna (3). Överraskande nog är de överväldigande bevisen för att m-l-LDH finns inuti mitokondrier inte allmänt accepterade, och vissa forskare är fortfarande skeptiska till existensen av m-l-LDH, medan andra lokaliserar m-l-LDH i intermembranutrymmet (17). Vi anser att skepticismen kan bero på svårigheter att isolera kopplade mitokondrier, vilket inte är en lätt uppgift, särskilt när det gäller skelettmuskelprover, eller på att man inte är tillräckligt noggrann när man väljer reaktionsmedium och använder hämmare i rätt koncentration (11). Att m-l-LDH är lokaliserad inuti mitokondrier kommer att visas nedan.
Transporteras och metaboliseras l-Lactat i cancercellers mitokondrier?
Ja, det gör det. Även om Warburg på 1920-talet konstaterade att cancerceller föredrar att producera ATP genom glykolys med produktion av l-laktat, hade såvitt vi vet inte den mitokondriella metabolismen av l-laktat undersökts i cancerceller förrän 2010, då de första bevisen för l-laktatmitokondriell metabolism i dessa celler (som redan 2008 rapporterades av Gabriella Chieppa i hennes doktorsavhandling vid universitetet i Molise) publicerades (18). För att studera transport och metabolism av l-laktat i mitokondrier som isolerats från både normala prostataceller och cancerceller användes spektroskopiska och polarografiska tekniker där antingen m-l-LDH-reaktionen eller syreförbrukningen i mitokondrier som tillförts externt l-laktat övervakades (19), i stället för att använda mer komplicerade förfaranden som finns tillgängliga i laboratorier för molekylärbiologi, genetik och kemi. De två förstnämnda teknikerna valdes eftersom de gör det möjligt att kontinuerligt övervaka de undersökta processernas kinetik i experiment som pågår i flera minuter när mitokondrierna förblir kopplade. Mätningar med de senare metoderna görs däremot vanligen när processerna redan har avslutats. En ökning av redoxtillståndet hos de intramitokondriella pyridinnukleotiderna, som visas genom fluorimetriska mätningar, vid tillsats av l-laktat till mitokondrier tyder på att l-laktatmetabolismen sker inuti organellerna via en NAD+ -beroende m-l-LDH; tyvärr angavs inte förekomsten av mitokondriell l-laktatmetabolism i cancerceller i Ferguson et al. (17), möjligen för att författarna till översikten anser att de spektroskopiska och polarografiska teknikerna är ”problematiska”, trots att de används i stor utsträckning av många forskare. Att deras åsikt är en minoritetsåsikt kan exemplifieras med ett citat från en översikt av Mayevsky och Rogatsky (20), där det står att ”Det stora antalet publikationer från olika grupper vittnar om den värdefulla information som samlats in under olika experimentella förhållanden. Övervakningen av NADH-nivåerna i vävnaden ger den viktigaste informationen om mitokondriernas metaboliska tillstånd”. Förekomsten av m-l-LDH kan också bekräftas immunologiskt i mitokondrier som bevisligen är fria från cytosolisk kontaminering.
Observera att i det fall då m-l-LDH föreslås vara lokaliserad i intermembranutrymmet, förklaras ökningen av den intramitokondriska pyridinnukleotidfluorescensen på följande sätt: l-laktat kommer in i det mitokondriella intermembranutrymmet där det oxideras till pyruvat, som i sin tur korsar det mitokondriella inre membranet för att oxideras inne i mitokondrierna via pyruvatdehydrogenaskomplexet . En sådan mekanism stöds inte av olika experimentella resultat. I de Bari et al. (18) visades till exempel att NAD+-reduktionen fortsätter trots närvaro av arsenit, en hämmare av pyruvatdehydrogenas, men att den hämmas av oxamat, en hämmare av l-LDH. Ytterligare bevis mot förekomsten av m-l-LDH i intermembranutrymmet kommer från experimentella resultat som visar att l-laktat kommer in i mitokondrierna under förhållanden där pyruvat är en icke-penetrerande förening (21) eller där pyruvat/H+-symportern blockeras av en hämmare (6). Dessa experimentella metoder kan också tillämpas på mätningar av syreförbrukning (i närvaro eller frånvaro av ADP), protonutflöde och membranpotentialgenerering i framtiden. Genom att tillämpa kriteriet för kontrollstyrka med olika icke-penetrerande hämmare (19) kan man fastställa om hastigheten för ovanstående processer speglar hastigheten för l-laktattransport genom mitokondriernas membran eller inte. På så sätt kan l-laktattransporten undersökas kvantitativt, inklusive förekomsten av hyperbolisk kinetik, pH-profil osv. Dessutom kan man genom att jämföra hämningsprofilerna för pyruvat- och l-laktatberoende mitokondriella processer med hjälp av föreningar som inte kan ta sig in i mitokondrier skilja mellan l-laktat- och pyruvatbärare.
Kortfattat har det också visats att externt tillsatt l-laktat kan ta sig in i både normala och cancerprostataceller, och framför allt, på ett bärarmedierat sätt, ta sig in i deras mitokondrier, där det finns en l-LDH och den är belägen i det inre facket. Det har visats att m-l-LDH:erna skiljer sig från de cytosoliska enzymerna som i sin tur skiljer sig från varandra. Normala celler och cancerceller uppvisar skillnader med avseende på m-l-LDH-proteinnivå och aktivitet, där både enzymexpressionen och aktiviteten är högre i cancerceller.
Under 2011 påvisades förekomsten av monokarboxylattransportör- (MCT) och LDH-proteiner i mitokondriella retiklar i bröstcancercellinjer (22). I det fallet mättes uttrycket av både MCT och l-LDH och deras mitokondriella lokalisering bestämdes via immunofluorescens, en teknik som inte gör det möjligt att identifiera den submitokondriella lokaliseringen.
En bredare undersökning av l-laktattransport och metabolism i cancercellers mitokondrier genomfördes i celler av humant hepatocellulärt karcinom (Hep G2) (21) där glukoneogenes äger rum (23). Hep G2-cellens mitokondrier (Hep G2-M) har en m-l-LDH som är begränsad till det inre mitokondriella kompartmentet. Cytosoliska och mitokondriella l-LDH:er visade sig också skilja sig från varandra i deras mättnadskinetik. Det har också visats att det förekommer en transportörmedierad l-laktattransport i dessa mitokondrier. Viktigt är att man för första gången visade utflödet av olika metaboliter, inklusive pyruvat, oxaloacetat, malat och citrat, till följd av tillsats av l-laktat till mitokondrier, vilket gav en första inblick i den mitokondriella ämnesomsättningens roll för l-laktat. I slutändan övervinner avlägsnandet av oxidationsprodukten genom transportmedierad transport och mitokondriell metabolism alla teoretiska termodynamiska svårigheter som ansågs utesluta all oxidation av l-laktat i mitokondrierna.
Dessa fynd tyder starkt på att det behövs en översyn av den dogmatiska synen på glukosmetabolismen, med särskild inriktning på l-laktats och m-l-LDH:s roll i glukoneogenesen. Därför kräver Cori-cykeln (formulerad 1929 som en energikrävande metabolisk väg hos djur, där glukosens kolatomer passerar längs den cirkulära vägen: muskelglykogen → blodlaktat → lever (där glukoneogenesen sker) → blodglukos → muskelglukos → muskelglykogen) också en översyn. I detta avseende har cellulär l-laktatoxidation, som är nödvändig för produktion av glukos i Cori-cykeln, traditionellt postulerats äga rum i cytosolen, men är det verkligen så? Den cytosoliska L-LDH (c-l-LDH) är ett reducerande enzym, det sista steget i den glykolytiska vägen, som omvandlar pyruvat till l-laktat och därmed ger förnyelse av NAD+. Denna reaktion bör fortgå oavbrutet, oberoende av om syre är närvarande eller inte, eftersom standardförändringen av den fria energin (ΔG0′) vid omvandling av pyruvat till l-laktat är cirka -6 kcal/mol. Dessutom skulle pyruvatets höga affinitet till c-l-LDH förklara det faktum att det normala / förhållandet i blod och andra vävnader är >10, ett värde som inte kan motsvara förslaget om pyruvat som slutprodukt av glykolysen under normala förhållanden. Därför är den dogmatiska framställningen av denna reaktion som dubbelriktad missvisande och har hittills accepterats på grund av avsaknaden av ett möjligt alternativ. Vi hävdar att oxidation av l-laktat tillbaka till pyruvat inte sker i cytosolen, utan snarare i mitokondrierna. Det finns faktiskt bara två alternativ för att förhindra ackumulering av l-laktat i cytosolen, antingen transporteras l-laktat ut ur cellen (under anaeroba förhållanden) och/eller oxideras via m-l-LDH när det transporteras in i mitokondrien (under aeroba förhållanden). Även om vi håller med Lu et al. (24) om att ”majoriteten av det pyruvat som härrör från glykolysen avleds till laktatjäsning” kan vi därför inte acceptera att l-laktat ”hålls borta från mitokondriell oxidativ ämnesomsättning.”
Av särskilt intresse är det faktum att pyruvat inte kan komma in i Hep G2-M. I motsats till malat + glutamat och l-laktat kan externt tillsatt pyruvat faktiskt inte orsaka vare sig syreförbrukning eller generering av membranpotential . Observera att en försämrad pyruvattransport i cancerceller har rapporterats av Paradies et al. (25). Oberoende av den teoretiska omöjligheten att oxidera l-laktat i cytosolen, vilket förklarades ovan, kan därför den klassiska Cori-cykeln inte inträffa i Hep G2-celler. Därför erbjuder vi en reviderad Cori-cykel (figur 1), som inbegriper både de mitokondriella bärare som förmedlar den l-laktatberoende trafiken och m-l-LDH, som tillhandahåller pyruvat inne i mitokondrierna. Att det utanför mitokondrierna förekommer oxaloacetat och malat som härrör från upptag och metabolism av l-laktat via m-l-LDH, pyruvatdehydrogenas, pyruvatkarboxylas och malatdehydrogenas och genom utbyten, troligen på grund av l-laktat/oxaloacetat- och l-laktat/malat-antiporters, bekräftar följaktligen att l-laktat spelar en anaplerotisk roll för glukoneogenesen där mitokondrierna spelar en unik roll. Det är viktigt att tillägget av l-laktat till Hep G2-M resulterar i att citrat, fettsyreprekursorn, uppträder utanför mitokondrierna. Följaktligen har man med hjälp av högupplöst masspektrometri funnit att l-laktat tas upp i mitokondrier i HeLa- och H460-celler och bevisat att det resulterar i lipidsyntes; dessutom har transmissionselektronmikroskopi bekräftat att LDH är lokaliserad till mitokondrierna (26). Överraskande nog har man inte tagit hänsyn till den anaplerotiska roll som l-laktatmetabolismen i mitokondrierna spelar när cancermetabolismen ”omprövades” (27).
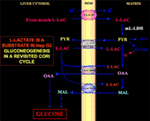
Figur 1. Cori-cykeln återigen undersökt i Hep G2-celler. Med tanke på att pyruvat inte kan komma in i Hep G2-M, vilket visades i Pizzuto et al. (21), når l-laktat som produceras i musklerna levern via blodet och från cytosolen in i mitokondrierna; I matrisen ger l-laktatmetabolismen upphov till pyruvat (PYR) via m-L-LDH och sedan till oxaloacetat (OAA) och malat (MAL) som exporteras från mitokondrierna till cytosolen via tre förmodade bärare för att användas för l-laktat-pyruvat-pendeln och för att glukoneogenesen ska kunna ske via en mekanism som liknar den som redan visats av de Bari et al. (6).
Vi anser att den föreslagna revideringen av Cori-cykeln, som är nödvändig för Hep G2-celler, också bör övervägas i alla andra typer av celler där mitokondriell metabolism av l-laktat är aktiv. Till exempel visades en partiell rekonstruktion av glukoneogenesen in vitro som härrör från mitokondriellt l-laktatupptag/metabolism i avsaknad av LDH utanför mitokondrierna (6).
Den mitokondriella l-laktatmetabolismens roll förtjänar ytterligare fokus: Med tanke på att väteperoxidproduktion i tumörernas mikromiljö ger bränsle till cancercellernas anabola tillväxt (28) bör man undersöka en möjlig roll för det förmodade mitokondriella l-laktatoxidaset (LOX) som genererar väteperoxid i mitokondrier i råttlever (29). Förekomsten av LOX i Hep G2-M tycks stämma överens med bevisen för att rotenon, som blockerar den syreförbrukning som induceras av tillsats av malat + glutamat, inte lyckas hämma den syreförbrukning som induceras av tillsats av l-laktat.
Författarnas bidrag
SP utformade denna åsikt, delade den och skrev artikeln tillsammans med AS.
Intressekonfliktutlåtande
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Recensenten deklarerade en delad anknytning, utan samarbete, med en av författarna till den handläggande redaktören.
1. Dianzani MU. Distribution av mjölksyraoxidas i lever- och njurceller hos normala råttor och råttor med fettdegeneration i levern. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Uthållighetsträning, uttryck och fysiologi för LDH, MCT1 och MCT4 i mänsklig skelettmuskulatur. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-laktattransport till mitokondrier i råtthjärtan och rekonstruktion av L-laktat/pyruvat-pendeln. Biochem J (2002) 15:101-4. doi:10.1042/bj364010101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Partiell rekonstruktion av glukoneogenes in vitro som härrör från mitokondriell L-laktatupptagning/metabolism och oxaloacetatexport via nya L-laktattranslokatorer. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Laktat, inte pyruvat, är neuronal aerob glykolysens slutprodukt: en elektrofysiologisk in vitro-studie. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Bevis för ett mitokondriellt laktatoxidationskomplex i neuroner hos råttor: en avgörande komponent för en laktatpendel i hjärnan. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport och metabolism av L-laktat sker i mitokondrier från cerebellära granuleceller och modifieras i celler som genomgår apoptos beroende på låg kaliumhalt. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. The mitochondrial L-lactate dehydrogenase affair. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Vid kapacitering av sperma från vildsvin bidrar L-laktat och succinat, men inte pyruvat och citrat, till ökningen av mitokondriernas membranpotential som övervakas via safranin O-fluorescens. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. Förekomsten av L-laktatdehydrogenas i det inre mitokondriella kompartmentet i grislever. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-laktatmetabolism i mitokondrier i potatisknölar. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Cell-cell och intracellulära laktatförbindelser. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Cerebral glykolysis: ett sekel av ihållande missförstånd och missuppfattningar. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Laktatmetabolism: historiskt sammanhang, tidigare feltolkningar och nuvarande förståelse. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-laktatmetabolism kan förekomma i normala och cancerprostataceller via den nya mitokondriella L-laktatdehydrogenasen. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Den mitokondriella transportens roll i energimetabolismen. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitokondriell funktion in vivo utvärderad med NADH-fluorescens: från djurmodeller till studier på människor. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-laktatmetabolism i HEP G2-cellens mitokondrier på grund av L-laktatdehydrogenaset bestämmer förekomsten av laktat/pyruvat-pendeln och uppkomsten av oxaloacetat, malat och citrat utanför mitokondrier. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitokondriell och plasmamembranens laktattransportör och laktatdehydrogenas isoformuttryck i bröstcancercellinjer. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Upprättande och karakterisering av en ny metod för att utvärdera glukoneogenesen med hjälp av hepatiska cellinjer, H4IIE och HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. Warburg-effekten vid tumörutveckling: mitokondriell oxidativ metabolism som en antimetastasemekanism. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport av pyruvat i mitokondrier från olika tumörceller. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Laktatmetabolism är associerad med däggdjurs mitokondrier. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexamining cancer metabolism: laktatproduktion för karcinogenes kan vara syftet med och förklaringen till Warburg-effekten. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancerceller ”befruktar” metaboliskt tumörens mikromiljö med väteperoxid och driver Warburg-effekten: implikationer för PET-avbildning av mänskliga tumörer. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-laktat genererar väteperoxid i renade mitokondrier från lever av råtta på grund av det förmodade L-laktatoxidaset som är lokaliserat i mellanrummet. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar