En plus d’être un précurseur du glucose dans le foie et le rein, le l-lactate est maintenant également reconnu comme un substrat énergétique dans la plupart des cellules via son oxydation en pyruvate. Cette oxydation, supposée se produire dans le cytosol, est catalysée par la l-lactate déshydrogénase, le pyruvate étant ensuite catabolisé dans la mitochondrie. Cependant, il a été reconnu récemment que les mitochondries jouent un rôle dans le métabolisme du l-lactate : l’existence d’une l-lactate déshydrogénase mitochondriale (m-l-LDH) a été suggérée par Dianzani (1), puis Baba et Sharma (2) ont démontré qu’elle était située dans la matrice mitochondriale (3). En effet, le transport et le métabolisme du l-lactate ont été mis en évidence dans diverses mitochondries, notamment dans les muscles squelettiques (4), le cœur de rat (5), le foie (6), le cerveau (7-9), les cellules granulaires cérébelleuses (10), le gastrocnémien de lapin (11), les spermatozoïdes (12), le foie de porc (13) et même les plantes (14). Ainsi, l’existence de la m-l-LDH, telle que revue par Passarella et al. (3), Brooks (15), et Schurr (16), a été reconnue avec son inclusion dans le MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Comme prévu, à la lumière de la présence de la l-LDH dans la matrice, la présence de transporteurs de l-lactate a été démontrée dans des études fonctionnelles avec des mitochondries purifiées et couplées. Ces transporteurs comprennent le symporteur l-lactate/H+ et les antiporteurs l-lactate/pyruvate et l-lactate/oxaloacétate (3). De manière surprenante, les preuves accablantes d’une m-l-LDH située à l’intérieur des mitochondries ne sont pas universellement acceptées, certains scientifiques restant sceptiques quant à l’existence de la m-l-LDH, tandis que d’autres la localisent dans l’espace intermembranaire (17). Nous pensons que le scepticisme pourrait provenir des difficultés à isoler les mitochondries couplées, ce qui n’est pas une tâche facile, en particulier avec les échantillons de muscles squelettiques, ou du manque de prudence dans le choix des milieux de réaction et dans l’utilisation d’inhibiteurs à la bonne concentration (11). Le fait que la m-l-LDH soit localisée à l’intérieur des mitochondries sera démontré ci-dessous.
Le l-Lactate est-il transporté et métabolisé dans les mitochondries des cellules cancéreuses ?
Oui, il l’est. Bien que dans les années 1920, Warburg ait découvert que les cellules cancéreuses préfèrent produire de l’ATP par glycolyse avec la production de l-lactate, à notre connaissance, le métabolisme mitochondrial du l-lactate n’avait pas été étudié dans les cellules cancéreuses jusqu’en 2010, lorsque la première preuve du métabolisme mitochondrial du l-lactate dans ces cellules (déjà signalé en 2008 par Gabriella Chieppa dans sa thèse de doctorat à l’Université de Molise) a été publiée (18). Dans ce cas, pour étudier le transport et le métabolisme du l-lactate dans les mitochondries isolées de cellules prostatiques normales et cancéreuses, des techniques spectroscopiques et polarographiques ont été utilisées, dans lesquelles la réaction de la m-l-LDH ou la consommation d’oxygène par les mitochondries, alimentées par du l-lactate ajouté de l’extérieur, ont été surveillées, respectivement (19), plutôt que d’utiliser des procédures plus complexes, disponibles dans les laboratoires de biologie moléculaire, de génétique et de chimie. Les deux premières techniques ont été choisies car elles permettent le suivi continu de la cinétique des processus étudiés dans des expériences qui durent plusieurs minutes et où les mitochondries restent couplées. En revanche, les mesures effectuées à l’aide des dernières méthodes sont généralement réalisées une fois que les processus sont terminés. Par conséquent, une augmentation de l’état redox des nucléotides pyridine intramitochondriaux, comme le montrent les mesures fluorimétriques, lors de l’ajout de l-lactate aux mitochondries, indique que le métabolisme du l-lactate se produit à l’intérieur des organelles via un m-l-LDH dépendant du NAD+ ; malheureusement, l’occurrence du métabolisme mitochondrial du l-lactate dans les cellules cancéreuses n’a pas été citée dans Ferguson et al. (17), peut-être parce que les auteurs de la revue considèrent que les techniques spectroscopiques et polarographiques sont « problématiques », malgré leur utilisation répandue par de nombreux scientifiques. Le fait qu’il s’agisse d’une opinion minoritaire pourrait être illustré par la citation d’une revue de Mayevsky et Rogatsky (20), qui déclare que « Le grand nombre de publications de différents groupes témoigne des informations précieuses recueillies dans diverses conditions expérimentales. Le contrôle des niveaux de NADH dans le tissu fournit les informations les plus importantes sur l’état métabolique des mitochondries. » L’existence du m-l-LDH peut également être confirmée immunologiquement dans des mitochondries dont il est prouvé qu’elles sont exemptes de toute contamination cytosolique.
Notez que dans le cas où il est proposé que la m-l-LDH soit localisée dans l’espace intermembranaire, l’augmentation de la fluorescence des nucléotides pyridine intramitochondriaux est expliquée comme suit : le l-lactate pénètre dans l’espace intermembranaire mitochondrial où il est oxydé en pyruvate, qui traverse à son tour la membrane interne mitochondriale pour être oxydé à l’intérieur de la mitochondrie via le complexe pyruvate déshydrogénase . Un tel mécanisme n’est pas soutenu par divers résultats expérimentaux. Par exemple, de Bari et al. (18) ont montré que la réduction du NAD+ se poursuit malgré la présence d’arsénite, un inhibiteur de la pyruvate déshydrogénase, mais est inhibée par l’oxamate, un inhibiteur de la l-LDH. Des preuves supplémentaires contre la présence de m-l-LDH dans l’espace intermembranaire émergent des résultats expérimentaux montrant que le l-lactate entre dans les mitochondries dans des conditions où le pyruvate est un composé non pénétrant (21) ou lorsque le symporteur pyruvate/H+ est bloqué par un inhibiteur (6). Ces approches expérimentales pourront également être appliquées à l’avenir aux mesures de la consommation d’oxygène (en présence ou en l’absence d’ADP), de l’efflux de protons et de la génération du potentiel membranaire. En appliquant le critère de force de contrôle avec divers inhibiteurs non pénétrants (19), on peut établir si la vitesse des processus ci-dessus reflète ou non celle du transport du l-lactate à travers la membrane mitochondriale. Ainsi, le transport du l-lactate peut être étudié quantitativement, y compris l’apparition d’une cinétique hyperbolique, le profil du pH, etc. De plus, la comparaison faite entre les profils d’inhibition des processus mitochondriaux dépendants du pyruvate et du l-lactate par l’utilisation de composés incapables de pénétrer dans les mitochondries permet de distinguer les transporteurs de l-lactate et de pyruvate.
Briefly, il a également été montré que le l-lactate ajouté de manière externe peut pénétrer dans les cellules prostatiques normales et cancéreuses et en particulier, de manière médiée par un transporteur, pénètre dans leurs mitochondries, où une l-LDH existe et est située dans le compartiment interne. Il a été démontré que les m-l-LDH diffèrent des enzymes cytosoliques qui elles-mêmes diffèrent les unes des autres. Les cellules normales et cancéreuses présentent des différences en ce qui concerne le niveau de protéine et l’activité des m-l-LDH, où l’expression et l’activité de l’enzyme sont toutes deux plus élevées dans les cellules cancéreuses.
En 2011, l’existence de protéines de transporteur de monocarboxylate (MCT) et de LDH dans les réticules mitochondriaux de lignées cellulaires de cancer du sein a été démontrée (22). Dans ce cas, l’expression des MCT et de la l-LDH a été mesurée, et leur localisation mitochondriale a été déterminée par immunofluorescence, une technique qui ne permet pas d’identifier la localisation submitochondriale.
Une étude plus large du transport et du métabolisme du l-lactate dans les mitochondries des cellules cancéreuses a été réalisée dans des cellules de carcinome hépatocellulaire humain (Hep G2) (21) dans lesquelles la gluconéogenèse a lieu (23). Les mitochondries des cellules Hep G2 (Hep G2-M) possèdent une m-l-LDH limitée au compartiment mitochondrial interne. On a également constaté que les l-LDH cytosoliques et mitochondriales différaient les unes des autres par leur cinétique de saturation. L’existence d’un transport de l-lactate médié par un transporteur dans ces mitochondries a également été démontrée. Il est important de noter que l’efflux de divers métabolites, y compris le pyruvate, l’oxaloacétate, le malate et le citrate, résultant de l’addition de l-lactate aux mitochondries a été démontré pour la première fois, ce qui a donné un premier aperçu du rôle du métabolisme mitochondrial du l-lactate ; en conséquence, l’existence d’une navette l-lactate/pyruvate consacrée à l’oxydation du NADH cytosolique a également été démontrée. En fin de compte, l’élimination du produit d’oxydation par le transport médié par un transporteur et le métabolisme mitochondrial surmonte toute difficulté thermodynamique théorique qui était considérée comme excluant toute oxydation du l-lactate dans la mitochondrie.
Ces résultats suggèrent fortement qu’une révision de la vision dogmatique du métabolisme du glucose est nécessaire avec une attention particulière sur le rôle du l-lactate et du m-l-LDH dans la gluconéogenèse. Par conséquent, le cycle de Cori (formulé en 1929 comme une voie métabolique nécessitant de l’énergie chez les animaux, où les atomes de carbone du glucose suivent un parcours circulaire : glycogène musculaire → lactate sanguin → foie (où se produit la néoglucogenèse) → glucose sanguin → glucose musculaire → glycogène musculaire) doit également être révisé. À cet égard, l’oxydation cellulaire du l-lactate, nécessaire à la production de glucose dans le cycle de Cori, a traditionnellement été postulée comme ayant lieu dans le cytosol, mais est-ce bien le cas ? La l-LDH cytosolique (c-l-LDH) est une enzyme réductrice, étape finale de la voie glycolytique, qui convertit le pyruvate en l-lactate, et assure ainsi la régénération du NAD+. Cette réaction doit se poursuivre sans relâche, indépendamment de la présence ou de l’absence d’oxygène, car la variation standard de l’énergie libre (ΔG0′) de la conversion du pyruvate en l-lactate est d’environ -6 kcal/mol. En outre, la forte affinité du pyruvate pour la c-l-LDH expliquerait le fait que le rapport normal / dans le sang et d’autres tissus est >10, une valeur qui ne peut pas correspondre à la proposition du pyruvate comme produit final de la glycolyse dans des conditions normales. Par conséquent, la représentation dogmatique de cette réaction comme bidirectionnelle est trompeuse et a été acceptée jusqu’à présent en raison de l’absence d’une alternative possible. Nous soutenons que l’oxydation du l-lactate en pyruvate n’a pas lieu dans le cytosol, mais plutôt dans les mitochondries. En effet, il n’existe que deux options pour empêcher l’accumulation de l-lactate dans le cytosol, soit le l-lactate est transporté hors de la cellule (dans des conditions anaérobies) et/ou est oxydé par la m-l-LDH lors de son transport dans la mitochondrie (dans des conditions aérobies). Par conséquent, même si nous sommes d’accord avec Lu et al. (24) que » la majorité du pyruvate dérivé de la glycolyse est détournée vers la fermentation du lactate « , nous ne pouvons pas accepter que le l-lactate soit » tenu à l’écart du métabolisme oxydatif mitochondrial. «
Le fait que le pyruvate ne puisse pas entrer dans l’Hep G2-M est particulièrement intéressant. En fait, contrairement au malate + glutamate et au l-lactate, le pyruvate ajouté de manière externe ne provoque ni la consommation d’oxygène ni la génération de potentiel membranaire . Notez qu’une déficience du transport du pyruvate dans les cellules cancéreuses a été rapportée par Paradies et al. (25). Par conséquent, indépendamment de l’impossibilité théorique d’oxyder le l-lactate dans le cytosol, comme nous l’avons expliqué ci-dessus, le cycle de Cori classique ne peut pas se produire dans les cellules Hep G2. Par conséquent, nous proposons un cycle de Cori révisé (figure 1), qui implique à la fois les transporteurs mitochondriaux qui assurent le trafic dépendant du l-lactate et la m-l-LDH, qui fournit le pyruvate à l’intérieur des mitochondries. Par conséquent, l’apparition à l’extérieur des mitochondries d’oxaloacétate et de malate dérivés de l’absorption et du métabolisme du l-lactate via la m-l-LDH, la pyruvate déshydrogénase, la pyruvate carboxylase et la malate déshydrogénase et par des échanges, probablement dus aux antiporteurs de l-lactate/oxaloacétate et de l-lactate/malate, confirme le rôle anaplérotique du l-lactate dans la gluconéogenèse dans laquelle les mitochondries jouent un rôle unique. Fait important, l’ajout de l-lactate à l’Hep G2-M entraîne l’apparition à l’extérieur des mitochondries de citrate, le précurseur des acides gras. En conséquence, en utilisant la spectrométrie de masse à haute résolution, l’absorption du l-lactate dans les mitochondries des cellules HeLa et H460 a été trouvée et il a été prouvé qu’elle entraînait une synthèse des lipides ; de plus, la microscopie électronique à transmission a confirmé que la LDH est localisée dans les mitochondries (26). Étonnamment, le rôle anaplérotique du métabolisme mitochondrial du l-lactate n’a pas été pris en compte lorsque le métabolisme du cancer a été « réexaminé » (27).
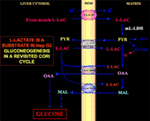
Figure 1. Le cycle de Cori revisité dans les cellules Hep G2. Étant donné que le pyruvate ne peut pas entrer dans Hep G2-M, comme l’ont montré Pizzuto et al. (21), le l-lactate produit dans les muscles atteint le foie via le flux sanguin et du cytosol entre dans les mitochondries ; dans la matrice, le métabolisme du l-lactate donne lieu à du pyruvate (PYR) via la m-L-LDH et ensuite à de l’oxaloacétate (OAA) et du malate (MAL) qui sont exportés de la mitochondrie au cytosol via trois transporteurs putatifs pour être utilisés pour la navette l-lactate-pyruvate et pour que la gluconéogenèse se produise via un mécanisme similaire à celui déjà montré par de Bari et al. (6).
Nous pensons que la révision proposée du cycle de Cori, nécessaire pour les cellules Hep G2, devrait également être envisagée dans tous les autres types de cellules où le métabolisme mitochondrial du l-lactate est actif. Par exemple, une reconstruction partielle de la gluconéogenèse in vitro découlant de l’absorption/métabolisme mitochondrial du l-lactate a été démontrée en l’absence de LDH à l’extérieur des mitochondries (6).
Le rôle du métabolisme mitochondrial du l-lactate mérite d’être approfondi : étant donné que la production de peroxyde d’hydrogène dans le microenvironnement tumoral alimente la croissance anabolique des cellules cancéreuses (28), un rôle possible de la l-lactate oxydase (LOX) mitochondriale putative qui génère du peroxyde d’hydrogène dans les mitochondries du foie de rat (29) devrait être étudié ; l’existence de LOX dans Hep G2-M semble être cohérente avec la preuve que la roténone, qui bloque la consommation d’oxygène induite par l’ajout de malate + glutamate ne parvient pas à inhiber la consommation d’oxygène induite par l’ajout de l-lactate.
Contributions des auteurs
SP a conçu cette opinion, l’a partagée et a rédigé l’article avec AS.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Le réviseur a déclaré une affiliation partagée, sans collaboration, avec l’un des auteurs à l’éditeur de traitement.
1. Dianzani MU. Distribution de l’acide lactique oxydase dans les cellules du foie et des reins de rats normaux et de rats atteints de dégénérescence graisseuse du foie. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochimie de la déshydrogénase lactique dans le cœur et les muscles pectoraux du rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondries et métabolisme du L-lactate. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Entraînement d’endurance, expression et physiologie de la LDH, de la MCT1 et de la MCT4 dans le muscle squelettique humain. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. Transport du L-lactate dans les mitochondries du cœur de rat et reconstruction de la navette L-lactate/pyruvate. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Reconstruction partielle de la gluconéogenèse in vitro découlant du captage/métabolisme mitochondrial du L-lactate et de l’exportation de l’oxaloacétate via de nouveaux translocateurs de L-lactate. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate : le substrat ultime de l’énergie oxydative cérébrale ? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Le lactate, et non le pyruvate, est le produit final de la glycolyse aérobie neuronale : une étude électrophysiologique in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Preuve d’un complexe d’oxydation du lactate mitochondrial dans les neurones de rat : un composant crucial pour une navette de lactate de cerveau. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport and metabolism of L-lactate occur in mitochondria from cerebellar granule cells and are modified in cells undergoing low potassium dependent apoptosis. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. L’affaire de la L-lactate déshydrogénase mitochondriale. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Dans la capacitation des spermatozoïdes de sanglier, le L-lactate et le succinate, mais pas le pyruvate et le citrate, contribuent à l’augmentation du potentiel de la membrane mitochondriale telle que surveillée par la fluorescence de la safranine O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. La présence de la L-lactate déshydrogénase dans le compartiment mitochondrial interne du foie de porc. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. Le métabolisme du L-lactate dans les mitochondries des tubercules de pomme de terre. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Les navettes de lactate cellule-cellule et intracellulaire. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Glycolyse cérébrale : un siècle de malentendus et d’idées fausses persistantes. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Métabolisme du lactate : contexte historique, erreurs d’interprétation antérieures et compréhension actuelle. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. Le métabolisme du L-lactate peut se produire dans les cellules prostatiques normales et cancéreuses via la nouvelle L-lactate déshydrogénase mitochondriale. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Le rôle du transport mitochondrial dans le métabolisme énergétique. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Fonction mitochondriale in vivo évaluée par la fluorescence du NADH : des modèles animaux aux études humaines. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Le métabolisme du L-lactate dans les mitochondries des cellules HEP G2 dû à la L-lactate déshydrogénase détermine l’apparition de la navette lactate/pyruvate et l’apparition de l’oxaloacétate, du malate et du citrate en dehors des mitochondries. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Expression des isoformes du transporteur de lactate mitochondrial et de la membrane plasmique et de la lactate déshydrogénase dans les lignées cellulaires du cancer du sein. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Établissement et caractérisation d’une nouvelle méthode d’évaluation de la gluconéogenèse à l’aide de lignées cellulaires hépatiques, H4IIE et HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. L’effet Warburg dans la progression tumorale : le métabolisme oxydatif mitochondrial comme mécanisme anti-métastase. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport of pyruvate in mitochondria from different tumor cells. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Le métabolisme du lactate est associé aux mitochondries des mammifères. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Réexaminer le métabolisme du cancer : la production de lactate pour la cancérogenèse pourrait être le but et l’explication de l’effet Warburg. Carcinogenèse (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Les cellules cancéreuses » fertilisent » métaboliquement le microenvironnement tumoral avec du peroxyde d’hydrogène, entraînant l’effet Warburg : implications pour l’imagerie TEP des tumeurs humaines. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactate génère du peroxyde d’hydrogène dans les mitochondries de foie de rat purifiées en raison de la L-lactate oxydase putative localisée dans l’espace intermembranaire. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar