Além de ser um precursor da glicose no fígado e nos rins, o l-lactato está agora também a ser reconhecido como um substrato energético na maioria das células através da sua oxidação para piruvitar. Esta oxidação, assumida como ocorrendo no citosol, é catalisada pela l-lactato desidrogenase com o piruvato subsequentemente catabolizado nas mitocôndrias. Entretanto, mitocôndrias recentemente foram reconhecidas como tendo um papel no metabolismo do l-lactato: a existência de uma l-lactato desidrogenase mitocondrial (m-l-LDH) foi sugerida por Dianzani (1), e posteriormente demonstrada por Baba e Sharma (2) para ser localizada na matriz mitocondrial (3). De fato, o transporte e metabolismo do l-lactato foi demonstrado em várias mitocôndrias, incluindo músculo esquelético (4) coração de rato (5), fígado (6), cérebro (7-9), células granulares cerebelares (10), gastrocnêmio de coelho (11), espermatozóides (12), fígado de porco (13), e até mesmo plantas (14). Assim, a existência de m-l-LDH, conforme revisto por Passarella et al. (3), Brooks (15), e Schurr (16), foi reconhecida com sua inclusão na MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Como esperado, à luz da presença do l-LDH na matriz, a ocorrência de portadores de l-lactato tem sido demonstrada em estudos funcionais com mitocôndrias purificadas e acopladas. Estes incluem o l-lactato/H+ symporter e o l-lactato/piruvato e l-lactato/oxaloacetato antitransportadores (3). Surpreendentemente, a esmagadora evidência para um m-l-LDH localizado dentro das mitocôndrias não é universalmente aceita, com alguns cientistas ainda sendo céticos sobre a existência do m-l-LDH, enquanto outros localizam o m-l-LDH no espaço intermembrana (17). É nossa opinião que o ceticismo pode ter origem devido a dificuldades em isolar mitocôndrias acopladas, não sendo uma tarefa fácil, em particular com amostras de músculo esquelético, ou não sendo suficientemente cuidadoso na seleção dos meios de reação e no uso de inibidores na concentração correta (11). Que m-l-LDH está localizado dentro das mitocôndrias será mostrado abaixo.
Is l-Lacttate Sendo Transportado e Metabolizado em Mitocôndrias de Câncer?
Sim, é. Embora na década de 1920, Warburg descobriu que as células cancerígenas preferem produzir ATP por glicólise com produção de l-lactato, até o melhor de nosso conhecimento, o metabolismo mitocondrial do l-lactato não havia sido investigado em células cancerígenas até 2010, quando foi publicada a primeira evidência de metabolismo mitocondrial l-lactato nestas células (já relatada em 2008 por Gabriella Chieppa em sua tese de doutorado na Universidade de Molise) (18). Neste caso, para estudar o transporte e metabolismo de l-lactato em mitocôndrias isoladas de células normais e cancerosas da próstata, foram utilizadas técnicas espectroscópicas e polarográficas, nas quais a reação m-lDH ou o consumo de oxigênio pelas mitocôndrias, fornecidas com l-lactato adicionado externamente, foram monitoradas, respectivamente (19), em vez de empregar procedimentos mais envolvidos, disponíveis em laboratórios de biologia molecular, genética e química. As duas primeiras técnicas foram escolhidas porque permitem o monitoramento contínuo da cinética dos processos investigados em experimentos que duram vários minutos onde as mitocôndrias permanecem acopladas. Em contraste, as medições usando os últimos métodos são geralmente feitas uma vez que os processos já tenham sido concluídos. Assim, um aumento no estado redox dos nucleotídeos da piridina intramitocondrial, como demonstrado pelas medições fluorimétricas, após a adição de l-lactato às mitocôndrias indica que o metabolismo l-lactato ocorre dentro das organelas através de um m-lDH dependente de NAD+; infelizmente, a ocorrência do metabolismo l-lactato mitocondrial em células cancerígenas não foi citada em Ferguson et al. (17) possivelmente porque os autores da revisão consideram as técnicas espectroscópicas e polarográficas como “problemáticas”, apesar de seu uso difundido por inúmeros cientistas. Que a sua opinião é minoritária pode ser exemplificada citando uma revisão de Mayevsky e Rogatsky (20), que afirma que “O grande número de publicações de diferentes grupos testemunha a valiosa informação recolhida em várias condições experimentais. O monitoramento dos níveis de NADH no tecido fornece as informações mais importantes sobre o estado metabólico das mitocôndrias”. A existência de m-l-LDH também pode ser confirmada imunologicamente nas mitocôndrias que estão comprovadamente livres de contaminação citosólica.
Note que no caso em que m-l-LDH é proposto para ser localizado no espaço intermembrana, o aumento da fluorescência intramitocondrial da piridina nucleotídica é explicado da seguinte forma: l-lactato entra no espaço intermembrana mitocondrial onde é oxidado para piruvato, que por sua vez atravessa a membrana interna mitocondrial para ser oxidado dentro das mitocôndrias através do complexo desidrogenase piruvato. Tal mecanismo não é suportado por vários achados experimentais. Por exemplo, em de Bari et al. (18), foi demonstrado que a redução de NAD+ prossegue apesar da presença de arsenita, um inibidor da piruvrogenase desidrogenase, mas é inibida pelo oxamato, um inibidor da l-LDH. Evidências adicionais contra a presença de m-l-LDH no espaço intermembrana emergem de resultados experimentais mostrando que o l-lactato entra na mitocôndria sob condições onde o piruvato é um composto não-penetrante (21) ou onde o piruvato/H+ é bloqueado por um inibidor (6). Estas abordagens experimentais também podem ser aplicadas a medidas de consumo de oxigênio (na presença ou ausência de ADP), efluxo de prótons e geração potencial de membranas no futuro. Aplicando o critério de força de controle com vários inibidores não-penetrantes (19), pode-se estabelecer se a taxa dos processos acima é ou não o reflexo do transporte de l-lactato através da membrana mitocondrial. Assim, o transporte de l-lactato pode ser investigado quantitativamente, incluindo a ocorrência de cinética hiperbólica, perfil de pH, etc. Além disso, a comparação feita entre os perfis de inibição dos processos mitocondriais piruvato e l-lactato dependente do uso de compostos que não conseguem entrar nas mitocôndrias permite distinguir entre portadores de l-lactato e piruvato.
Briefly, também foi demonstrado que o l-lactato adicionado externamente pode entrar tanto nas células normais como nas células cancerosas da próstata e, em particular, de forma mediada por portadores, entra nas suas mitocôndrias, onde existe um l-LDH e está localizado no compartimento interno. Foi demonstrado que as m-l-LDH diferem das enzimas citosólicas que diferem umas das outras. As células normais e cancerígenas mostram diferenças em relação ao nível e atividade da proteína m-l-LDH, onde tanto a expressão enzimática quanto a atividade são maiores nas células cancerígenas.
Em 2011, foi demonstrada a existência de monocarboxilato transportador (MCT) e proteínas LDH na reticula mitocondrial das linhas celulares do câncer de mama (22). Nesse caso, foi medida a expressão tanto do MCT quanto do LDH, e sua localização mitocondrial foi determinada via imunofluorescência, técnica que não permite a identificação da localização submocondrial.
Foi realizada uma investigação mais ampla do transporte e metabolismo do l-lactato nas mitocôndrias de células cancerosas em células do carcinoma hepatocelular humano (Hep G2) (21) em que ocorre a gliconeogênese (23). As mitocôndrias de células Hep G2 (Hep G2-M) possuem um m-l-LDH restrito ao compartimento mitocondrial interno. Verificou-se que as mitocôndrias citosólicas e mitocondriais l-LDH também diferem entre si na sua cinética de saturação. A ocorrência de um transporte de l-lactato mediado por um transportador nestas mitocôndrias também foi demonstrada. Importante, o efluxo de vários metabolitos, incluindo piruvato, oxaloacetato, malato e citrato, resultantes da adição de l-lactato às mitocôndrias foi mostrado pela primeira vez, dando uma primeira visão do papel do metabolismo mitocondrial do l-lactato; assim, a ocorrência de um vaivém l-lactato/piruvato dedicado à oxidação do NADH citosólico foi também mostrada. Finalmente, a remoção do produto de oxidação por transporte mediado por portadores e metabolismo mitocondrial supera qualquer dificuldade termodinâmica teórica que foi considerada para descartar qualquer oxidação do l-lactato nas mitocôndrias.
Estas descobertas sugerem fortemente que uma revisão da visão dogmática do metabolismo da glicose é necessária com um foco especial no papel do l-lactato e m-l-LDH na gluconeogênese. Assim, o ciclo Cori (formulado em 1929 como uma via metabólica que requer energia em animais, onde átomos de carbono da glicose passam pela via circular: glicogênio muscular → lactato sanguíneo → fígado (onde ocorre gluconeogênese) → glicose no sangue → glicose muscular → glicose muscular → glicogênio muscular) também exige revisão. Neste sentido, a oxidação celular l-lactato, que é necessária para a produção de glicose no ciclo do Cori, tem sido tradicionalmente postulada para ocorrer no citosol, mas será? O citosol-l-LDH (c-l-LDH) é uma enzima redutora, a etapa final da via glicolítica, que converte o piruvato em l-lactato, e assim proporciona a regeneração do NAD+. Esta reação deve prosseguir sem diminuir, independentemente da presença ou ausência de oxigênio, já que a mudança padrão de energia livre (ΔG0′) da conversão do piruvato em l-lactato é de cerca de -6 kcal/mol. Além disso, a alta afinidade do piruvato com o c-l-LDH explicaria o fato de que a relação normal / relação no sangue e outros tecidos é >10, um valor que não pode corresponder à proposta do piruvato como o produto final da glicólise em condições normais. Portanto, o retrato dogmático desta reação como bidirecional é enganoso e tem sido aceito até o momento devido à ausência de uma possível alternativa. Nós afirmamos que a oxidação l-lactato de volta ao piruvato não ocorre no citosol, mas sim, ocorre nas mitocôndrias. Na verdade, existem apenas duas opções para evitar a acumulação de l-lactato no citosol, ou o l-lactato é transportado para fora da célula (em condições anaeróbicas) e/ou é oxidado via m-lDH no seu transporte para a mitocôndria (em condições aeróbicas). Portanto, mesmo se concordarmos com Lu et al. (24) que “a maioria dos piruvatos derivados da glicólise é desviada para a fermentação do lactato”, não podemos aceitar que o l-lactato seja “mantido longe do metabolismo oxidativo mitocondrial”
De especial interesse é o fato de que o piruvato não pode entrar na Hepatite G2-M. Na verdade, ao contrário do malato + glutamato e l-lactato, o piruvato adicionado externamente não causa consumo de oxigênio ou geração potencial de membrana . Note que uma deficiência do transporte piruvato nas células cancerosas foi relatada por Paradies et al. (25). Portanto, independentemente da inviabilidade teórica da oxidação do l-lactato no citosol, como foi explicado acima, o ciclo clássico do Cori não pode ocorrer na Hepatite G2cells. Portanto, oferecemos um ciclo Cori revisado (Figura 1), que envolve tanto os portadores mitocondriais que medeiam o tráfego dependente de l-lactato quanto o m-l-LDH, que fornece o piruvato dentro das mitocôndrias. Assim, o aparecimento fora das mitocôndrias de oxaloacetato e malato derivado da absorção e metabolismo do l-lactato via m-l-LDH, desidrogenase piruvada, carboxilase piruvada, e malato desidrogenase e por trocas, provavelmente devido ao l-lactato/oxaloacetato e l-lactato/ /malato antitransportadores, confirma um papel anaplerótico do l-lactato na gliconeogênese, na qual as mitocôndrias desempenham um papel único. Importante, a adição de l-lactato à Hepatite G2-M resulta no aparecimento fora das mitocôndrias do citrato, o precursor dos ácidos gordos. Assim, usando espectrometria de massa de alta resolução, a absorção de l-lactato nas mitocôndrias de células de HeLa e H460 foi encontrada e provou resultar na síntese lipídica; além disso, a microscopia eletrônica de transmissão confirmou que o LDH está localizado nas mitocôndrias (26). Surpreendentemente, o papel anaplerótico do metabolismo l-lactato mitocondrial não foi considerado quando o metabolismo do câncer foi “reexaminado” (27).
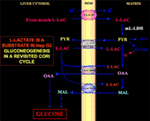
Figura 1. Ciclo de Cori revisitado em células Hepatite G2. Dado que o piruvato não pode entrar na Hep G2-M, como mostrado em Pizzuto et al. (21), o l-lactato produzido nos músculos chega ao fígado através da corrente sanguínea e a partir do citosol entra na mitocôndria; no metabolismo da matriz l-lactato dá origem ao piruvato (PYR) via m-LDH e depois ao oxaloacetato (OAA) e malato (MAL) que são exportados da mitocôndria para o citosol através de três supostos portadores a serem utilizados para o transporte do piruvato l-lactato e para que a gluconeogênese ocorra através de um mecanismo semelhante ao já demonstrado por de Bari et al. (6).
Consideramos que a revisão proposta do ciclo de Cori, necessária para as células Hepatite G2, também deve ser considerada em todos os outros tipos de células onde o metabolismo mitocondrial do l-lactato está ativo. Por exemplo, a reconstrução parcial da gluconeogênese in vitro decorrente da captação/metabolismo do l-lactato mitocondrial foi mostrada na ausência de LDH fora das mitocôndrias (6).
O papel do metabolismo do l-lactato mitocondrial merece maior atenção: dado que a produção de peróxido de hidrogênio no microambiente tumoral alimenta o crescimento anabólico das células cancerosas (28), um possível papel da suposta l-lactato oxidase mitocondrial (LOX) que gera peróxido de hidrogênio nas mitocôndrias hepáticas de ratos (29) deve ser investigado; a existência de LOX no Hep G2-M parece ser consistente com as evidências de que a rotenona, que bloqueia o consumo de oxigênio induzido pela adição de malato + glutamato, não inibe o consumo de oxigênio induzido pela adição de l-lactato.
Contribuições do autor
SP concebeu esta opinião, compartilhou-a e escreveu o artigo com AS.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
O revisor declarou uma afiliação compartilhada, sem qualquer colaboração, com um dos autores ao editor responsável.
1. Dianzani MU. Distribuição da oxidase ácida láctica em células hepáticas e renais de ratos normais e ratos com degeneração gordurosa do fígado. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histoquímica da desidrogenase láctica nos músculos do coração e peitoral do rato J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitocondria e L-lacttate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Treinamento de resistência, expressão e fisiologia de LDH, MCT1 e MCT4 no músculo esquelético humano. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-lactato transporte em mitocôndria de coração de rato e reconstrução do vaivém L-lactato/piruvato. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Reconstrução parcial da gluconeogênese in vitro decorrente da absorção/metabolismo de L-lactato mitocondrial e exportação de oxaloacetato através de novos translocadores de L-lactato. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: o substrato de energia oxidativa cerebral final? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Lactato, não piruvato, é um produto final de glicólise neuronal aeróbica: um estudo electrofisiológico in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Evidência para um complexo de oxidação mitocondrial de lactato em neurônios de ratos: um componente crucial para uma nave de transporte de lactato cerebral. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. O transporte e o metabolismo do L-lactato ocorrem nas mitocôndrias a partir de células de grânulos cerebelares e são modificados em células submetidas a apoptose dependente de baixo potássio. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. O caso da mitocondrial L-lactato desidrogenase. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Na capacitação do esperma de javali L-lactato e succinato, mas não piruvato e citrato, contribuem para o aumento do potencial da membrana mitocondrial conforme monitorado através da fluorescência safranina O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. A ocorrência de L-lactato desidrogenase no compartimento mitocondrial interno do fígado de porco. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lactato metabolismo em mitocôndria de tubérculo de batata. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Vaivéns de células e de lactato intracelular. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Glicólise cerebral: um século de mal-entendidos e equívocos persistentes. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolismo do lactato: contexto histórico, interpretações erradas anteriores, e compreensão atual. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-lactate metabolism can occur in normal and cancer prostate cells via the novel mitochondrial L-lactate dehydrogenase. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. O papel do transporte mitocondrial no metabolismo energético. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Função mitocondrial avaliada in vivo pela fluorescência NADH: de modelos animais a estudos humanos. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-lactate metabolism in HEP G2 cell mitochondria due to the L-lactate dehydrogenase determines the occurrence of the lactate/pyruvate shuttle and the appearance of oxaloacetate, malate and citrate outside mitochondria. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Transportador de lactato mitocondrial e de membrana plasmática e expressão da isoforma de desidrogenase láctica nas linhas celulares do câncer de mama. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Estabelecimento e caracterização de um novo método para avaliação da gluconeogênese utilizando linhas celulares hepáticas, H4IIE e HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. O efeito Warburg na progressão tumoral: metabolismo oxidativo mitocondrial como mecanismo anti-metástase. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transporte de piruvato em mitocôndrias a partir de diferentes células tumorais. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. O metabolismo do lactato está associado à mitocôndria de mamíferos. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexaminação do metabolismo do câncer: a produção de lactato para carcinogênese poderia ser o propósito e a explicação do efeito Warburg. Carcinogênese (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. As células cancerígenas “fertilizam” metabólicamente o microambiente do tumor com peróxido de hidrogênio, impulsionando o efeito Warburg: implicações para a imagem PET de tumores humanos. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactato gera peróxido de hidrogénio nas mitocôndrias hepáticas purificadas de ratos devido à putativa L-lactato oxidase localizada no espaço intermembrana. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar