Pe lângă faptul că este un precursor al glucozei în ficat și rinichi, l-lactatul este acum recunoscut și ca un substrat energetic în majoritatea celulelor prin oxidarea sa la piruvat. Această oxidare, despre care se presupune că are loc în citosol, este catalizată de l-lactat dehidrogenază, piruvatul fiind ulterior catabolizat în mitocondrii. Cu toate acestea, s-a recunoscut recent că mitocondriile joacă un rol în metabolismul l-lactatului: existența unei l-lactat-dehidrogenaze mitocondriale (m-l-LDH) a fost sugerată de Dianzani (1), iar ulterior Baba și Sharma (2) au demonstrat că aceasta este localizată în matricea mitocondrială (3). Într-adevăr, transportul și metabolismul l-lactatului a fost demonstrat în diverse mitocondrii, inclusiv în mușchiul scheletic (4), inima de șobolan (5), ficatul (6), creierul (7-9), celulele granulare cerebeloase (10), gastrocnemius de iepure (11), celulele spermatozoizilor (12), ficatul de porc (13) și chiar în plante (14). Astfel, existența m-l-LDH, așa cum a fost revizuită de Passarella et al. (3), Brooks (15) și Schurr (16), a fost recunoscută prin includerea sa în MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Așa cum era de așteptat, având în vedere prezența l-LDH în matrice, apariția purtătorilor pentru l-lactat a fost demonstrată în studiile funcționale cu mitocondrii purificate și cuplate. Printre aceștia se numără simporatorul l-lactat/H+ și antiporterii l-lactat/piruvat și l-lactat/oxaloacetat (3). În mod surprinzător, dovezile copleșitoare privind existența unui m-l-LDH localizat în interiorul mitocondriilor nu sunt unanim acceptate, unii oameni de știință fiind încă sceptici cu privire la existența m-l-LDH, în timp ce alții localizează m-l-LDH în spațiul intermembranar (17). Suntem de părere că scepticismul ar putea proveni din cauza dificultăților de izolare a mitocondriilor cuplate, o sarcină deloc ușoară, în special în cazul probelor de mușchi scheletici, sau din faptul că nu am fost suficient de atenți la selectarea mediilor de reacție și la utilizarea inhibitorilor la concentrația corectă (11). Faptul că m-l-LDH este localizat în interiorul mitocondriilor va fi arătat mai jos.
Este l-lactatul transportat și metabolizat în mitocondriile celulelor canceroase?
Da, este. Deși în anii 1920, Warburg a constatat că celulele canceroase preferă să producă ATP prin glicoliză cu producția de l-lactat, din câte știm noi, metabolismul mitocondrial al l-lactatului nu a fost investigat în celulele canceroase până în 2010, când au fost publicate primele dovezi ale metabolismului mitocondrial al l-lactatului în aceste celule (deja raportate în 2008 de Gabriella Chieppa în teza sa de doctorat de la Universitatea din Molise) (18). În acest caz, pentru a studia transportul și metabolismul l-lactatului în mitocondriile izolate din celule de prostată normale și canceroase, au fost utilizate tehnici spectroscopice și polarografice, în care au fost monitorizate fie reacția m-l-LDH, fie consumul de oxigen de către mitocondrii, alimentate cu l-lactat adăugat extern, respectiv (19), în loc să se utilizeze proceduri mai complexe, disponibile în laboratoarele de biologie moleculară, genetică și chimie. Primele două tehnici au fost alese deoarece acestea permit monitorizarea continuă a cineticii proceselor investigate în experimentele care durează câteva minute în care mitocondriile rămân cuplate. În schimb, măsurătorile efectuate cu ajutorul celor din urmă metode se fac, de obicei, după ce procesele s-au încheiat deja. În consecință, o creștere a stării redox a nucleotidelor piridinice intramitocondriale, așa cum reiese din măsurătorile fluorimetrice, la adăugarea de l-lactat în mitocondrii indică faptul că metabolismul l-lactatului are loc în interiorul organitelor prin intermediul unui m-l-LDH dependent de NAD+; din păcate, apariția metabolismului mitocondrial al l-lactatului în celulele canceroase nu a fost citată în Ferguson et al. (17), probabil pentru că autorii revistei consideră că tehnicile spectroscopice și polarografice sunt „problematice”, în ciuda utilizării sale pe scară largă de către numeroși oameni de știință. Faptul că opinia lor este minoritară ar putea fi exemplificat prin citarea unei recenzii realizate de Mayevsky și Rogatsky (20), care afirmă că „Numărul mare de publicații realizate de diferite grupuri atestă informațiile valoroase adunate în diferite condiții experimentale. Monitorizarea nivelurilor de NADH în țesuturi oferă cele mai importante informații despre starea metabolică a mitocondriilor”. Existența m-l-LDH poate fi, de asemenea, confirmată imunologic în mitocondrii care s-au dovedit a fi lipsite de contaminare citosolică.
Observați că în cazul în care se propune ca m-l-LDH să fie localizată în spațiul intermembranar, creșterea fluorescenței nucleotidei piridinice intramitocondriale se explică astfel: l-lactatul intră în spațiul intermembranar mitocondrial unde este oxidat în piruvat, care la rândul său traversează membrana internă mitocondrială pentru a fi oxidat în interiorul mitocondriei prin intermediul complexului piruvat dehidrogenază . Un astfel de mecanism nu este susținut de diverse constatări experimentale. De exemplu, în de Bari et al. (18), s-a demonstrat că reducerea NAD+ are loc în ciuda prezenței arsenitului, un inhibitor al piruvatului dehidrogenazei, dar este inhibată de oxamat, un inhibitor al l-LDH. Dovezi suplimentare împotriva prezenței m-l-LDH în spațiul intermembranar apar din rezultatele experimentale care arată că l-lactatul intră în mitocondrii în condiții în care piruvatul este un compus nepenetrant (21) sau în care simporatorul piruvat/H+ este blocat de un inhibitor (6). Aceste abordări experimentale pot fi, de asemenea, aplicate în viitor la măsurători ale consumului de oxigen (în prezența sau absența ADP), ale efluxului de protoni și ale generării potențialului de membrană. Prin aplicarea criteriului puterii de control cu diferiți inhibitori nepenetranți (19), se poate stabili dacă rata proceselor de mai sus o reflectă sau nu pe cea a transportului de l-lactat prin membrana mitocondrială. Astfel, transportul de l-lactat poate fi investigat cantitativ, inclusiv apariția cineticii hiperbolice, profilul pH-ului etc. Mai mult, comparația făcută între profilurile de inhibiție a proceselor mitocondriale dependente de piruvat și de l-lactat prin utilizarea unor compuși care nu sunt capabili să pătrundă în mitocondrii permite o distincție între purtătorii de l-lactat și piruvat.
În mod succint, s-a demonstrat, de asemenea, că l-lactatul adăugat din exterior poate pătrunde atât în celulele de prostată normale, cât și în cele canceroase și, în special, într-o manieră mediată de purtător, pătrunde în mitocondriile acestora, unde există un l-LDH care este localizat în compartimentul intern. S-a demonstrat că m-l-LDH-urile diferă de enzimele citosolice care, la rândul lor, diferă între ele. Celulele normale și cele canceroase prezintă diferențe în ceea ce privește nivelul de proteine și activitatea m-l-LDH, unde atât expresia cât și activitatea enzimei sunt mai mari în celulele canceroase.
În 2011, a fost demonstrată existența proteinelor transportoare de monocarboxilat (MCT) și LDH în reticulele mitocondriale ale liniilor celulare de cancer mamar (22). În acest caz, a fost măsurată expresia atât a MCT, cât și a l-LDH, iar localizarea lor mitocondrială a fost determinată prin imunofluorescență, o tehnică care nu permite identificarea localizării submitochondriale.
O investigație mai amplă a transportului și metabolismului l-lactatului în mitocondriile celulelor canceroase a fost efectuată în celulele de carcinom hepatocelular uman (Hep G2) (21) în care are loc gluconeogeneza (23). Mitocondriile celulelor Hep G2 (Hep G2-M) posedă un m-l-LDH limitat la compartimentul mitocondrial intern. S-a constatat, de asemenea, că l-LDH citosolică și mitocondrială diferă una de cealaltă în ceea ce privește cinetica de saturație. S-a demonstrat, de asemenea, apariția unui transport de l-lactat mediat de purtător în aceste mitocondrii. În mod important, s-a demonstrat pentru prima dată efluxul diferiților metaboliți, inclusiv piruvatul, oxaloacetatul, malatul și citratul, care rezultă în urma adaosului de l-lactat în mitocondrii, ceea ce a oferit o primă perspectivă asupra rolului metabolismului mitocondrial al l-lactatului; în consecință, s-a demonstrat, de asemenea, apariția unei navete l-lactat/piruvat dedicată oxidării NADH citosolic. În cele din urmă, eliminarea produsului de oxidare prin transportul mediat de purtător și metabolismul mitocondrial depășește orice dificultate termodinamică teoretică care a fost considerată ca excluzând orice oxidare a l-lactatului în mitocondrie.
Aceste constatări sugerează cu tărie că este necesară o revizuire a viziunii dogmatice asupra metabolismului glucozei, cu o atenție specială asupra rolului l-lactatului și al m-l-LDH în gluconeogeneză. Prin urmare, ciclul Cori (formulat în 1929 ca o cale metabolică care necesită energie la animale, în care atomii de carbon ai glucozei trec de-a lungul traseului circular: glicogen muscular → lactat sanguin → ficat (unde are loc gluconeogeneza) → glucoză sanguină → glucoză musculară → glicogen muscular) necesită, de asemenea, o revizuire. În această privință, în mod tradițional s-a postulat că oxidarea celulară a l-lactatului, care este necesară pentru producerea glucozei în ciclul Cori, are loc în citosol, dar oare are loc? L-LDH citosolică (c-l-LDH) este o enzimă reducătoare, ultima etapă a căii glicolitice, care transformă piruvatul în l-lactat și asigură astfel regenerarea NAD+. Această reacție ar trebui să se desfășoare nestingherită, indiferent de prezența sau absența oxigenului, deoarece modificarea standard a energiei libere (ΔG0′) a conversiei piruvatului în l-lactat este de aproximativ -6 kcal/mol. În plus, afinitatea mare a piruvatului față de c-l-LDH ar explica faptul că raportul normal / în sânge și în alte țesuturi este >10, o valoare care nu poate corespunde cu propunerea piruvatului ca produs final al glicolizei în condiții normale. Prin urmare, prezentarea dogmatică a acestei reacții ca fiind bidirecțională este înșelătoare și a fost acceptată până în prezent din cauza absenței unei alternative posibile. Noi susținem că oxidarea l-lactatului înapoi la piruvat nu are loc în citosol, ci mai degrabă în mitocondrii. Într-adevăr, există doar două opțiuni pentru a preveni acumularea de l-lactat în citosol, fie l-lactatul este transportat în afara celulei (în condiții anaerobe) și/sau este oxidat prin intermediul m-l-LDH în momentul transportului său în mitocondrie (în condiții aerobe). Prin urmare, chiar dacă suntem de acord cu Lu et al. (24) că „majoritatea piruvatului derivat din glicoliză este deviat către fermentarea lactatului”, nu putem accepta că l-lactatul este „ținut departe de metabolismul oxidativ mitocondrial.”
De un interes deosebit este faptul că piruvatul nu poate intra în Hep G2-M. De fapt, spre deosebire de malat + glutamat și l-lactat, piruvatul adăugat din exterior nu reușește să provoace nici consumul de oxigen, nici generarea de potențial de membrană . Observați că o afectare a transportului piruvatului în celulele canceroase a fost raportată de Paradies și colab. (25). Prin urmare, independent de imposibilitatea teoretică a oxidării l-lactatului în citosol, așa cum s-a explicat mai sus, ciclul clasic Cori nu poate avea loc în celulele Hep G2. Prin urmare, oferim un ciclu Cori revizuit (figura 1), care implică atât purtătorii mitocondriali care mediază traficul dependent de l-lactat, cât și m-l-LDH, care furnizează piruvatul în interiorul mitocondriilor. În consecință, apariția în afara mitocondriilor a oxaloacetatului și a malatului derivate din captarea și metabolizarea l-lactatului prin intermediul m-l-LDH, piruvatului dehidrogenazei, piruvatului carboxilazei și malatului dehidrogenazei și prin schimburi, probabil datorate antiporterilor l-lactat/oxaloacetat și l-lactat/malat, confirmă rolul anaplerotic al l-lactatului în gluconeogeneză, în care mitocondriile joacă un rol unic. Este important faptul că adăugarea de l-lactat în Hep G2-M are ca rezultat apariția în afara mitocondriilor a citratului, precursorul acizilor grași. În consecință, prin utilizarea spectrometriei de masă de înaltă rezoluție, s-a constatat absorbția de l-lactat în mitocondriile celulelor HeLa și H460 și s-a dovedit că are ca rezultat sinteza lipidelor; în plus, microscopia electronică cu transmisie a confirmat că LDH este localizată în mitocondrii (26). În mod surprinzător, rolul anaplerotic al metabolismului mitocondrial al l-lactatului nu a fost luat în considerare atunci când metabolismul cancerului a fost „reexaminat” (27).
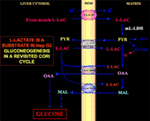
Figura 1. Ciclul Cori revizuit în celulele Hep G2. Având în vedere că piruvatul nu poate intra în Hep G2-M, așa cum s-a arătat în Pizzuto et al. (21), l-lactatul produs în mușchi ajunge în ficat prin fluxul sanguin, iar din citosol intră în mitocondrii; în matrice, metabolismul l-lactatului dă naștere la piruvat (PYR) prin intermediul m-L-LDH și apoi la oxaloacetat (OAA) și malat (MAL) care sunt exportate din mitocondrie în citosol prin intermediul a trei purtători putativi pentru a fi utilizate pentru naveta l-lactat-piruvat și pentru ca gluconeogeneza să aibă loc printr-un mecanism similar cu cel demonstrat deja de Bari et al. (6).
Credem că revizuirea propusă a ciclului Cori, necesară pentru celulele Hep G2, ar trebui să fie luată în considerare și în toate celelalte tipuri de celule în care metabolismul mitocondrial al l-lactatului este activ. De exemplu, reconstrucția parțială a gluconeogenezei in vitro care rezultă din absorbția/metabolismul mitocondrial al l-lactatului a fost demonstrată în absența LDH în afara mitocondriilor (6).
Rolul metabolismului mitocondrial al l-lactatului merită o atenție mai mare: având în vedere că producția de peroxid de hidrogen în micro-mediul tumoral alimentează creșterea anabolică a celulelor canceroase (28), ar trebui investigat un posibil rol al l-lactat oxidazei mitocondriale putative (LOX) care generează peroxid de hidrogen în mitocondriile ficatului de șobolan (29); existența LOX în Hep G2-M pare să fie în concordanță cu dovezile că rotenona, care blochează consumul de oxigen indus de adăugarea de malat + glutamat nu reușește să inhibe consumul de oxigen indus de adăugarea de l-lactat.
Contribuții ale autorilor
SP a conceput această opinie, a împărtășit-o și a scris lucrarea împreună cu AS.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Revizorul a declarat editorului de manipulare o afiliere comună, fără colaborare, cu unul dintre autori.
1. Dianzani MU. Distribuția acidului lactic oxidază în celulele hepatice și renale ale șobolanilor normali și ale șobolanilor cu degenerare grasă a ficatului. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochimia deshidrogenazei lactice în inima și mușchii pectorali de șobolan J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria și metabolismul L-lactatului. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Antrenamentul de anduranță, expresia și fiziologia LDH, MCT1 și MCT4 în mușchii scheletici umani. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. Transportul L-lactatului în mitocondriile inimii de șobolan și reconstrucția navetei L-lactat / piruvat. Biochem J (2002) 15:101-4. doi:10.1042/bj364010101
PubMed Abstract | Refef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Reconstrucția parțială a gluconeogenezei in vitro care rezultă din absorbția/metabolismul mitocondrial al L-lactatului și exportul de oxaloacetat prin intermediul unor noi translocători de L-lactat. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | Ref Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Lactatul, și nu piruvatul, este produsul final al glicolizei aerobe neuronale: un studiu electrofiziologic in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Dovezi pentru un complex mitocondrial de oxidare a lactatului în neuronii de șobolan: o componentă crucială pentru o navetă a lactatului cerebral. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transportul și metabolismul L-lactatului au loc în mitocondriile din celulele granulelor cerebeloase și sunt modificate în celulele supuse apoptozei dependente de potasiu scăzut. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. Afacerea mitocondrială L-lactat dehidrogenază. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. În capacitarea spermatozoizilor de mistreț, L-lactatul și succinatul, dar nu piruvatul și citratul, contribuie la creșterea potențialului membranei mitocondriale, monitorizată prin fluorescența safraninei O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | Refef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. Metabolismul L-lactatului în mitocondriile tuberculilor de cartof. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Navetele de lactat celulare și intracelulare. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | Ref Full Text | Google Scholar
16. Schurr A. Glicoliza cerebrală: un secol de neînțelegeri și concepții greșite persistente. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolismul lactatului: context istoric, interpretări greșite anterioare și înțelegere actuală. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | Refef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. Metabolismul L-lactatului poate avea loc în celulele prostatice normale și canceroase prin intermediul noii L-lactat dehidrogenaze mitocondriale. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. The role of mitochondrial transport in energy metabolism. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | Refef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Funcția mitocondrială in vivo evaluată prin fluorescența NADH: de la modele animale la studii umane. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Metabolismul L-lactatului în mitocondriile celulelor HEP G2 datorat L-lactat dehidrogenazei determină apariția navetei lactat/piruvat și apariția oxaloacetatului, malatului și citratului în afara mitocondriilor. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Expresia izoformei transportatorului de lactat mitocondrial și a membranei plasmatice și a izoformei lactat dehidrogenazei în liniile celulare de cancer mamar. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | Refef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Stabilirea și caracterizarea unei noi metode de evaluare a gluconeogenezei folosind linii celulare hepatice, H4IIE și HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Tan M, Cai Q. Efectul Warburg în progresia tumorală: metabolismul oxidativ mitocondrial ca mecanism anti-metastazic. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Capuano F, Palombini G, Galeotti T, Papa S. Transportul de piruvat în mitocondriile din diferite celule tumorale. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Metabolismul lactatului este asociat cu mitocondriile mamiferelor. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexaminarea metabolismului cancerului: producția de lactat pentru carcinogeneză ar putea fi scopul și explicația efectului Warburg. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically „fertilize” the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactatul generează peroxid de hidrogen în mitocondriile purificate din ficatul de șobolan datorită L-lactatului oxidază putativă localizată în spațiul intermembranar. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar