Ud over at være en glukoseprækursor i lever og nyre er l-laktat nu også blevet anerkendt som et energisubstrat i de fleste celler via dets oxidation til pyruvat. Denne oxidation, som antages at finde sted i cytosolen, katalyseres af l-laktatdehydrogenase, og pyruvat kataboliseres efterfølgende i mitokondrierne. For nylig blev det imidlertid erkendt, at mitokondrier spiller en rolle i l-laktatmetabolismen: Dianzani (1) foreslog, at der findes en mitokondriel l-laktatdehydrogenase (m-l-LDH), og senere påviste Baba og Sharma (2), at den befinder sig i mitokondriernes matrix (3). Faktisk blev l-laktattransport og -metabolisme påvist i forskellige mitokondrier, herunder skeletmuskulatur (4), rottehjerte (5), lever (6), hjerne (7-9), cerebellære granuleceller (10), gastrocnemius-celler fra kanin (11), sædceller (12), svinelever (13) og endda planter (14). Således blev eksistensen af m-l-LDH, som gennemgået af Passarella et al. (3), Brooks (15) og Schurr (16), anerkendt med dens optagelse i MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Som forventet, i lyset af tilstedeværelsen af l-LDH i matricen, er forekomsten af carriers for l-laktat blevet påvist i funktionelle undersøgelser med rensede, koblede mitokondrier. Disse omfatter l-laktat/H+-symporteren og l-laktat/pyruvat- og l-laktat/oxaloacetat-antiporterne (3). Overraskende nok er de overvældende beviser for et m-l-LDH placeret inde i mitokondrier ikke universelt accepteret, idet nogle forskere stadig er skeptiske over for eksistensen af m-l-LDH, mens andre lokaliserer m-l-LDH i intermembranrummet (17). Det er vores opfattelse, at denne skepsis kan skyldes vanskeligheder med at isolere koblede mitokondrier, hvilket ikke er en let opgave, især ikke med prøver fra skeletmuskulaturen, eller at man ikke er omhyggelig nok med valg af reaktionsmedier og anvendelse af inhibitorer i den korrekte koncentration (11). At m-l-LDH er lokaliseret inde i mitokondrier vil blive vist nedenfor.
Er l-Lactat transporteret og metaboliseret i kræftcellers mitokondrier?
Ja, det er det. Selv om Warburg i 1920’erne fandt, at kræftceller foretrækker at producere ATP ved glykolyse med produktion af l-laktat, var den mitokondrielle metabolisme af l-laktat så vidt vides ikke blevet undersøgt i kræftceller før 2010, hvor det første bevis for l-laktat-mitokondriel metabolisme i disse celler (allerede rapporteret i 2008 af Gabriella Chieppa i sin ph.d.-afhandling ved universitetet i Molise) blev offentliggjort (18). I dette tilfælde blev der til undersøgelse af l-laktattransport og -metabolisme i mitokondrier isoleret fra både normale og kræftprostataceller anvendt spektroskopiske og polarografiske teknikker, hvor enten m-l-LDH-reaktionen eller mitokondriernes iltforbrug, der blev forsynet med eksternt tilsat l-laktat, blev overvåget (19), i stedet for at anvende mere komplicerede procedurer, der er tilgængelige i molekylærbiologiske, genetiske og kemiske laboratorier. De to førstnævnte teknikker blev valgt, da de giver mulighed for kontinuerlig overvågning af kinetikken af de undersøgte processer i eksperimenter, der varer i flere minutter, hvor mitokondrierne forbliver koblet. Målinger med de sidstnævnte metoder foretages derimod normalt, når processerne allerede er afsluttet. Følgelig tyder en stigning i redoxtilstanden af de intramitokondrielle pyridinnukleotider, som vist ved fluorimetriske målinger, ved tilsætning af l-laktat til mitokondrier på, at l-laktatmetabolismen finder sted inde i organellerne via en NAD+-afhængig m-l-LDH; desværre blev forekomsten af mitokondriel l-laktatmetabolisme i kræftceller ikke citeret i Ferguson et al. (17), muligvis fordi forfatterne af reviewet anser de spektroskopiske og polarografiske teknikker for at være “problematiske”, på trods af deres udbredte anvendelse af mange forskere. At deres holdning er en minoritetsholdning kan eksemplificeres ved at citere fra en gennemgang af Mayevsky og Rogatsky (20), hvori det hedder, at “Det store antal publikationer fra forskellige grupper vidner om de værdifulde oplysninger, der er indsamlet under forskellige eksperimentelle forhold. Overvågningen af NADH-niveauet i vævet giver de vigtigste oplysninger om mitokondriernes metaboliske tilstand.” Eksistensen af m-l-LDH kan også bekræftes immunologisk i mitokondrier, som beviseligt er fri for cytosolisk kontaminering.
Bemærk, at i det tilfælde, hvor m-l-LDH foreslås lokaliseret i intermembranrummet, forklares stigningen i den intramitokondrielle pyridinnukleotidfluorescens på følgende måde: l-laktat kommer ind i det mitokondrielle intermembranrum, hvor det oxideres til pyruvat, som igen krydser den mitokondrielle indre membran for at blive oxideret inde i mitokondrierne via pyruvatdehydrogenase-komplekset . En sådan mekanisme støttes ikke af forskellige eksperimentelle resultater. F.eks. blev det i de Bari et al. (18) vist, at NAD+-reduktionen fortsætter på trods af tilstedeværelsen af arsenit, en inhibitor af pyruvatdehydrogenase, men at den hæmmes af oxamat, en inhibitor af l-LDH. Yderligere beviser mod tilstedeværelsen af m-l-LDH i intermembranrummet fremgår af eksperimentelle resultater, der viser, at l-laktat kommer ind i mitokondrier under forhold, hvor pyruvat er en ikke-penetrerende forbindelse (21), eller hvor pyruvat/H+-symporteren er blokeret af en inhibitor (6). Disse eksperimentelle metoder kan i fremtiden også anvendes til målinger af iltforbrug (i tilstedeværelse eller fravær af ADP), protonudstrømning og generering af membranpotentiale. Ved at anvende kontrolstyrkekriteriet med forskellige ikke-penetrerende inhibitorer (19) kan det fastslås, om hastigheden af ovennævnte processer afspejler hastigheden af l-laktattransporten gennem mitokondriemembranen eller ej. Dermed kan l-laktattransporten undersøges kvantitativt, herunder forekomsten af hyperbolisk kinetik, pH-profil osv. Desuden giver en sammenligning af hæmningsprofilerne for pyruvat- og l-laktatafhængige mitokondrieprocesser ved hjælp af forbindelser, der ikke kan trænge ind i mitokondrier, mulighed for at skelne mellem l-laktat- og pyruvatbærere.
Kort fortalt er det også blevet vist, at eksternt tilsat l-laktat kan trænge ind i både normale og kræftprostataceller og især på en bærermedieret måde trænge ind i deres mitokondrier, hvor der findes en l-LDH, som er placeret i det indre kompartment. Det er blevet påvist, at m-l-LDH’erne adskiller sig fra de cytosoliske enzymer, som selv adskiller sig fra hinanden. Normale og kræftceller viser forskelle med hensyn til m-l-LDH-proteinniveau og -aktivitet, hvor både enzymekspression og -aktivitet er højere i kræftceller.
I 2011 blev det påvist, at der findes monokarboxylattransporter (MCT) og LDH-proteiner i mitokondrielle retikler af brystkræftcellelinjer (22). I det tilfælde blev ekspressionen af både MCT’er og l-LDH målt, og deres mitokondrielle lokalisering blev bestemt via immunofluorescens, en teknik, der ikke gør det muligt at identificere den submitokondrielle lokalisering.
En bredere undersøgelse af l-laktattransport og metabolisme i kræftcellers mitokondrier blev udført i humane hepatocellulære karcinomceller (Hep G2) (21) (21), hvori glukoneogenese finder sted (23). Hep G2-cellemitokondrier (Hep G2-M) har et m-l-LDH, der er begrænset til det indre mitokondrielle kompartment. Det blev også konstateret, at cytosoliske og mitokondrielle l-LDH’er adskiller sig fra hinanden i deres mætningskinetik. Det er også blevet påvist, at der forekommer en carrier-medieret l-laktattransport i disse mitokondrier. Det er vigtigt, at udstrømningen af forskellige metabolitter, herunder pyruvat, oxaloacetat, malat og citrat, som følge af l-laktattilsætning til mitokondrier for første gang blev påvist, hvilket gav et første indblik i den rolle, som mitokondriernes metabolisme af l-laktat spiller; i overensstemmelse hermed blev det også påvist, at der forekommer en l-laktat/pyruvat-shuttle, der anvendes til oxidation af det cytosoliske NADH. I sidste ende overvinder fjernelsen af oxidationsproduktet ved carrier-medieret transport og mitokondriel metabolisme enhver teoretisk termodynamisk vanskelighed, som blev anset for at udelukke enhver l-laktatoxidation i mitokondrierne.
Disse resultater tyder stærkt på, at der er behov for en revision af den dogmatiske opfattelse af glukosemetabolismen med særlig fokus på l-laktats og m-l-LDH’s rolle i glukoneogenesen. Derfor kræver Cori-cyklussen (formuleret i 1929 som en energikrævende metabolisk vej hos dyr, hvor glukosens kulstofatomer passerer langs den cirkulære rute: muskelglykogen → blodlaktat → lever (hvor glukoneogenese finder sted) → blodglukose → muskelglukose → muskelglykogen) også en revision. I denne henseende er den cellulære l-laktatoxidation, som er nødvendig for produktionen af glukose i Cori-cyklusen, traditionelt blevet postuleret som værende foregået i cytosolen, men er den det? Det cytosoliske l–LDH (c-l-LDH) er et reducerende enzym, det sidste trin i den glycolytiske vej, som omdanner pyruvat til l-laktat og dermed sørger for regenerering af NAD+. Denne reaktion bør fortsætte ufortrødent, uanset om der er ilt til stede eller ej, da standardændringen i den frie energi (ΔG0′) ved omdannelse af pyruvat til l-laktat er ca. -6 kcal/mol. Desuden ville pyruvatets høje affinitet til c-l-LDH forklare, at det normale /-forhold i blod og andre væv er >10, en værdi, der ikke kan svare til forslaget om pyruvat som slutprodukt af glykolysen under normale forhold. Derfor er den dogmatiske fremstilling af denne reaktion som tovejsreaktion misvisende og er hidtil blevet accepteret på grund af fraværet af et muligt alternativ. Vi hævder, at l-laktatoxidation tilbage til pyruvat ikke finder sted i cytosolen, men i stedet i mitokondrierne. Der er faktisk kun to muligheder for at forhindre ophobning af l-laktat i cytosolen: enten transporteres l-laktat ud af cellen (under anaerobe forhold) og/eller oxideres via m-l-LDH ved transport ind i mitokondriet (under aerobe forhold). Derfor kan vi, selv om vi er enige med Lu et al. (24) i, at “størstedelen af det fra glykolyse afledte pyruvat omdirigeres til laktatfermentering”, ikke acceptere, at l-laktat “holdes væk fra mitokondriel oxidativ metabolisme.”
Af særlig interesse er det faktum, at pyruvat ikke kan komme ind i Hep G2-M. I modsætning til malat + glutamat og l-laktat kan eksternt tilsat pyruvat nemlig ikke forårsage hverken iltforbrug eller dannelse af membranpotentiale . Bemærk, at en forringelse af pyruvattransporten i kræftceller er blevet rapporteret af Paradies et al. (25). Derfor kan den klassiske Cori-cyklus, uafhængigt af den teoretiske umulighed af l-laktatoxidation i cytosolen, som det blev forklaret ovenfor, ikke finde sted i Hep G2-celler. Derfor tilbyder vi en revideret Cori-cyklus (figur 1), som involverer både de mitokondrielle transportører, der formidler den l-laktatafhængige trafik, og m-l-LDH, som tilfører pyruvat inde i mitokondrierne. Derfor bekræfter forekomsten uden for mitokondrier af oxaloacetat og malat, der stammer fra l-laktatoptagelse og -metabolisme via m-l-LDH, pyruvatdehydrogenase, pyruvatcarboxylase og malatdehydrogenase og ved udveksling, sandsynligvis på grund af l-laktat/oxaloacetat- og l-laktat/malat-antiportere, en anaplerotisk rolle for l-laktat i glukoneogenese, hvor mitokondrier spiller en unik rolle. Det er vigtigt at bemærke, at tilsætning af l-laktat til Hep G2-M resulterer i, at citrat, fedtsyreprækursoren, optræder uden for mitokondrier. Ved hjælp af højopløsningsmassespektrometri blev l-laktatoptagelse i mitokondrier af HeLa- og H460-celler derfor fundet og bevist, at det resulterer i lipidsyntese; desuden bekræftede transmissionselektronmikroskopi, at LDH er lokaliseret til mitokondrier (26). Overraskende nok er den anaplerotiske rolle, som l-laktat-mitokondriemetabolismen spiller, ikke blevet overvejet, da kræftmetabolismen blev “genundersøgt” (27).
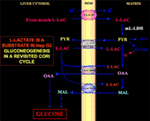
Figur 1. Cori-cyklus genbesøgt i Hep G2-celler. I betragtning af, at pyruvat ikke kan komme ind i Hep G2-M, som vist i Pizzuto et al. (21), når l-laktat produceret i musklerne leveren via blodstrømmen og kommer fra cytosolen ind i mitokondrierne; i matrixen giver l-laktatmetabolismen anledning til pyruvat (PYR) via m-L-LDH og derefter til oxaloacetat (OAA) og malat (MAL), som eksporteres fra mitokondrierne til cytosolen via tre formodede transportører, der skal bruges til l-laktat-pyruvat-shuttle og til glukoneogenese via en mekanisme, der ligner den, som de Bari et al. allerede har påvist. (6).
Vi mener, at den foreslåede revision af Cori-cyklusen, der er nødvendig for Hep G2-celler, også bør overvejes i alle andre celletyper, hvor mitokondriel metabolisme af l-laktat er aktiv. F.eks. blev der vist en delvis rekonstruktion af in vitro glukoneogenese som følge af mitokondriel l-laktatoptagelse/metabolisme i fravær af LDH uden for mitokondrier (6).
Den rolle, som den mitokondrielle l-laktatmetabolisme spiller, fortjener yderligere fokus: I betragtning af, at hydrogenperoxidproduktion i tumormikromiljøet giver brændstof til kræftcellers anabole vækst (28), bør en mulig rolle for den formodede mitokondrielle l-laktatoxidase (LOX), som genererer hydrogenperoxid i mitokondrier fra rottelever (29), undersøges; LOX-eksistensen i Hep G2-M synes at være i overensstemmelse med beviserne for, at rotenon, som blokerer iltforbrug induceret ved tilsætning af malat + glutamat, ikke hæmmer iltforbrug induceret ved tilsætning af l-laktat.
Forfatterbidrag
SP udtænkte denne udtalelse, delte den og skrev artiklen sammen med AS.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført i fravær af kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Revisor erklærede en fælles tilknytning, uden samarbejde, med en af forfatterne til den behandlende redaktør.
1. Dianzani MU. Fordeling af mælkesyreoxidase i lever- og nyreceller fra normale rotter og rotter med fedtdegeneration af leveren. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitokondrier og L-laktatmetabolisme. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Udholdenhedstræning, udtryk og fysiologi af LDH, MCT1 og MCT4 i menneskelige skeletmuskler. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-laktattransport til mitokondrier i rottehjerte og rekonstruktion af L-laktat/pyruvat-transporten. Biochem J (2002) 15:101-4. doi:10.1042/bj364010101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Delvis rekonstruktion af in vitro glukoneogenese som følge af mitokondriel L-laktatoptagelse/metabolisme og oxaloacetateksport via nye L-laktattranslocatorer. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Laktat: det ultimative cerebrale oxidative energisubstrat? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Laktat, ikke pyruvat, er neuronalt aerobt glykolyse slutprodukt: en in vitro elektrofysiologisk undersøgelse. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Bevis for et mitokondrielt laktatoxidationskompleks i rotte-neuroner: en afgørende komponent for en hjerne-laktatfærge. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport og metabolisme af L-laktat forekommer i mitokondrier fra cerebellære granuleceller og ændres i celler, der undergår lav kaliumafhængig apoptose. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. Den mitokondrielle L-laktatdehydrogenaseaffære. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Ved kapacitation af vildsvinssæd bidrager L-laktat og succinat, men ikke pyruvat og citrat, til stigningen i mitokondriernes membranpotentiale, som overvåges via safranin O-fluorescens. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. Forekomsten af L-laktatdehydrogenase i det indre mitokondrielle kompartment i svinelever. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Pizzuto R, Chieppa G, Passarella S. L-laktatmetabolisme i kartoffelknoldens mitokondrier. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Celle-celle- og intracellulære laktatfærger. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Cerebral glykolyse: et århundrede med vedvarende misforståelser og misforståelser. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Kane DA, Rightmire Z, Gladden LB. Laktatmetabolisme: historisk kontekst, tidligere fejlfortolkninger og nuværende forståelse. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-laktatmetabolisme kan forekomme i normale og kræftprostataceller via den nye mitokondrielle L-laktatdehydrogenase. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Den rolle, som mitokondrietransporten spiller i energimetabolismen. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitokondriefunktion in vivo evalueret ved NADH-fluorescens: fra dyremodeller til undersøgelser på mennesker. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-laktatmetabolisme i HEP G2-cellemitokondrier på grund af L-laktatdehydrogenase bestemmer forekomsten af laktat/pyruvat-shuttle og forekomsten af oxaloacetat, malat og citrat uden for mitokondrier. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitokondriel og plasmamembran laktattransportør og laktatdehydrogenase isoform ekspression i brystkræftcellelinjer. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Etablering og karakterisering af en ny metode til evaluering af glukoneogenese ved hjælp af hepatiske cellelinjer, H4IIE og HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. Warburg-effekten i tumorprogression: mitokondriel oxidativ metabolisme som en anti-metastasemekanisme. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport af pyruvat i mitochondrier fra forskellige tumorceller. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Laktatmetabolisme er forbundet med pattedyrs mitokondrier. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexamining cancer metabolism: Lactate production for carcinogenesis could be the purpose and explanation of the Warburg effect. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Kræftceller “befrugter” metabolisk tumormikromiljøet med hydrogenperoxid og driver Warburg-effekten: implikationer for PET-billeddannelse af menneskelige tumorer. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-laktat genererer hydrogenperoxid i rensede mitokondrier fra rottelever på grund af den putative L-laktatoxidase lokaliseret i intermembranrummet. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar