Además de ser un precursor de la glucosa en el hígado y el riñón, el l-lactato se reconoce ahora como un sustrato energético en la mayoría de las células mediante su oxidación a piruvato. Esta oxidación, que se supone que ocurre en el citosol, es catalizada por la l-lactato deshidrogenasa y el piruvato se cataboliza posteriormente en las mitocondrias. Sin embargo, recientemente se ha reconocido que las mitocondrias desempeñan un papel en el metabolismo del l-lactato: la existencia de una l-lactato deshidrogenasa mitocondrial (m-l-LDH) fue sugerida por Dianzani (1), y posteriormente se demostró por Baba y Sharma (2) que estaba localizada en la matriz mitocondrial (3). De hecho, el transporte y el metabolismo del l-lactato se demostró en varias mitocondrias, incluyendo el músculo esquelético (4), el corazón de rata (5), el hígado (6), el cerebro (7-9), las células granulares del cerebelo (10), el gastrocnemio de conejo (11), los espermatozoides (12), el hígado de cerdo (13) e incluso las plantas (14). Así, la existencia de m-l-LDH, tal y como revisaron Passarella et al. (3), Brooks (15) y Schurr (16), fue reconocida con su inclusión en la MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Como era de esperar, a la luz de la presencia de la l-LDH en la matriz, se ha demostrado la aparición de portadores de l-lactato en estudios funcionales con mitocondrias purificadas y acopladas. Estos incluyen el simportador de l-lactato/H+ y los antiportadores de l-lactato/piruvato y l-lactato/oxaloacetato (3). Sorprendentemente, la abrumadora evidencia de una m-l-LDH localizada en el interior de las mitocondrias no es aceptada universalmente, ya que algunos científicos siguen siendo escépticos sobre la existencia de la m-l-LDH, mientras que otros localizan la m-l-LDH en el espacio intermembranal (17). En nuestra opinión, el escepticismo podría deberse a las dificultades para aislar las mitocondrias acopladas, una tarea nada fácil, en particular con las muestras de músculo esquelético, o a no ser lo suficientemente cuidadoso en la selección de los medios de reacción y en el uso de inhibidores a la concentración correcta (11). A continuación se demostrará que la m-lDH se localiza en el interior de las mitocondrias.
¿Se transporta y metaboliza el l-lactato en las mitocondrias de las células cancerosas?
Sí, lo hace. Aunque en la década de 1920, Warburg descubrió que las células cancerosas prefieren producir ATP mediante la glucólisis con la producción de l-lactato, hasta donde sabemos, el metabolismo mitocondrial del l-lactato no se había investigado en las células cancerosas hasta 2010, cuando se publicaron las primeras evidencias del metabolismo mitocondrial del l-lactato en estas células (ya reportadas en 2008 por Gabriella Chieppa en su tesis doctoral en la Universidad de Molise) (18). En este caso, para estudiar el transporte y el metabolismo del l-lactato en mitocondrias aisladas de células de próstata normales y cancerosas, se utilizaron técnicas espectroscópicas y polarográficas, en las que se monitorizó la reacción de m-l-LDH o el consumo de oxígeno por parte de las mitocondrias, suministradas con l-lactato añadido externamente, respectivamente (19), en lugar de emplear procedimientos más complicados, disponibles en los laboratorios de biología molecular, genética y química. Se eligieron las dos primeras técnicas porque permiten el seguimiento continuo de la cinética de los procesos investigados en experimentos que duran varios minutos en los que las mitocondrias permanecen acopladas. Por el contrario, las mediciones con los últimos métodos suelen realizarse una vez que los procesos ya han finalizado. Por consiguiente, un aumento del estado redox de los nucleótidos de piridina intramitocondriales, tal como muestran las mediciones fluorimétricas, tras la adición de l-lactato a las mitocondrias indica que el metabolismo del l-lactato se produce en el interior de los orgánulos a través de una m-l-LDH dependiente del NAD+; lamentablemente, la ocurrencia del metabolismo mitocondrial del l-lactato en las células cancerosas no se citó en Ferguson et al. (17) posiblemente porque los autores de la revisión consideran que las técnicas espectroscópicas y polarográficas son «problemáticas», a pesar de su uso generalizado por numerosos científicos. Que la suya es una opinión minoritaria podría ejemplificarse citando una revisión de Mayevsky y Rogatsky (20), en la que se afirma que «El gran número de publicaciones de diferentes grupos atestigua la valiosa información obtenida en diversas condiciones experimentales. El seguimiento de los niveles de NADH en el tejido proporciona la información más importante sobre el estado metabólico de las mitocondrias». La existencia de m-l-LDH también puede confirmarse inmunológicamente en las mitocondrias que han demostrado estar libres de contaminación citosólica.
Nótese que en el caso de que se proponga que la m-lDH esté localizada en el espacio intermembrana, el aumento de la fluorescencia del nucleótido de piridina intramitocondrial se explica de la siguiente manera: el l-lactato entra en el espacio intermembrana mitocondrial donde se oxida a piruvato, que a su vez atraviesa la membrana interna mitocondrial para ser oxidado dentro de la mitocondria a través del complejo piruvato deshidrogenasa . Este mecanismo no está respaldado por varios hallazgos experimentales. Por ejemplo, en de Bari et al. (18), se demostró que la reducción de NAD+ procede a pesar de la presencia de arsenito, un inhibidor de la piruvato deshidrogenasa, pero es inhibida por el oxamato, un inhibidor de la l-LDH. Otras pruebas en contra de la presencia de m-l-LDH en el espacio intermembrana surgen de los resultados experimentales que muestran que el l-lactato entra en la mitocondria en condiciones en las que el piruvato es un compuesto no penetrante (21) o en las que el simportador de piruvato/H+ está bloqueado por un inhibidor (6). Estos enfoques experimentales pueden aplicarse también a las mediciones del consumo de oxígeno (en presencia o ausencia de ADP), el eflujo de protones y la generación de potencial de membrana en el futuro. Aplicando el criterio de fuerza de control con varios inhibidores no penetrantes (19) se puede establecer si la tasa de los procesos mencionados refleja o no la del transporte de l-lactato a través de la membrana mitocondrial. Así, se puede investigar cuantitativamente el transporte de l-lactato, incluyendo la ocurrencia de una cinética hiperbólica, el perfil de pH, etc. Además, la comparación realizada entre los perfiles de inhibición de los procesos mitocondriales dependientes de piruvato y de l-lactato mediante el uso de compuestos que no pueden entrar en las mitocondrias permite distinguir entre los portadores de l-lactato y de piruvato.
Brevemente, también se ha demostrado que el l-lactato añadido externamente puede entrar tanto en las células de próstata normales como en las cancerosas y, en particular, de forma mediada por un portador, entra en sus mitocondrias, donde existe una l-LDH que se encuentra en el compartimento interno. Se ha demostrado que las m-lDH se diferencian de las enzimas citosólicas que a su vez se diferencian entre sí. Las células normales y cancerosas muestran diferencias con respecto al nivel de proteína y actividad de las m-lDH, donde tanto la expresión como la actividad de la enzima son mayores en las células cancerosas.
En 2011, se demostró la existencia de proteínas del transportador de monocarboxilato (MCT) y de la LDH en retículos mitocondriales de líneas celulares de cáncer de mama (22). En ese caso, se midió la expresión tanto de MCT como de l-LDH, y se determinó su localización mitocondrial mediante inmunofluorescencia, una técnica que no permite identificar la localización submitocondrial.
Una investigación más amplia sobre el transporte y el metabolismo del l-lactato en las mitocondrias de células cancerosas se llevó a cabo en células de carcinoma hepatocelular humano (Hep G2) (21) en las que tiene lugar la gluconeogénesis (23). Las mitocondrias de las células Hep G2 (Hep G2-M) poseen una m-l-LDH restringida al compartimento mitocondrial interno. También se encontró que las l-LDH citosólica y mitocondrial difieren entre sí en su cinética de saturación. También se ha demostrado la existencia de un transporte de l-lactato mediado por un portador en estas mitocondrias. Es importante destacar que se demostró por primera vez el eflujo de varios metabolitos, incluyendo piruvato, oxaloacetato, malato y citrato, resultante de la adición de l-lactato a las mitocondrias, lo que dio una primera visión del papel del metabolismo mitocondrial del l-lactato; en consecuencia, también se demostró la ocurrencia de una lanzadera de l-lactato/piruvato dedicada a la oxidación del NADH citosólico. En última instancia, la eliminación del producto de la oxidación mediante el transporte mediado por el portador y el metabolismo mitocondrial supera cualquier dificultad termodinámica teórica que se consideraba que descartaba cualquier oxidación de l-lactato en la mitocondria.
Estos hallazgos sugieren fuertemente que es necesaria una revisión de la visión dogmática del metabolismo de la glucosa con un enfoque especial en el papel del l-lactato y la m-lDH en la gluconeogénesis. Por lo tanto, el ciclo de Cori (formulado en 1929 como una vía metabólica que requiere energía en los animales, en la que los átomos de carbono de la glucosa pasan por la ruta circular: glucógeno muscular → lactato sanguíneo → hígado (donde se produce la gluconeogénesis) → glucosa sanguínea → glucosa muscular → glucógeno muscular) también exige una revisión. En este sentido, se ha postulado tradicionalmente que la oxidación celular del l-lactato, necesaria para la producción de glucosa en el ciclo de Cori, tiene lugar en el citosol, pero ¿es así? La l-LDH citosólica (c-l-LDH) es una enzima reductora, el último paso de la vía glucolítica, que convierte el piruvato en l-lactato, y proporciona así la regeneración de NAD+. Esta reacción debería proceder sin problemas, independientemente de la presencia o ausencia de oxígeno, ya que el cambio de energía libre estándar (ΔG0′) de la conversión de piruvato a l-lactato es de aproximadamente -6 kcal/mol. Además, la alta afinidad del piruvato por la c-lDH explicaría el hecho de que la relación normal / en la sangre y otros tejidos sea >10, un valor que no puede corresponderse con la propuesta del piruvato como producto final de la glucólisis en condiciones normales. Por lo tanto, la representación dogmática de esta reacción como bidireccional es engañosa y ha sido aceptada hasta la fecha debido a la ausencia de una posible alternativa. Nosotros sostenemos que la oxidación de l-lactato a piruvato no tiene lugar en el citosol, sino que se produce en la mitocondria. De hecho, sólo hay dos opciones para evitar la acumulación de l-lactato en el citosol, o bien el l-lactato es transportado fuera de la célula (en condiciones anaeróbicas) y/o es oxidado a través de la m-l-LDH en su transporte a la mitocondria (en condiciones aeróbicas). Por lo tanto, incluso si estamos de acuerdo con Lu et al. (24) en que «la mayor parte del piruvato derivado de la glucólisis se desvía a la fermentación del lactato», no podemos aceptar que el l-lactato se «mantenga alejado del metabolismo oxidativo mitocondrial»
De especial interés es el hecho de que el piruvato no puede entrar en la Hep G2-M. De hecho, al contrario de lo que ocurre con el malato + glutamato y el l-lactato, el piruvato añadido externamente no provoca ni el consumo de oxígeno ni la generación de potencial de membrana . Obsérvese que el transporte de piruvato en las células cancerosas se ha visto afectado por Paradies et al. (25). Por lo tanto, independientemente de la inviabilidad teórica de la oxidación de l-lactato en el citosol, como se explicó anteriormente, el ciclo Cori clásico no puede ocurrir en las células Hep G2. Por lo tanto, ofrecemos un ciclo Cori revisado (Figura 1), que implica tanto a los transportadores mitocondriales que median el tráfico dependiente de l-lactato como a la m-l-LDH, que proporciona piruvato dentro de las mitocondrias. En consecuencia, la aparición fuera de las mitocondrias de oxaloacetato y malato derivados de la captación y el metabolismo del l-lactato a través de la m-lDH, la piruvato deshidrogenasa, la piruvato carboxilasa y la malato deshidrogenasa y por intercambios, probablemente debidos a los antiportadores l-lactato/oxaloacetato y l-lactato/malato, confirma un papel anaplerótico del l-lactato en la gluconeogénesis en el que las mitocondrias desempeñan un papel único. Es importante destacar que la adición de l-lactato a la Hep G2-M da lugar a la aparición fuera de las mitocondrias de citrato, el precursor de los ácidos grasos. En consecuencia, mediante el uso de la espectrometría de masas de alta resolución, se descubrió que la captación de l-lactato en las mitocondrias de las células HeLa y H460 daba lugar a la síntesis de lípidos; además, la microscopía electrónica de transmisión confirmó que la LDH está localizada en las mitocondrias (26). Sorprendentemente, el papel anaplerótico del metabolismo mitocondrial del l-lactato no ha sido considerado cuando se «reexaminó» el metabolismo del cáncer (27).
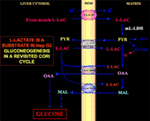
Figura 1. Ciclo de Cori revisado en células Hep G2. Dado que el piruvato no puede entrar en la Hep G2-M, como se muestra en Pizzuto et al. (21), el l-lactato producido en los músculos llega al hígado a través del torrente sanguíneo y desde el citosol entra en las mitocondrias; en la matriz, el metabolismo del l-lactato da lugar a piruvato (PYR) a través de la m-L-LDH y, a continuación, a oxaloacetato (OAA) y malato (MAL), que se exportan desde las mitocondrias al citosol a través de tres portadores putativos para ser utilizados por la lanzadera de l-lactato-piruvato y para que se produzca la gluconeogénesis a través de un mecanismo similar al ya demostrado por de Bari et al. (6).
Creemos que la revisión propuesta del ciclo de Cori, necesaria para las células Hep G2, debería considerarse también en todos los demás tipos de células en las que el metabolismo mitocondrial del l-lactato está activo. Por ejemplo, se demostró la reconstrucción parcial de la gluconeogénesis in vitro derivada de la captación/metabolismo mitocondrial del l-lactato en ausencia de LDH fuera de las mitocondrias (6).
El papel del metabolismo mitocondrial del l-lactato merece mayor atención: dado que la producción de peróxido de hidrógeno en el microambiente tumoral alimenta el crecimiento anabólico de las células cancerosas (28), debe investigarse un posible papel de la putativa l-lactato oxidasa mitocondrial (LOX) que genera peróxido de hidrógeno en las mitocondrias de hígado de rata (29); la existencia de LOX en la Hep G2-M parece ser coherente con la evidencia de que la rotenona, que bloquea el consumo de oxígeno inducido por la adición de malato + glutamato no logra inhibir el consumo de oxígeno inducido por la adición de l-lactato.
Contribuciones de los autores
SP concibió esta opinión, la compartió y escribió el artículo con AS.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
El revisor declaró una afiliación compartida, sin colaboración, con uno de los autores al editor encargado.
1. Dianzani MU. Distribución de la oxidasa del ácido láctico en las células del hígado y del riñón de ratas normales y de ratas con degeneración grasa del hígado. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Entrenamiento de resistencia, expresión y fisiología de LDH, MCT1 y MCT4 en el músculo esquelético humano. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-lactate transport into rat heart mitochondria and reconstruction of the L-lactate/pyruvate shuttle. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Reconstrucción parcial de la gluconeogénesis in vitro a partir de la captación/metabolismo mitocondrial de L-lactato y la exportación de oxaloacetato a través de nuevos translocadores de L-lactato. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. El lactato, no el piruvato, es el producto final de la glucólisis aeróbica neuronal: un estudio electrofisiológico in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Evidence for a mitochondrial lactate oxidation complex in rat neurons: a crucial component for a brain lactate shuttle. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport and metabolism of L-lactate occur in mitochondria from cerebellar granule cells and are modified in cells undergoing low potassium dependent apoptosis. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. El asunto de la L-lactato deshidrogenasa mitocondrial. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. In boar sperm capacitation L-lactate and succinate, but not pyruvate and citrate, contribute to the mitochondrial membrane potential increase as monitored via safranine O fluorescence. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lactate metabolism in potato tuber mitochondria. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Cell-cell and intracellular lactate shuttles. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Glucólisis cerebral: un siglo de persistentes malentendidos y conceptos erróneos. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolismo del lactato: contexto histórico, interpretaciones erróneas anteriores y comprensión actual. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. El metabolismo del L-lactato puede ocurrir en células de próstata normales y cancerosas a través de la nueva L-lactato deshidrogenasa mitocondrial. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. The role of mitochondrial transport in energy metabolism. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitochondrial function in vivo evaluated by NADH fluorescence: from animal models to human studies. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. El metabolismo del L-lactato en las mitocondrias de las células HEP G2 debido a la L-lactato deshidrogenasa determina la aparición de la lanzadera lactato/piruvato y la aparición de oxaloacetato, malato y citrato fuera de las mitocondrias. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitochondrial and plasma membrane lactate transporter and lactate dehydrogenase isoform expression in breast cancer cell lines. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Establecimiento y caracterización de un nuevo método para evaluar la gluconeogénesis utilizando líneas celulares hepáticas, H4IIE y HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. El efecto Warburg en la progresión tumoral: el metabolismo oxidativo mitocondrial como mecanismo antimetastásico. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport of pyruvate in mitochondria from different tumor cells. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. El metabolismo del lactato está asociado a las mitocondrias de los mamíferos. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexaminando el metabolismo del cáncer: la producción de lactato para la carcinogénesis podría ser el propósito y la explicación del efecto Warburg. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martínez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Las células cancerosas «fertilizan» metabólicamente el microambiente tumoral con peróxido de hidrógeno, impulsando el efecto Warburg: implicaciones para las imágenes PET de los tumores humanos. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. El L-lactato genera peróxido de hidrógeno en mitocondrias purificadas de hígado de rata debido a la putativa L-lactato oxidasa localizada en el espacio intermembrana. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar