Amellett, hogy az l-laktát a májban és a vesében glükóz prekurzor, ma már a legtöbb sejtben energiaszubsztrátként is felismerik a piruváttá történő oxidációja révén. Ezt az oxidációt, amely feltételezhetően a citoszolban történik, az l-laktát-dehidrogenáz katalizálja, a piruvát pedig ezt követően a mitokondriumokban katabolizálódik. Nemrégiben azonban felismerték, hogy a mitokondriumok is szerepet játszanak az l-laktát-metabolizmusban: Dianzani (1) felvetette egy mitokondriális l-laktát-dehidrogenáz (m-l-LDH) létezését, majd később Baba és Sharma (2) kimutatta, hogy a mitokondriális mátrixban található (3). Az l-laktát transzportját és metabolizmusát valóban kimutatták különböző mitokondriumokban, többek között a vázizomban (4), patkányszívben (5), májban (6), agyban (7-9), kisagyi szemcsesejtekben (10), nyúl gastrocnemiusban (11), spermiumsejtekben (12), sertésmájban (13) és még a növényben is (14). Így az m-l-LDH létezését, amint azt Passarella és munkatársai (3), Brooks (15) és Schurr (16) áttekintették, a MitoCartába (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl) való felvételével ismerték el. A várakozásoknak megfelelően, tekintettel az l-LDH jelenlétére a mátrixban, az l-laktát hordozóinak előfordulását kimutatták a tisztított, kapcsolt mitokondriumokkal végzett funkcionális vizsgálatokban. Ezek közé tartozik az l-laktát/H+ szimporter és az l-laktát/piruvát és l-laktát/oxalacetát antiporterek (3). Meglepő módon a mitokondrium belsejében elhelyezkedő m-l-LDH elsöprő bizonyítéka nem általánosan elfogadott, egyes tudósok még mindig szkeptikusak az m-l-LDH létezésével kapcsolatban, míg mások az intermembrán térben lokalizálják az m-l-LDH-t (17). Véleményünk szerint a szkepticizmus a kapcsolt mitokondriumok izolálásának nehézségeiből eredhet, ami nem könnyű feladat, különösen a vázizomminták esetében, vagy abból, hogy nem elég körültekintő a reakcióközegek kiválasztása és a megfelelő koncentrációjú inhibitorok használata (11). Azt, hogy az m-l-LDH a mitokondriumokban lokalizálódik, az alábbiakban mutatjuk be.
Az l-laktátot a rákos sejtek mitokondriumaiban szállítják és metabolizálják?
Igen, így van. Bár az 1920-as években Warburg megállapította, hogy a rákos sejtek inkább glikolízissel termelnek ATP-t l-laktáttermeléssel, legjobb tudomásunk szerint az l-laktát mitokondriális anyagcseréjét nem vizsgálták rákos sejtekben egészen 2010-ig, amikor is megjelent az első bizonyíték az l-laktát mitokondriális anyagcseréjére ezekben a sejtekben (amelyről már 2008-ban beszámolt Gabriella Chieppa a Molise Egyetemen írt PhD-dolgozatában) (18). Ebben az esetben a normál és rákos prosztata sejtekből izolált mitokondriumokban történő l-laktát-transzport és -anyagcsere tanulmányozására spektroszkópiai és polarográfiás technikákat alkalmaztak, amelyekben vagy az m-l-L-LDH reakciót, vagy a külsőleg hozzáadott l-laktáttal táplált mitokondriumok oxigénfogyasztását követték nyomon (19), ahelyett, hogy a molekuláris biológiai, genetikai és kémiai laboratóriumokban rendelkezésre álló bonyolultabb eljárásokat alkalmazták volna. Az előbbi két technikát választottuk, mivel ezek lehetővé teszik a vizsgált folyamatok kinetikájának folyamatos nyomon követését olyan, több percig tartó kísérletekben, amelyekben a mitokondriumok összekapcsolva maradnak. Ezzel szemben az utóbbi módszerekkel végzett mérések általában akkor történnek, amikor a folyamatok már befejeződtek. Ennek megfelelően az intramitokondriális piridin-nukleotidok redoxállapotának fluorimetriás mérésekkel kimutatott növekedése az l-laktát mitokondriumokhoz való hozzáadásakor arra utal, hogy az l-laktát-metabolizmus a szerveztek belsejében zajlik egy NAD+-függő m-l-LDH-n keresztül; sajnos a mitokondriális l-laktát-metabolizmus rákos sejtekben való előfordulását nem idézte a Ferguson et al. (17) valószínűleg azért, mert az áttekintés szerzői a spektroszkópiai és polarográfiás technikát “problematikusnak” tartják, annak ellenére, hogy számos tudós széles körben használja. Azt, hogy az ő véleményük kisebbségi vélemény, talán jól példázza egy idézet Mayevsky és Rogatsky (20) áttekintéséből, amely szerint “A különböző csoportok által publikált nagyszámú közlemény tanúskodik a különböző kísérleti körülmények között gyűjtött értékes információkról. A szövetek NADH-szintjének megfigyelése a legfontosabb információt a mitokondriumok metabolikus állapotáról szolgáltatja”. Az m-l-LDH létezése immunológiailag is igazolható olyan mitokondriumokban, amelyek bizonyítottan mentesek a citoszolikus szennyeződéstől.
Megjegyezzük, hogy abban az esetben, amikor az m-l-LDH lokalizációját a membránközi térben javasolják, az intramitokondriális piridin nukleotid fluoreszcencia növekedése a következőképpen magyarázható: az l-laktát belép a mitokondriális intermembrán térbe, ahol piruváttá oxidálódik, amely viszont áthalad a mitokondriális belső membránon, hogy a piruvát-dehidrogenáz komplexen keresztül a mitokondriumon belül oxidálódjon . Ezt a mechanizmust különböző kísérleti eredmények nem támasztják alá. Például de Bari és munkatársai (18) kimutatták, hogy a NAD+ redukció a piruvát-dehidrogenáz inhibitorának, az arzenitnek a jelenléte ellenére is folytatódik, de az oxamát, az l-LDH inhibitora gátolja. További bizonyítékot szolgáltatnak az m-l-LDH intermembrán térben való jelenléte ellen azok a kísérleti eredmények, amelyek azt mutatják, hogy az l-laktát olyan körülmények között jut be a mitokondriumokba, amikor a piruvát nem penetráns vegyület (21), vagy amikor a piruvát/H+ szimportert gátolja egy inhibitor (6). Ezek a kísérleti megközelítések a jövőben az oxigénfogyasztás (ADP jelenlétében vagy hiányában), a protonkiáramlás és a membránpotenciál generálásának mérésére is alkalmazhatók. A kontrollerősség kritériumának különböző, nem penetráns inhibitorokkal történő alkalmazásával (19) megállapítható, hogy a fenti folyamatok sebessége tükrözi-e a mitokondriális membránon keresztüli l-laktát-transzport sebességét vagy sem. Így az l-laktát-transzport kvantitatív módon vizsgálható, beleértve a hiperbolikus kinetika előfordulását, a pH-profilt stb. Továbbá a piruvát- és az l-laktát-függő mitokondriális folyamatok gátlási profiljai között a mitokondriumokba bejutni nem képes vegyületek alkalmazásával végzett összehasonlítás lehetővé teszi az l-laktát- és piruvát-hordozók megkülönböztetését.
Röviden azt is kimutatták, hogy a kívülről hozzáadott l-laktát mind a normál, mind a rákos prosztata sejtekbe bejuthat, és különösen a hordozó által közvetített módon jut be a mitokondriumokba, ahol létezik egy l-LDH, amely a belső kompartmentben található. Az m-l-LDH-k bizonyítottan különböznek a citoszolikus enzimektől, amelyek maguk is különböznek egymástól. A normál és a rákos sejtek különbséget mutatnak az m-l-LDH fehérjeszintje és aktivitása tekintetében, ahol mind az enzim expressziója, mind az aktivitása magasabb a rákos sejtekben.
2011-ben kimutatták a monokarboxilát transzporter (MCT) és az LDH fehérjék létezését az emlőrákos sejtvonalak mitokondriális retikuláiban (22). Ebben az esetben mind az MCT-k, mind az l-LDH expresszióját megmértük, és mitokondriális lokalizációjukat immunfluoreszcenciával határoztuk meg, amely technika nem teszi lehetővé a szubszubjektokondriális lokalizáció azonosítását.
A rákos sejtek mitokondriumaiban zajló l-laktát-transzport és -anyagcsere szélesebb körű vizsgálatát humán hepatocelluláris karcinóma (Hep G2) sejtekben végeztük (21), amelyekben glükoneogenezis zajlik (23). A Hep G2 sejtek mitokondriumai (Hep G2-M) a belső mitokondriális kompartmentre korlátozódó m-l-LDH-val rendelkeznek. A citoszolikus és a mitokondriális l-LDH-k telítési kinetikája is különbözik egymástól. Kimutatták a hordozó által közvetített l-laktát-transzport előfordulását is ezekben a mitokondriumokban. Fontos, hogy először mutatták ki a különböző metabolitok, köztük a piruvát, az oxalacetát, a malát és a citrát mitokondriumokba történő l-laktát-addícióból eredő kiáramlását, ami első ízben adott betekintést az l-laktát mitokondriális metabolizmusának szerepébe; ennek megfelelően kimutatták a citoszolikus NADH oxidációjának szentelt l-laktát/piruvát transzfer előfordulását is. Végső soron az oxidációs termék hordozó által közvetített transzport és mitokondriális metabolizmus révén történő eltávolítása legyőzi az elméleti termodinamikai nehézségeket, amelyekről úgy vélték, hogy kizárják az l-laktát oxidációját a mitokondriumokban.
Ezek az eredmények határozottan arra utalnak, hogy a glükózanyagcseréről alkotott dogmatikus nézet felülvizsgálatára van szükség, különös tekintettel az l-laktát és az m-l-LDH szerepére a glükoneogenezisben. Ezért a Cori-ciklus (amelyet 1929-ben fogalmaztak meg, mint az állatok energiaigényes anyagcsere-útvonalát, ahol a glükóz szénatomjai körkörös úton haladnak: izomglikogén → vérlaktát → máj (ahol a glükoneogenezis zajlik) → vércukor → izomglükóz → izomglikogén) szintén felülvizsgálatot igényel. E tekintetben a celluláris l-laktát-oxidációt, amely a Cori-ciklusban a glükóz előállításához szükséges, hagyományosan úgy posztulálták, hogy a citoszolban zajlik, de vajon így van-e? A citoszolikus-l-L-LDH (c-l-LDH) egy redukáló enzim, a glikolitikus útvonal utolsó lépése, amely a piruvátot l-laktáttá alakítja, és így biztosítja a NAD+ regenerációját. Ennek a reakciónak az oxigén jelenlététől vagy hiányától függetlenül zavartalanul kell lejátszódnia, mivel a piruvát l-laktáttá történő átalakulásának standard szabadenergia-változása (ΔG0′) körülbelül -6 kcal/mol. Ezenkívül a piruvát nagy affinitása a c-l-LDH-hoz megmagyarázná azt a tényt, hogy a vérben és más szövetekben a normál / arány >10, egy olyan érték, amely nem felelhet meg a piruvátnak mint a glikolízis végtermékének normál körülmények között történő javaslatának. Ezért e reakció kétirányúként való dogmatikus ábrázolása félrevezető, és a lehetséges alternatíva hiányában mindeddig elfogadott. Azt állítjuk, hogy az l-laktát piruváttá történő visszaalakítása nem a citoszolban, hanem a mitokondriumokban történik. Valójában csak két lehetőség van az l-laktát citoszolban való felhalmozódásának megakadályozására: az l-laktátot vagy ki kell szállítani a sejtből (anaerob körülmények között) és/vagy a mitokondriumba történő szállításakor (aerob körülmények között) az m-l-LDH-n keresztül oxidálni kell. Ezért, még ha egyet is értünk Lu és munkatársaival (24) abban, hogy “a glikolízisből származó piruvát nagy része a laktátfermentációra irányul”, nem fogadhatjuk el, hogy az l-laktát “távol marad a mitokondriális oxidatív metabolizmustól.”
Különös érdekesség, hogy a piruvát nem tud bejutni a Hep G2-M-be. Valójában, ellentétben a malát + glutamáttal és az l-laktáttal, a külsőleg hozzáadott piruvát nem okoz sem oxigénfogyasztást, sem membránpotenciál generálást . Megjegyzendő, hogy a piruvát transzportjának károsodásáról a rákos sejtekben Paradies és munkatársai (25) számoltak be. Ezért, függetlenül az l-laktát oxidáció elméleti megvalósíthatatlanságától a citoszolban, amint azt fentebb kifejtettük, a klasszikus Cori-ciklus nem játszódhat le a Hep G2sejtekben. Ezért egy felülvizsgált Cori-ciklust ajánlunk (1. ábra), amely magában foglalja mind az l-laktát-függő forgalmat közvetítő mitokondriális hordozókat, mind az m-l-LDH-t, amely a mitokondriumokon belül biztosítja a piruvátot. Ennek megfelelően az l-laktát felvételéből és metabolizmusából származó oxalaktát és malát megjelenése a mitokondriumokon kívül az m-l-L-LDH, a piruvát-dehidrogenáz, a piruvát-karboxiláz és a malát-dehidrogenáz, valamint a cserék révén, valószínűleg az l-laktát/oxalaktát és l-laktát/malát antiportereknek köszönhetően, megerősíti az l-laktát anaplerotikus szerepét a glükoneogenezisben, amelyben a mitokondriumok egyedülálló szerepet játszanak. Fontos, hogy az l-laktát hozzáadása a Hep G2-M-hez a zsírsav prekurzor, a citrát megjelenését eredményezi a mitokondriumokon kívül. Ennek megfelelően nagyfelbontású tömegspektrometria segítségével megállapították és bizonyították, hogy az l-laktát felvétele a HeLa- és H460-sejtek mitokondriumaiba lipidszintézist eredményez; emellett transzmissziós elektronmikroszkópia megerősítette, hogy az LDH a mitokondriumokban lokalizálódik (26). Meglepő módon az l-laktát mitokondriális anyagcseréjének anaplerotikus szerepét nem vették figyelembe, amikor a rákos anyagcserét “újra megvizsgálták” (27).
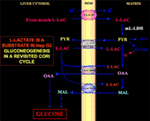
1. ábra. A Cori-ciklus újragondolása Hep G2 sejtekben. Tekintettel arra, hogy a piruvát nem tud belépni a Hep G2-M-be, amint azt Pizzuto et al. (21), az izmokban termelt l-laktát a véráram útján jut a májba, és a citoszolból a mitokondriumokba kerül; a mátrixban az l-laktát-metabolizmusból az m-L-LDH-n keresztül piruvát (PYR), majd oxalacetát (OAA) és malát (MAL) keletkezik, amelyek a mitokondriumokból három feltételezett hordozón keresztül a citoszolba kerülnek, hogy az l-laktát-piruvát transzferhez és a glükoneogenezishez használhatók legyenek a de Bari et al. által már bemutatott mechanizmushoz hasonló mechanizmuson keresztül. (6).
Úgy véljük, hogy a Cori-ciklus javasolt felülvizsgálatát, amely a Hep G2 sejtek esetében szükséges, minden más sejttípusban is figyelembe kell venni, ahol az l-laktát mitokondriális metabolizmusa aktív. Például a mitokondriális l-laktátfelvételből/metabolizmusból eredő in vitro glükoneogenezis részleges rekonstrukcióját mutatták ki a mitokondriumokon kívüli LDH hiányában (6).
A mitokondriális l-laktát-metabolizmus szerepe további figyelmet érdemel: tekintettel arra, hogy a tumor mikrokörnyezetében a hidrogén-peroxid-termelés táplálja a rákos sejtek anabolikus növekedését (28), meg kell vizsgálni a feltételezett mitokondriális l-laktát-oxidáz (LOX) lehetséges szerepét, amely hidrogén-peroxidot termel a patkánymáj mitokondriumaiban (29); a LOX létezése a Hep G2-M-ben összhangban tűnik azzal a bizonyítékkal, hogy a rotenon, amely gátolja a malát + glutamát hozzáadásával indukált oxigénfogyasztást, nem gátolja az l-laktát hozzáadásával indukált oxigénfogyasztást.
A szerzők közreműködése
SP fogalmazta meg ezt a véleményt, megosztotta azt és írta a tanulmányt AS-szel.
Enyilatkozat az összeférhetetlenségről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A bíráló a kezelőszerkesztőnek nyilatkozott az egyik szerzővel való közös, együttműködés nélküli kapcsolatról.
1. Dianzani MU. A tejsav-oxidáz eloszlása normál patkányok és zsíros májdegenerációban szenvedő patkányok máj- és vesesejtjeiben. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Állóképességi edzés, az LDH, az MCT1 és az MCT4 expressziója és fiziológiája az emberi vázizomzatban. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-laktát transzport a patkányszív mitokondriumaiba és az L-laktát/piruvát transzfer rekonstrukciója. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Az in vitro glükoneogenezis részleges rekonstrukciója, amely a mitokondriális L-laktát felvételből/metabolizmusból és oxalacetát exportból származik új L-laktát-transzlokátorokon keresztül. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. A laktát, nem a piruvát a neuronális aerob glikolízis végterméke: egy in vitro elektrofiziológiai vizsgálat. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Bizonyíték egy mitokondriális laktát oxidációs komplexre patkány neuronokban: az agyi laktát transzfer döntő komponense. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Az L-laktát transzportja és metabolizmusa a kisagyi szemcsesejtek mitokondriumaiban történik, és módosul az alacsony káliumfüggő apoptózison átesett sejtekben. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. A mitokondriális L-laktát-dehidrogenáz ügye. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. A vaddisznó spermiumok kapacitációjában az L-laktát és a szukcinát, de nem a piruvát és a citrát járul hozzá a mitokondriális membránpotenciál növekedéséhez, amit a szafranin O fluoreszcenciával követnek nyomon. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. Az L-laktát-dehidrogenáz előfordulása a sertésmáj belső mitokondriális kompartmentjében. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-laktát anyagcsere a burgonyagumó mitokondriumaiban. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Sejt-sejt és intracelluláris laktát transzferek. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Agyi glikolízis: egy évszázadnyi tartós félreértés és tévhit. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. A laktát-anyagcsere: történelmi összefüggések, korábbi téves értelmezések és a jelenlegi megértés. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. Az L-laktát anyagcsere normális és rákos prosztata sejtekben az új mitokondriális L-laktát dehidrogenázon keresztül történhet. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. A mitokondriális transzport szerepe az energiaanyagcserében. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. A mitokondriális funkció in vivo értékelése NADH-fluoreszcenciával: az állatmodellektől a humán vizsgálatokig. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Az L-laktát metabolizmus a HEP G2 sejt mitokondriumaiban az L-laktát dehidrogenáz miatt meghatározza a laktát/piruvát transzfer előfordulását és az oxalacetát, malát és citrát megjelenését a mitokondriumokon kívül. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitokondriális és plazmamembrán laktát transzporter és laktát dehidrogenáz izoformák expressziója emlőrákos sejtvonalakban. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. A glükoneogenezis értékelésére szolgáló új módszer létrehozása és jellemzése májsejtvonalak, H4IIE és HepG2 segítségével. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. A Warburg-effektus a tumorprogresszióban: a mitokondriális oxidatív metabolizmus mint anti-metasztázis mechanizmus. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. A piruvát transzportja különböző tumorsejtek mitokondriumaiban. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. A laktát anyagcsere az emlős mitokondriumokhoz kapcsolódik. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. A rákos anyagcsere újbóli vizsgálata: a karcinogenezishez szükséges laktáttermelés lehet a Warburg-effektus célja és magyarázata. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically “fertilize” the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. Az L-laktát az intermembrán térben lokalizált putatív L-laktát oxidáznak köszönhetően hidrogén-peroxidot termel tisztított patkánymáj mitokondriumokban. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar