Oltre ad essere un precursore del glucosio nel fegato e nei reni, l-lattato è ora anche riconosciuto come un substrato energetico nella maggior parte delle cellule attraverso la sua ossidazione a piruvato. Questa ossidazione, che si presume avvenga nel citosol, è catalizzata dalla l-lattato deidrogenasi con il piruvato successivamente catabolizzato nei mitocondri. Tuttavia, recentemente è stato riconosciuto che i mitocondri svolgono un ruolo nel metabolismo del lattato: l’esistenza di una l-lattato deidrogenasi mitocondriale (m-l-LDH) è stata suggerita da Dianzani (1), e successivamente è stato dimostrato da Baba e Sharma (2) che si trova nella matrice mitocondriale (3). Infatti, il trasporto e il metabolismo del lattato è stato dimostrato in vari mitocondri, tra cui il muscolo scheletrico (4), il cuore di ratto (5), il fegato (6), il cervello (7-9), le cellule del granulo cerebellare (10), il gastrocnemio di coniglio (11), le cellule dello sperma (12), il fegato di maiale (13) e persino le piante (14). Così, l’esistenza di m-l-LDH, come rivisto da Passarella et al. (3), Brooks (15), e Schurr (16), è stato riconosciuto con la sua inclusione nel MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Come previsto, alla luce della presenza del l-LDH nella matrice, la presenza di trasportatori per l-lattato è stata dimostrata in studi funzionali con mitocondri purificati e accoppiati. Questi includono il simporter l-lattato/H+ e gli antiporters l-lattato/piruvato e l-lattato/ossalacetato (3). Sorprendentemente, la prova schiacciante di un m-l-LDH situato all’interno dei mitocondri non è universalmente accettata, con alcuni scienziati ancora scettici sull’esistenza del m-l-LDH, mentre altri localizzano il m-l-LDH nello spazio intermembrana (17). È nostra opinione che lo scetticismo potrebbe avere origine a causa delle difficoltà nell’isolare i mitocondri accoppiati, un compito non facile, in particolare con campioni di muscoli scheletrici, o non essere abbastanza attenti nella selezione dei mezzi di reazione e nell’uso di inibitori alla concentrazione corretta (11). Il fatto che m-l-LDH sia localizzato all’interno dei mitocondri sarà dimostrato di seguito.
Il lattato è trasportato e metabolizzato nei mitocondri delle cellule tumorali?
Sì, lo è. Anche se negli anni ’20, Warburg ha scoperto che le cellule tumorali preferiscono produrre ATP tramite glicolisi con produzione di l-lattato, per quanto ne sappiamo, il metabolismo mitocondriale del l-lattato non era stato studiato nelle cellule tumorali fino al 2010, quando è stata pubblicata la prima prova del metabolismo mitocondriale del l-lattato in queste cellule (già riportata nel 2008 da Gabriella Chieppa nella sua tesi di dottorato all’Università del Molise) (18). In questo caso, per studiare il trasporto e il metabolismo dell’l-lattato nei mitocondri isolati da cellule prostatiche sia normali che tumorali, sono state utilizzate tecniche spettroscopiche e polarografiche, in cui sono state monitorate rispettivamente la reazione del m-l-LDH o il consumo di ossigeno da parte dei mitocondri, alimentati con l-lattato aggiunto esternamente (19), piuttosto che utilizzare procedure più complesse, disponibili nei laboratori di biologia molecolare, genetica e chimica. Le prime due tecniche sono state scelte perché permettono il monitoraggio continuo della cinetica dei processi studiati in esperimenti che durano diversi minuti dove i mitocondri rimangono accoppiati. Al contrario, le misurazioni con gli ultimi metodi sono di solito effettuate una volta che i processi sono già stati completati. Di conseguenza, un aumento dello stato redox dei nucleotidi piridinici intramitocondriali, come mostrato dalle misurazioni fluorimetriche, dopo l’aggiunta di l-lattato ai mitocondri indica che il metabolismo del l-lattato avviene all’interno degli organelli attraverso un m-l-LDH dipendente dal NAD+; purtroppo, il verificarsi del metabolismo mitocondriale del l-lattato nelle cellule tumorali non è stato citato in Ferguson et al. (17) forse perché gli autori della revisione considerano le tecniche spettroscopiche e polarografiche “problematiche”, nonostante il loro uso diffuso da numerosi scienziati. Che la loro sia un’opinione minoritaria potrebbe essere esemplificata citando da una recensione di Mayevsky e Rogatsky (20), che afferma che “Il gran numero di pubblicazioni di diversi gruppi testimonia le preziose informazioni raccolte in varie condizioni sperimentali. Il monitoraggio dei livelli di NADH nel tessuto fornisce le informazioni più importanti sullo stato metabolico dei mitocondri”. L’esistenza di m-l-LDH può essere confermata anche immunologicamente in mitocondri che si dimostrano privi di contaminazione citosolica.
Si noti che nel caso in cui si propone che m-l-LDH sia localizzato nello spazio intermembrana, l’aumento della fluorescenza intramitocondriale del nucleotide piridinico si spiega come segue: l-lattato entra nello spazio intermembrana mitocondriale dove viene ossidato a piruvato, che a sua volta attraversa la membrana interna mitocondriale per essere ossidato all’interno dei mitocondri tramite il complesso piruvato deidrogenasi . Tale meccanismo non è supportato da vari risultati sperimentali. Per esempio, in de Bari et al. (18), è stato dimostrato che la riduzione del NAD+ procede nonostante la presenza di arsenito, un inibitore della piruvato deidrogenasi, ma è inibita dall’oxamato, un inibitore della l-LDH. Ulteriori prove contro la presenza di m-l-LDH nello spazio intermembrana emergono dai risultati sperimentali che mostrano che l-lattato entra nei mitocondri in condizioni in cui il piruvato è un composto non penetrante (21) o in cui il simporter piruvato/H+ è bloccato da un inibitore (6). Questi approcci sperimentali possono essere applicati anche alle misurazioni del consumo di ossigeno (in presenza o in assenza di ADP), all’efflusso di protoni e alla generazione di potenziale di membrana in futuro. Applicando il criterio della forza di controllo con vari inibitori non penetranti (19) si può stabilire se il tasso dei processi di cui sopra rispecchia o meno quello del trasporto di l-lattato attraverso la membrana mitocondriale. Così, il trasporto di l-lattato può essere studiato quantitativamente, compreso il verificarsi di cinetiche iperboliche, il profilo del pH, ecc. Inoltre, il confronto tra i profili di inibizione dei processi mitocondriali dipendenti dal piruvato e dal l-lattato attraverso l’uso di composti che non sono in grado di entrare nei mitocondri permette di distinguere tra l-lattato e i trasportatori di piruvato.
In breve, è stato anche dimostrato che il l-lattato aggiunto esternamente può entrare sia nelle cellule prostatiche normali che in quelle cancerose e in particolare, in modo mediato dal trasportatore, entra nei loro mitocondri, dove esiste un l-LDH e si trova nel compartimento interno. È stato dimostrato che gli m-l-LDH differiscono dagli enzimi citosolici che a loro volta differiscono tra loro. Le cellule normali e quelle tumorali mostrano differenze rispetto al livello proteico e all’attività del m-l-LDH, dove sia l’espressione che l’attività dell’enzima sono più elevate nelle cellule tumorali.
Nel 2011, è stata dimostrata l’esistenza di proteine del trasportatore monocarbossilato (MCT) e del LDH nei reticoli mitocondriali delle linee cellulari del cancro al seno (22). In quel caso, è stata misurata l’espressione sia di MCT che di l-LDH, e la loro localizzazione mitocondriale è stata determinata tramite immunofluorescenza, una tecnica che non permette di identificare la localizzazione submitocondriale.
Un’indagine più ampia sul trasporto e il metabolismo di l-lattato nei mitocondri delle cellule tumorali è stata effettuata in cellule di carcinoma epatocellulare umano (Hep G2) (21) in cui avviene la gluconeogenesi (23). I mitocondri delle cellule Hep G2 (Hep G2-M) possiedono un m-l-LDH limitato al compartimento mitocondriale interno. L’l-LDH citosolico e mitocondriale differiscono anche nella loro cinetica di saturazione. È stata anche dimostrata l’esistenza di un trasporto l-lattato mediato dal trasportatore in questi mitocondri. Importante, l’efflusso di vari metaboliti, tra cui piruvato, ossalacetato, malato e citrato, risultante dall’aggiunta di lattato ai mitocondri è stato mostrato per la prima volta, dando così una prima visione del ruolo del metabolismo mitocondriale del lattato; di conseguenza, è stata mostrata anche la presenza di una navetta lattato/piruvato dedicata all’ossidazione del NADH citosolico. Infine, la rimozione del prodotto di ossidazione attraverso il trasporto mediato dal trasportatore e il metabolismo mitocondriale supera qualsiasi difficoltà termodinamica teorica che era considerata per escludere qualsiasi ossidazione del l-lattato nei mitocondri.
Questi risultati suggeriscono fortemente che una revisione della visione dogmatica del metabolismo del glucosio è necessaria con una particolare attenzione al ruolo del l-lattato e del m-l-LDH nella gluconeogenesi. Quindi, il ciclo di Cori (formulato nel 1929 come una via metabolica che richiede energia negli animali, dove gli atomi di carbonio del glucosio passano lungo il percorso circolare: glicogeno muscolare → lattato ematico → fegato (dove avviene la gluconeogenesi) → glucosio ematico → glucosio muscolare → glicogeno muscolare) richiede una revisione, anche. A questo proposito, l’ossidazione cellulare del lattato, necessaria per la produzione di glucosio nel ciclo di Cori, è stata tradizionalmente postulata per avvenire nel citosol, ma è così? Il citosolico-l-LDH (c-l-LDH) è un enzima riducente, il passo finale della via glicolitica, che converte il piruvato in l-lattato, e quindi fornisce la rigenerazione di NAD+. Questa reazione dovrebbe procedere senza sosta, indipendentemente dalla presenza o dall’assenza di ossigeno, poiché la variazione standard di energia libera (ΔG0′) della conversione del piruvato in l-lattato è di circa -6 kcal/mol. Inoltre, l’alta affinità del piruvato al c-l-LDH spiegherebbe il fatto che il normale / rapporto nel sangue e altri tessuti è >10, un valore che non può corrispondere con la proposta del piruvato come prodotto finale della glicolisi in condizioni normali. Pertanto, la rappresentazione dogmatica di questa reazione come bidirezionale è fuorviante ed è stata accettata fino ad oggi a causa dell’assenza di una possibile alternativa. Noi sosteniamo che l’ossidazione del lattato a piruvato non avviene nel citosol, ma piuttosto nei mitocondri. Infatti, ci sono solo due opzioni per prevenire l’accumulo di lattato nel citosol: o il lattato viene trasportato fuori dalla cellula (in condizioni anaerobiche) e/o viene ossidato tramite m-l-LDH al momento del suo trasporto nel mitocondrio (in condizioni aerobiche). Pertanto, anche se siamo d’accordo con Lu et al. (24) che “la maggior parte del piruvato derivato dalla glicolisi viene dirottato verso la fermentazione del lattato”, non possiamo accettare che l-lattato sia “tenuto lontano dal metabolismo ossidativo mitocondriale.”
Di particolare interesse è il fatto che il piruvato non può entrare in Hep G2-M. Infatti, contrariamente a malato + glutammato e l-lattato, il piruvato aggiunto esternamente non riesce a causare né il consumo di ossigeno né la generazione di potenziale di membrana. Si noti che un’alterazione del trasporto del piruvato nelle cellule tumorali è stata riportata da Paradies et al. (25). Quindi, indipendentemente dall’impossibilità teorica dell’ossidazione del lattato nel citosol, come spiegato sopra, il classico ciclo Cori non può avvenire nelle cellule Hep G2. Pertanto, offriamo un ciclo Cori rivisto (Figura 1), che coinvolge sia i trasportatori mitocondriali che mediano il traffico dipendente dal lattato e il m-l-LDH, che fornisce piruvato all’interno dei mitocondri. Di conseguenza, la comparsa all’esterno dei mitocondri di ossalacetato e malato derivati dall’assorbimento e dal metabolismo del lattato tramite m-l-LDH, piruvato deidrogenasi, piruvato carbossilasi e malato deidrogenasi e dagli scambi, probabilmente dovuti agli antiporters l-lattato/ossalacetato e l-lattato/malato, conferma un ruolo anaplerotico del lattato nella gluconeogenesi in cui i mitocondri svolgono un ruolo unico. È importante notare che l’aggiunta di l-lattato a Hep G2-M provoca la comparsa all’esterno dei mitocondri di citrato, il precursore degli acidi grassi. Di conseguenza, utilizzando la spettrometria di massa ad alta risoluzione, l’assorbimento di l-lattato nei mitocondri delle cellule HeLa e H460 è stato trovato e ha dimostrato di provocare la sintesi dei lipidi; inoltre, la microscopia elettronica a trasmissione ha confermato che LDH è localizzato nei mitocondri (26). Sorprendentemente, il ruolo anaplerotico del metabolismo mitocondriale di l-lattato non è stato considerato quando il metabolismo del cancro è stato “riesaminato” (27).
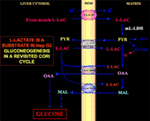
Figura 1. Ciclo di Cori rivisitato in cellule Hep G2. Dato che il piruvato non può entrare in Hep G2-M, come mostrato in Pizzuto et al. (21), l-lattato prodotto nei muscoli raggiunge il fegato attraverso il flusso sanguigno e dal citosol entra nei mitocondri; nella matrice il metabolismo del lattato dà origine al piruvato (PYR) tramite m-L-LDH e poi all’ossalacetato (OAA) e al malato (MAL) che vengono esportati dai mitocondri al citosol tramite tre trasportatori putativi per essere utilizzati per la navetta piruvato-lattato e per la gluconeogenesi tramite un meccanismo simile a quello già mostrato da de Bari et al. (6).
Riteniamo che la proposta di revisione del ciclo di Cori, necessaria per le cellule Hep G2, debba essere considerata anche in tutti gli altri tipi di cellule in cui è attivo il metabolismo mitocondriale del l-lattato. Per esempio, la ricostruzione parziale della gluconeogenesi in vitro derivante dall’uptake/metabolismo mitocondriale del l-lattato è stata dimostrata in assenza di LDH fuori dai mitocondri (6).
Il ruolo del metabolismo mitocondriale del lattato merita ulteriore attenzione: dato che la produzione di perossido di idrogeno nel microambiente tumorale alimenta la crescita anabolica delle cellule tumorali (28), un possibile ruolo della putativa mitocondriale l-lattato ossidasi (LOX) che genera perossido di idrogeno nei mitocondri del fegato di ratto (29) dovrebbe essere studiato; l’esistenza della LOX in Hep G2-M sembra essere coerente con l’evidenza che il rotenone, che blocca il consumo di ossigeno indotto dall’aggiunta di malato + glutammato non riesce a inibire il consumo di ossigeno indotto dall’aggiunta di l-lattato.
Contributi degli autori
SP ha concepito questa opinione, l’ha condivisa e ha scritto l’articolo con AS.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.
Il revisore ha dichiarato un’affiliazione condivisa, senza alcuna collaborazione, con uno degli autori all’editor di trattamento.
1. Dianzani MU. Distribuzione dell’acido lattico ossidasi nelle cellule epatiche e renali di ratti normali e ratti con degenerazione grassa del fegato. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Istochimica della deidrogenasi lattica nel cuore e nei muscoli pettorali del ratto J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitocondri e L-lattato metabolismo. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Allenamento di resistenza, espressione e fisiologia di LDH, MCT1 e MCT4 nel muscolo scheletrico umano. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-lattato trasporto in mitocondri di cuore di ratto e la ricostruzione della navetta L-lattato/piruvato. Biochem J (2002) 15:101-4. doi:10.1042/bj364010101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Ricostruzione parziale della gluconeogenesi in vitro derivante dall’uptake/metabolismo mitocondriale di L-lattato e dall’esportazione di ossalacetato attraverso nuovi translocatori di L-lattato. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lattato: il substrato energetico ossidativo cerebrale finale? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Lattato, non piruvato, è neuronale prodotto finale glicolisi aerobica: uno studio elettrofisiologico in vitro. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Prove per un complesso mitocondriale di ossidazione del lattato nei neuroni di ratto: un componente cruciale per una navetta di lattato del cervello. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Il trasporto e il metabolismo di L-lattato si verificano nei mitocondri delle cellule del granulo cerebellare e sono modificati nelle cellule sottoposte a bassa apoptosi potassio dipendente. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. L’affare mitocondriale L-lattato deidrogenasi. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Nella capacitazione dello sperma di cinghiale L-lattato e succinato, ma non piruvato e citrato, contribuiscono all’aumento del potenziale di membrana mitocondriale come monitorato tramite fluorescenza safranina O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. La presenza di L-lattato deidrogenasi nel compartimento mitocondriale interno del fegato di maiale. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lattato metabolismo nei mitocondri del tubero di patata. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Navette di lattato cellula-cellula e intracellulare. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Glicolisi cerebrale: un secolo di incomprensione persistente e malinteso. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolismo del lattato: contesto storico, interpretazioni errate precedenti e comprensione attuale. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. Il metabolismo di L-lattato può avvenire in cellule prostatiche normali e cancerose attraverso la nuova mitocondriale L-lattato deidrogenasi. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Il ruolo del trasporto mitocondriale nel metabolismo energetico. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Funzione mitocondriale in vivo valutato da fluorescenza NADH: da modelli animali a studi umani. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Il metabolismo del L-lattato nei mitocondri delle cellule HEP G2 dovuto alla L-lattato deidrogenasi determina la comparsa della navetta lattato/piruvato e la comparsa di ossalacetato, malato e citrato fuori dai mitocondri. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitocondriale e membrana plasmatica lattato trasportatore e lattato deidrogenasi isoforma espressione in linee cellulari del cancro al seno. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Istituzione e caratterizzazione di un nuovo metodo per valutare la gluconeogenesi utilizzando linee cellulari epatiche, H4IIE e HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. L’effetto Warburg nella progressione del tumore: metabolismo ossidativo mitocondriale come meccanismo anti-metastasi. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Trasporto di piruvato nei mitocondri di diverse cellule tumorali. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. metabolismo lattato è associato con mitocondri di mammiferi. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Riesaminando il metabolismo del cancro: la produzione di lattato per la carcinogenesi potrebbe essere lo scopo e la spiegazione dell’effetto Warburg. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cellule tumorali metabolicamente “fertilizzare” il microambiente tumorale con perossido di idrogeno, guidando l’effetto Warburg: implicazioni per PET imaging di tumori umani. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lattato genera perossido di idrogeno in mitocondri purificati del fegato di ratto a causa della putativa L-lattato ossidasi localizzata nello spazio intermembrana. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar