L-Laktat ist nicht nur ein Glukosevorläufer in Leber und Niere, sondern wird jetzt auch als Energiesubstrat in den meisten Zellen durch seine Oxidation zu Pyruvat erkannt. Diese Oxidation, von der man annimmt, dass sie im Zytosol stattfindet, wird von der L-Lactat-Dehydrogenase katalysiert, wobei das Pyruvat anschließend in den Mitochondrien abgebaut wird. Vor kurzem wurde jedoch erkannt, dass die Mitochondrien eine Rolle im L-Laktat-Stoffwechsel spielen: Dianzani (1) vermutete die Existenz einer mitochondrialen L-Laktat-Dehydrogenase (m-l-LDH), die später von Baba und Sharma (2) in der mitochondrialen Matrix nachgewiesen wurde (3). Tatsächlich wurden der Transport und der Stoffwechsel von L-Laktat in verschiedenen Mitochondrien nachgewiesen, darunter im Skelettmuskel (4), im Rattenherz (5), in der Leber (6), im Gehirn (7-9), in den Körnerzellen des Kleinhirns (10), im Gastrocnemius von Kaninchen (11), in Spermazellen (12), in der Schweineleber (13) und sogar in Pflanzen (14). So wurde die Existenz von m-l-LDH, wie von Passarella et al. (3), Brooks (15) und Schurr (16) beschrieben, mit der Aufnahme in die MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl) anerkannt. Wie angesichts des Vorhandenseins von l-LDH in der Matrix zu erwarten war, wurde in Funktionsstudien mit gereinigten, gekoppelten Mitochondrien das Auftreten von Trägern für l-Laktat nachgewiesen. Dazu gehören der l-Laktat/H+-Symporter sowie die l-Laktat/Pyruvat- und l-Laktat/Oxaloazetat-Antiporter (3). Überraschenderweise werden die überwältigenden Beweise für einen m-l-LDH im Inneren der Mitochondrien nicht allgemein akzeptiert. Einige Wissenschaftler sind immer noch skeptisch, was die Existenz von m-l-LDH betrifft, während andere m-l-LDH im Intermembranraum lokalisieren (17). Unserer Meinung nach könnte die Skepsis auf Schwierigkeiten bei der Isolierung gekoppelter Mitochondrien zurückzuführen sein, was insbesondere bei Skelettmuskelproben keine einfache Aufgabe ist, oder auf mangelnde Sorgfalt bei der Auswahl der Reaktionsmedien und der Verwendung von Inhibitoren in der richtigen Konzentration (11). Dass m-l-LDH in Mitochondrien lokalisiert ist, wird weiter unten gezeigt.
Wird l-Laktat in den Mitochondrien von Krebszellen transportiert und verstoffwechselt?
Ja, das wird es. Obwohl Warburg in den 1920er Jahren feststellte, dass Krebszellen die ATP-Produktion durch Glykolyse mit L-Laktat-Produktion bevorzugen, war der mitochondriale Metabolismus von L-Laktat unseres Wissens nach in Krebszellen nicht untersucht worden, bis 2010 der erste Nachweis für den mitochondrialen L-Laktat-Stoffwechsel in diesen Zellen (bereits 2008 von Gabriella Chieppa in ihrer Doktorarbeit an der Universität Molise berichtet) veröffentlicht wurde (18). In diesem Fall wurden zur Untersuchung des L-Aktat-Transports und -Stoffwechsels in Mitochondrien, die sowohl aus normalen als auch aus Krebs-Prostatazellen isoliert wurden, spektroskopische und polarographische Techniken verwendet, bei denen entweder die m-l-LDH-Reaktion oder der Sauerstoffverbrauch von Mitochondrien, die mit extern zugegebenem L-Aktat versorgt wurden, überwacht wurden (19), anstatt aufwändigere Verfahren anzuwenden, die in Molekularbiologie-, Genetik- und Chemielabors verfügbar sind. Die beiden erstgenannten Techniken wurden gewählt, da sie die kontinuierliche Überwachung der Kinetik der untersuchten Prozesse in Experimenten ermöglichen, die mehrere Minuten dauern und bei denen die Mitochondrien gekoppelt bleiben. Im Gegensatz dazu werden die Messungen mit den letzteren Methoden in der Regel durchgeführt, wenn die Prozesse bereits abgeschlossen sind. Dementsprechend deutet ein durch fluorimetrische Messungen nachgewiesener Anstieg des Redoxzustands der intramitochondrialen Pyridinnukleotide bei Zugabe von l-Laktat in die Mitochondrien darauf hin, dass der l-Laktat-Stoffwechsel innerhalb der Organellen über eine NAD+-abhängige m-l-LDH erfolgt; leider wurde das Vorkommen des mitochondrialen l-Laktat-Stoffwechsels in Krebszellen in Ferguson et al. (17) nicht zitiert, möglicherweise weil die Autoren der Übersichtsarbeit die spektroskopischen und polarographischen Techniken für „problematisch“ halten, obwohl sie von zahlreichen Wissenschaftlern verwendet werden. Dass es sich dabei um eine Minderheitenmeinung handelt, könnte durch ein Zitat aus einer Übersichtsarbeit von Mayevsky und Rogatsky (20) verdeutlicht werden, in der es heißt: „Die große Anzahl von Veröffentlichungen verschiedener Gruppen zeugt von den wertvollen Informationen, die unter verschiedenen Versuchsbedingungen gesammelt wurden. Die Überwachung des NADH-Gehalts im Gewebe liefert die wichtigsten Informationen über den Stoffwechselzustand der Mitochondrien“. Die Existenz von m-l-LDH kann auch immunologisch in Mitochondrien bestätigt werden, die nachweislich frei von zytosolischer Kontamination sind.
Wenn m-l-LDH im Intermembranraum lokalisiert sein soll, wird der Anstieg der intramitochondrialen Pyridinnukleotid-Fluoreszenz wie folgt erklärt: l-Lactat gelangt in den mitochondrialen Intermembranraum, wo es zu Pyruvat oxidiert wird, das wiederum die mitochondriale Innenmembran durchquert, um innerhalb der Mitochondrien über den Pyruvat-Dehydrogenase-Komplex oxidiert zu werden. Ein solcher Mechanismus wird durch verschiedene experimentelle Befunde nicht gestützt. So wurde beispielsweise von de Bari et al. (18) gezeigt, dass die NAD+-Reduktion trotz der Anwesenheit von Arsenit, einem Inhibitor der Pyruvatdehydrogenase, abläuft, aber durch Oxamat, einen Inhibitor der l-LDH, gehemmt wird. Zusätzliche Beweise gegen das Vorhandensein von m-l-LDH im Intermembranraum ergeben sich aus experimentellen Ergebnissen, die zeigen, dass l-Laktat in die Mitochondrien gelangt, wenn Pyruvat eine nichtpenetrierende Verbindung ist (21) oder wenn der Pyruvat/H+-Symporter durch einen Inhibitor blockiert ist (6). Diese experimentellen Ansätze können in Zukunft auch auf Messungen des Sauerstoffverbrauchs (in Anwesenheit oder Abwesenheit von ADP), des Protonenausflusses und der Erzeugung des Membranpotenzials angewendet werden. Durch Anwendung des Kriteriums der Kontrollstärke mit verschiedenen nicht penetrierenden Inhibitoren (19) kann festgestellt werden, ob die Geschwindigkeit der oben genannten Prozesse die des l-Laktat-Transports durch die Mitochondrienmembran widerspiegelt oder nicht. Auf diese Weise kann der l-Laktat-Transport quantitativ untersucht werden, einschließlich des Auftretens einer hyperbolischen Kinetik, des pH-Profils, usw. Darüber hinaus ermöglicht der Vergleich zwischen den Hemmungsprofilen von Pyruvat- und L-Laktat-abhängigen mitochondrialen Prozessen durch die Verwendung von Verbindungen, die nicht in die Mitochondrien eindringen können, eine Unterscheidung zwischen L-Laktat- und Pyruvat-Trägern.
Kurz gesagt wurde auch gezeigt, dass von außen zugeführtes L-Laktat sowohl in normale als auch in Krebs-Prostatazellen eindringen kann und insbesondere auf trägervermittelte Weise in ihre Mitochondrien eindringt, wo eine l-LDH existiert und sich im inneren Kompartiment befindet. Die m-l-LDHs unterscheiden sich nachweislich von den zytosolischen Enzymen, die sich ihrerseits voneinander unterscheiden. Normale und Krebszellen weisen Unterschiede in Bezug auf den m-l-LDH-Proteingehalt und die Aktivität auf, wobei sowohl die Enzymexpression als auch die Aktivität in Krebszellen höher sind.
Im Jahr 2011 wurde die Existenz von Monocarboxylat-Transporter- (MCT) und LDH-Proteinen in mitochondrialen Retikeln von Brustkrebszelllinien nachgewiesen (22). In diesem Fall wurde die Expression sowohl von MCTs als auch von l-LDH gemessen, und ihre mitochondriale Lokalisierung wurde mittels Immunfluoreszenz bestimmt, einer Technik, die keine Identifizierung der submitochondrialen Lokalisierung ermöglicht.
Eine umfassendere Untersuchung des l-Laktat-Transports und -Stoffwechsels in den Mitochondrien von Krebszellen wurde in menschlichen Leberzellkarzinom-(Hep G2)-Zellen (21) durchgeführt, in denen die Gluconeogenese stattfindet (23). Die Mitochondrien der Hep G2-Zellen (Hep G2-M) besitzen eine m-l-LDH, die auf das innere Mitochondrienkompartiment beschränkt ist. Es wurde auch festgestellt, dass sich zytosolische und mitochondriale l-LDHs in ihrer Sättigungskinetik unterscheiden. Das Auftreten eines Carrier-vermittelten L-Laktat-Transports in diesen Mitochondrien wurde ebenfalls nachgewiesen. Wichtig ist, dass der Ausfluss verschiedener Metaboliten, einschließlich Pyruvat, Oxalacetat, Malat und Citrat, der aus der L-Laktat-Zufuhr in die Mitochondrien resultiert, erstmals gezeigt wurde, was einen ersten Einblick in die Rolle des mitochondrialen L-Laktat-Stoffwechsels gibt; dementsprechend wurde auch das Auftreten eines L-Laktat/Pyruvat-Shuttles gezeigt, das der Oxidation des zytosolischen NADH dient. Letztendlich überwindet die Entfernung des Oxidationsprodukts durch Carrier-vermittelten Transport und mitochondrialen Stoffwechsel alle theoretischen thermodynamischen Schwierigkeiten, die eine L-Lactat-Oxidation in den Mitochondrien ausschließen sollten.
Diese Ergebnisse legen nahe, dass eine Revision der dogmatischen Sichtweise des Glucosestoffwechsels erforderlich ist, wobei die Rolle von L-Lactat und m-l-LDH bei der Gluconeogenese besonders berücksichtigt werden sollte. Daher muss auch der Cori-Zyklus (der 1929 als energieaufwändiger Stoffwechselweg bei Tieren formuliert wurde, bei dem die Kohlenstoffatome der Glukose den Kreislauf durchlaufen: Muskelglykogen → Blutlaktat → Leber (wo die Glukoneogenese stattfindet) → Blutglukose → Muskelglukose → Muskelglykogen) überarbeitet werden. Die zelluläre L-Laktat-Oxidation, die für die Herstellung von Glukose im Cori-Zyklus erforderlich ist, wird traditionell als im Zytosol stattfindend postuliert, aber ist sie das auch? Die zytosolische L-DH (c-LDH) ist ein reduzierendes Enzym, das im letzten Schritt des glykolytischen Weges Pyruvat in L-Laktat umwandelt und so für die Regeneration von NAD+ sorgt. Diese Reaktion sollte unabhängig von der An- oder Abwesenheit von Sauerstoff ungehindert ablaufen, da die Standardänderung der freien Energie (ΔG0′) bei der Umwandlung von Pyruvat in l-Lactat etwa -6 kcal/mol beträgt. Darüber hinaus würde die hohe Affinität von Pyruvat zu c-l-LDH die Tatsache erklären, dass das normale /-Verhältnis in Blut und anderen Geweben >10 ist, ein Wert, der nicht mit dem Vorschlag von Pyruvat als Endprodukt der Glykolyse unter normalen Bedingungen übereinstimmen kann. Daher ist die dogmatische Darstellung dieser Reaktion als bidirektional irreführend und wurde bisher akzeptiert, da es keine mögliche Alternative gibt. Wir behaupten, dass die Oxidation von L-Laktat zurück zu Pyruvat nicht im Zytosol, sondern in den Mitochondrien stattfindet. In der Tat gibt es nur zwei Möglichkeiten, eine Anhäufung von L-Laktat im Zytosol zu verhindern: entweder wird L-Laktat aus der Zelle transportiert (unter anaeroben Bedingungen) und/oder es wird durch m-l-LDH beim Transport in das Mitochondrium oxidiert (unter aeroben Bedingungen). Selbst wenn wir Lu et al. (24) zustimmen, dass „der Großteil des aus der Glykolyse stammenden Pyruvats in die Laktatfermentation umgeleitet wird“, können wir daher nicht akzeptieren, dass L-Laktat „vom mitochondrialen oxidativen Stoffwechsel ferngehalten wird“
Besonders interessant ist die Tatsache, dass Pyruvat nicht in Hep G2-M gelangen kann. Im Gegensatz zu Malat + Glutamat und L-Laktat bewirkt extern zugeführtes Pyruvat weder einen Sauerstoffverbrauch noch die Erzeugung eines Membranpotentials. Eine Beeinträchtigung des Pyruvat-Transports in Krebszellen wurde bereits von Paradies et al. (25) beschrieben. Unabhängig von der theoretischen Unmöglichkeit der L-Lactat-Oxidation im Zytosol kann der klassische Cori-Zyklus in Hep-G2-Zellen nicht ablaufen, wie oben erläutert wurde. Daher bieten wir einen überarbeiteten Cori-Zyklus an (Abbildung 1), an dem sowohl die mitochondrialen Carrier, die den l-Laktat-abhängigen Verkehr vermitteln, als auch die m-l-LDH, die Pyruvat innerhalb der Mitochondrien bereitstellt, beteiligt sind. Dementsprechend bestätigt das Auftreten von Oxalacetat und Malat außerhalb der Mitochondrien, die aus der L-Lactat-Aufnahme und dem Metabolismus über m-l-LDH, Pyruvat-Dehydrogenase, Pyruvat-Carboxylase und Malat-Dehydrogenase sowie durch Austauschvorgänge stammen, die wahrscheinlich auf die L-Lactat/Oxalacetat- und L-Lactat/Malat-Antiporter zurückzuführen sind, eine anaplerotische Rolle für L-Lactat in der Gluconeogenese, bei der die Mitochondrien eine einzigartige Rolle spielen. Wichtig ist, dass die Zugabe von L-Laktat zu Hep G2-M zum Auftreten von Citrat, dem Fettsäurevorläufer, außerhalb der Mitochondrien führt. Dementsprechend wurde mit Hilfe der hochauflösenden Massenspektrometrie die Aufnahme von L-Laktat in die Mitochondrien von HeLa- und H460-Zellen festgestellt und nachgewiesen, dass sie zur Lipidsynthese führt; außerdem bestätigte die Transmissionselektronenmikroskopie, dass LDH in den Mitochondrien lokalisiert ist (26). Überraschenderweise wurde die anaplerotische Rolle des mitochondrialen L-Laktat-Stoffwechsels nicht berücksichtigt, als der Krebsstoffwechsel „neu untersucht“ wurde (27).
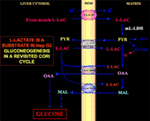
Abbildung 1. Der Cori-Zyklus in Hep-G2-Zellen wird erneut untersucht. In Anbetracht der Tatsache, dass Pyruvat nicht in Hep G2-M eindringen kann, wie in Pizzuto et al. (21) gezeigt haben, gelangt das in den Muskeln produzierte l-Laktat über den Blutkreislauf in die Leber und vom Zytosol in die Mitochondrien; In der Matrix führt der L-Laktat-Stoffwechsel über m-L-LDH zu Pyruvat (PYR) und anschließend zu Oxalacetat (OAA) und Malat (MAL), die über drei mutmaßliche Carrier aus den Mitochondrien in das Zytosol exportiert werden, um für den L-Laktat-Pyruvat-Shuttle und die Gluconeogenese verwendet zu werden, und zwar über einen Mechanismus, der dem bereits von de Bari et al. (6).
Wir sind der Meinung, dass die vorgeschlagene Überarbeitung des Cori-Zyklus, die für Hep G2-Zellen notwendig ist, auch für alle anderen Zelltypen in Betracht gezogen werden sollte, in denen der mitochondriale Metabolismus von L-Laktat aktiv ist. So wurde beispielsweise eine teilweise Rekonstruktion der in vitro-Gluconeogenese, die aus der mitochondrialen L-Lactat-Aufnahme/dem mitochondrialen L-Lactat-Stoffwechsel resultiert, in Abwesenheit von LDH außerhalb der Mitochondrien gezeigt (6).
Die Rolle des mitochondrialen L-Laktat-Stoffwechsels verdient weitere Aufmerksamkeit: In Anbetracht der Tatsache, dass die Wasserstoffperoxidproduktion in der Tumormikroumgebung das anabole Wachstum von Krebszellen antreibt (28), sollte eine mögliche Rolle der mutmaßlichen mitochondrialen L-Laktat-Oxidase (LOX) untersucht werden, die Wasserstoffperoxid in den Mitochondrien der Rattenleber erzeugt (29); das Vorhandensein von LOX in Hep G2-M scheint mit dem Nachweis übereinzustimmen, dass Rotenon, das den durch die Zugabe von Malat + Glutamat induzierten Sauerstoffverbrauch blockiert, den durch die Zugabe von L-Laktat induzierten Sauerstoffverbrauch nicht hemmt.
Beiträge der Autoren
SP konzipierte diese Stellungnahme, teilte sie mit AS und schrieb die Arbeit.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der Gutachter erklärte gegenüber dem behandelnden Herausgeber, dass er mit einem der Autoren in einer gemeinsamen Beziehung steht, ohne dass eine Zusammenarbeit besteht.
1. Dianzani MU. Verteilung der Milchsäureoxidase in Leber- und Nierenzellen von normalen Ratten und Ratten mit Leberverfettung. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Ausdauertraining, Expression und Physiologie von LDH, MCT1 und MCT4 im menschlichen Skelettmuskel. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-Laktat-Transport in Rattenherz-Mitochondrien und Rekonstruktion des L-Laktat/Pyruvat-Shuttles. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Partielle Rekonstruktion der in vitro-Gluconeogenese durch mitochondriale L-Lactat-Aufnahme/Metabolismus und Oxalacetat-Export über neuartige L-Lactat-Translokatoren. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Laktat, nicht Pyruvat, ist das Endprodukt der neuronalen aeroben Glykolyse: eine elektrophysiologische in vitro Studie. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Evidence for a mitochondrial lactate oxidation complex in rat neurons: a crucial component for a brain lactate shuttle. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport und Metabolismus von L-Laktat finden in Mitochondrien von Kleinhirn-Körnerzellen statt und werden in Zellen verändert, die eine kaliumabhängige Apoptose durchlaufen. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. The mitochondrial L-lactate dehydrogenase affair. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. In Ebersperma capacitation L-lactate and succinate, but not pyruvate and citrate, contribute to the mitochondrial membrane potential increase as monitored via safranine O fluorescence. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lactate metabolism in potato tuber mitochondria. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Cell-cell and intracellular lactate shuttles. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Cerebral glycolysis: a century of persistent misunderstanding and misconception. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Laktatstoffwechsel: historischer Kontext, frühere Fehlinterpretationen und aktuelles Verständnis. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-lactate metabolism can occur in normal and cancer prostate cells via the novel mitochondrial L-lactate dehydrogenase. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. The role of mitochondrial transport in energy metabolism. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitochondriale Funktion in vivo bewertet durch NADH-Fluoreszenz: von Tiermodellen zu Studien am Menschen. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Der L-Laktat-Stoffwechsel in den Mitochondrien der HEP G2-Zellen durch die L-Laktat-Dehydrogenase bestimmt das Auftreten des Laktat/Pyruvat-Shuttles und das Auftreten von Oxalacetat, Malat und Citrat außerhalb der Mitochondrien. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitochondrial and plasma membrane lactate transporter and lactate dehydrogenase isoform expression in breast cancer cell lines. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Establishment and characterization of a novel method for evaluating gluconeogenesis using hepatic cell lines, H4IIE and HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. The Warburg effect in tumor progression: mitochondrial oxidative metabolism as an anti-metastasis mechanism. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport von Pyruvat in Mitochondrien von verschiedenen Tumorzellen. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Lactate metabolism is associated with mammalian mitochondria. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexamining cancer metabolism: lactate production for carcinogenesis could be the purpose and explanation of the Warburg effect. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically „fertilize“ the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactate generates hydrogen peroxide in purified rat liver mitochondria due to the putative L-lactate oxidase localized in the intermembrane space. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar