Naast een glucose precursor in lever en nieren, wordt l-lactaat nu ook erkend als een energie substraat in de meeste cellen via zijn oxidatie tot pyruvaat. Deze oxidatie, waarvan wordt aangenomen dat zij in het cytosol plaatsvindt, wordt gekatalyseerd door l-lactaatdehydrogenase en het pyruvaat wordt vervolgens in de mitochondriën gekataboliseerd. Onlangs werd echter erkend dat mitochondriën een rol spelen in het l-lactaatmetabolisme: het bestaan van een mitochondriaal l-lactaatdehydrogenase (m-l-LDH) werd gesuggereerd door Dianzani (1), en later aangetoond door Baba en Sharma (2) dat het zich in de mitochondriale matrix bevindt (3). Inderdaad, l-lactaat transport en metabolisme werd aangetoond in verschillende mitochondriën, waaronder skeletspier (4), rattenhart (5), lever (6), hersenen (7-9), cerebellaire granule cellen (10), konijn gastrocnemius (11), spermacellen (12), varkenslever (13), en zelfs plantaardig (14). Aldus werd het bestaan van m-l-LDH, zoals besproken door Passarella et al. (3), Brooks (15), en Schurr (16), erkend met de opname ervan in de MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Zoals verwacht, in het licht van de aanwezigheid van de l-LDH in de matrix, is het voorkomen van dragers voor l-lactaat aangetoond in functionele studies met gezuiverde, gekoppelde mitochondriën. Hiertoe behoren de l-lactaat/H+ symporter en de l-lactaat/pyruvaat en l-lactaat/oxaloacetaat antiporters (3). Verrassend genoeg wordt het overweldigende bewijs voor een m-l-LDH in de mitochondriën niet door iedereen aanvaard: sommige wetenschappers staan nog steeds sceptisch tegenover het bestaan van m-l-LDH, terwijl anderen m-l-LDH in de intermembraanruimte lokaliseren (17). Wij zijn van mening dat de scepsis te wijten zou kunnen zijn aan moeilijkheden bij het isoleren van gekoppelde mitochondriën – geen gemakkelijke taak, met name bij monsters van skeletspieren – of aan het feit dat men niet zorgvuldig genoeg is geweest bij het selecteren van reactiemedia en bij het gebruik van remmers in de juiste concentratie (11). Dat m-l-LDH in de mitochondriën gelokaliseerd is, zal hieronder worden aangetoond.
Wordt l-Lactaat getransporteerd en gemetaboliseerd in de Mitochondriën van kankercellen?
Ja, dat is zo. Hoewel Warburg in de jaren 1920 ontdekte dat kankercellen bij voorkeur ATP produceren door glycolyse met l-lactaatproductie, was het mitochondriale metabolisme van l-lactaat voor zover wij weten niet onderzocht in kankercellen tot 2010, toen het eerste bewijs voor l-lactaat mitochondriaal metabolisme in deze cellen (al in 2008 gerapporteerd door Gabriella Chieppa in haar proefschrift aan de Universiteit van Molise) werd gepubliceerd (18). In dit geval, om het l-lactaat transport en metabolisme in mitochondriën geïsoleerd uit zowel normale als kanker prostaatcellen te bestuderen, werden spectroscopische en polarografische technieken gebruikt, waarin ofwel de m-l-LDH reactie of het zuurstofverbruik door mitochondriën, voorzien van extern toegevoegd l-lactaat werden gecontroleerd, respectievelijk (19), in plaats van gebruik te maken van meer ingewikkelde procedures, beschikbaar in moleculaire biologie, genetica, en chemie laboratoria. De eerste twee technieken werden gekozen omdat zij de continue monitoring van de kinetiek van de onderzochte processen mogelijk maken in experimenten die verscheidene minuten duren waarbij de mitochondriën gekoppeld blijven. Metingen met behulp van de laatste methoden daarentegen worden gewoonlijk verricht wanneer de processen reeds zijn voltooid. Zo wijst een toename van de redoxtoestand van de intramitochondriale pyridinenucleotiden, zoals aangetoond door fluorimetrische metingen, na de toevoeging van l-lactaat aan mitochondriën erop dat het l-lactaatmetabolisme binnen de organellen plaatsvindt via een NAD+-afhankelijk m-l-LDH; helaas werd het voorkomen van het mitochondriale l-lactaatmetabolisme in kankercellen niet vermeld in Ferguson et al. (17) mogelijk omdat de auteurs van het overzicht de spectroscopische en polarografische technieken als “problematisch” beschouwen, ondanks het wijdverbreide gebruik ervan door talrijke wetenschappers. Dat dit een minderheidsstandpunt is, kan worden geïllustreerd door een citaat uit een overzicht van Mayevsky en Rogatsky (20), waarin staat dat “het grote aantal publicaties van verschillende groepen getuigt van de waardevolle informatie die in verschillende experimentele omstandigheden is verzameld. De controle van het NADH-gehalte in het weefsel verschaft de belangrijkste informatie over de metabolische toestand van de mitochondriën.” Het bestaan van m-l-LDH kan ook immunologisch worden bevestigd in mitochondriën waarvan is aangetoond dat ze vrij zijn van cytosolische verontreiniging.
Merk op dat in het geval waar m-l-LDH wordt voorgesteld gelokaliseerd te zijn in de intermembraan ruimte, de toename in de intramitochondriale pyridine nucleotide fluorescentie als volgt wordt verklaard: l-lactaat komt de mitochondriale intermembraan ruimte binnen waar het wordt geoxideerd tot pyruvaat, dat op zijn beurt de mitochondriale binnenmembraan doorkruist om binnen de mitochondriën te worden geoxideerd via het pyruvaat dehydrogenase complex . Een dergelijk mechanisme wordt niet ondersteund door diverse experimentele bevindingen. Zo werd in de Bari et al. (18) aangetoond dat de reductie van NAD+ doorgaat ondanks de aanwezigheid van arseniet, een remmer van pyruvaatdehydrogenase, maar wordt geremd door oxamaat, een remmer van l-LDH. Aanvullend bewijs tegen de aanwezigheid van m-l-LDH in de intermembraanruimte komt naar voren uit experimentele resultaten die aantonen dat l-lactaat de mitochondria binnenkomt onder omstandigheden waarin pyruvaat een niet-penetrante verbinding is (21) of waarin de pyruvaat/H+ symporter wordt geblokkeerd door een remmer (6). Deze experimentele benaderingen kunnen in de toekomst ook worden toegepast op metingen van zuurstofverbruik (in aanwezigheid of afwezigheid van ADP), proton efflux en membraanpotentiaal generatie. Door toepassing van het controlesterktecriterium met verschillende niet-penetrerende remmers (19) kan worden vastgesteld of de snelheid van de bovengenoemde processen al dan niet die van het l-lactaattransport over het mitochondriale membraan weerspiegelt. Aldus kan het l-lactaattransport kwantitatief worden onderzocht, met inbegrip van het optreden van hyperboolkinetiek, pH-profiel, enz. Bovendien kan door vergelijking van de remmingsprofielen van pyruvaat- en l-lactaat-afhankelijke mitochondriale processen met behulp van verbindingen die de mitochondriën niet kunnen binnendringen, een onderscheid worden gemaakt tussen l-lactaat- en pyruvaat-dragers.
Nu is ook aangetoond dat uitwendig toegevoegd l-lactaat zowel normale als kankerprostaatcellen kan binnendringen en met name, op een carrier-gemedieerde wijze, hun mitochondriën binnendringt, waar een l-LDH bestaat en zich in het binnenste compartiment bevindt. Aangetoond is dat de m-l-LDH’s verschillen van de cytosolische enzymen, die zelf weer van elkaar verschillen. Normale en kankercellen vertonen verschillen met betrekking tot het m-l-LDH eiwitgehalte en de activiteit, waarbij zowel de expressie als de activiteit van het enzym hoger zijn in kankercellen.
In 2011 werd het bestaan van monocarboxylaat transporter (MCT) en LDH eiwitten in mitochondriale reticula van borstkanker cellijnen aangetoond (22). In dat geval werd de expressie van zowel MCT’s als l-LDH gemeten, en hun mitochondriale lokalisatie werd bepaald via immunofluorescentie, een techniek waarmee de submitochondriale lokalisatie niet kan worden vastgesteld.
Een breder onderzoek naar l-lactaattransport en metabolisme in kankercelmitochondriën werd uitgevoerd in menselijke hepatocellulair carcinoom (Hep G2) cellen (21) waarin gluconeogenese plaatsvindt (23). Hep G2 cel mitochondriën (Hep G2-M) bezitten een m-l-LDH beperkt tot het binnenste mitochondriale compartiment. Cytosolische en mitochondriale l-LDH’s bleken ook van elkaar te verschillen in hun verzadigingskinetiek. Het optreden van een carrier-gemedieerd l-lactaat transport in deze mitochondriën werd eveneens aangetoond. Belangrijk is dat de efflux van verschillende metabolieten, waaronder pyruvaat, oxaloacetaat, malaat en citraat, als gevolg van l-lactaat toevoeging aan mitochondriën voor het eerst werd aangetoond, dit geeft een eerste inzicht in de rol van het mitochondriale metabolisme van l-lactaat; dienovereenkomstig werd het optreden van een l-lactaat/pyruvaat shuttle gewijd aan de oxidatie van het cytosolische NADH ook aangetoond. Uiteindelijk overwint de verwijdering van het oxidatieproduct door carrier-gemedieerd transport en mitochondriaal metabolisme elke theoretische thermodynamische moeilijkheid die werd geacht elke oxidatie van l-lactaat in de mitochondriën uit te sluiten.
Deze bevindingen suggereren sterk dat een herziening van de dogmatische visie op glucose metabolisme nodig is met speciale aandacht voor de rol van l-lactaat en m-l-LDH in gluconeogenese. De Cori-cyclus (in 1929 geformuleerd als een energieleverende metabolische route bij dieren, waarbij koolstofatomen van glucose de cirkelvormige route afleggen: spierglycogeen → bloedlactaat → lever (waar gluconeogenese plaatsvindt) → bloedglucose → spierglucose → spierglycogeen) moet dus ook worden herzien. In dit verband wordt traditioneel aangenomen dat de cellulaire l-lactaatoxidatie, die noodzakelijk is voor de productie van glucose in de Cori-cyclus, in het cytosol plaatsvindt, maar is dat wel zo? Het cytosolisch-l-LDH (c-l-LDH) is een reducerend enzym, de laatste stap van de glycolytische route, dat pyruvaat omzet in l-lactaat, en zo zorgt voor de regeneratie van NAD+. Deze reactie zou onverminderd moeten doorgaan, onafhankelijk van de aan- of afwezigheid van zuurstof, aangezien de standaard vrije-energie (ΔG0′) verandering van de omzetting van pyruvaat in l-lactaat ongeveer -6 kcal/mol bedraagt. Bovendien zou de hoge affiniteit van pyruvaat voor c-l-LDH het feit verklaren dat de normale / ratio in bloed en andere weefsels >10 is, een waarde die niet kan corresponderen met het voorstel van pyruvaat als het eindproduct van glycolyse onder normale omstandigheden. Daarom is de dogmatische voorstelling van deze reactie als bidirectioneel misleidend en tot op heden aanvaard wegens het ontbreken van een mogelijk alternatief. Wij beweren dat de oxidatie van l-lactaat tot pyruvaat niet plaatsvindt in het cytosol, maar in de mitochondriën. Er zijn namelijk maar twee mogelijkheden om te voorkomen dat l-lactaat zich ophoopt in het cytosol: ofwel wordt l-lactaat uit de cel getransporteerd (onder anaërobe omstandigheden) en/of wordt het geoxideerd via m-l-LDH bij het transport naar de mitochondriën (onder aërobe omstandigheden). Daarom, zelfs als we het eens zijn met Lu et al. (24) dat “het merendeel van glycolyse-afgeleid pyruvaat wordt omgeleid naar lactaat fermentatie,” kunnen we niet accepteren dat l-lactaat “weg wordt gehouden van mitochondriaal oxidatief metabolisme.”
Van bijzonder belang is het feit dat pyruvaat niet in Hep G2-M kan komen. In feite, in tegenstelling tot malaat + glutamaat en l-lactaat, veroorzaakt extern toegevoegd pyruvaat noch zuurstofverbruik noch membraanpotentiaalvorming. Merk op dat een verzwakking van pyruvaat transport in kankercellen is gerapporteerd door Paradies et al. (25). Daarom, onafhankelijk van de theoretische onhaalbaarheid van l-lactaat oxidatie in het cytosol, zoals hierboven werd uitgelegd, kan de klassieke Cori cyclus niet voorkomen in Hep G2 cellen. Daarom bieden wij een herziene Cori-cyclus (figuur 1), die zowel de mitochondriale dragers die bemiddelen de l-lactaat-afhankelijke verkeer en de m-l-LDH, die pyruvaat levert binnen mitochondriën omvat. Het verschijnen buiten de mitochondriën van oxaalacetaat en malaat afkomstig van de opname en metabolisatie van l-lactaat via m-l-LDH, pyruvaatdehydrogenase, pyruvaatcarboxylase en malaatdehydrogenase en door uitwisseling, waarschijnlijk door de l-lactaat/oxaalacetaat en l-lactaat/malaat antiporters, bevestigt de anaplerotische rol van l-lactaat in de gluconeogenese waarin mitochondriën een unieke rol spelen. Belangrijk is dat de toevoeging van l-lactaat aan Hep G2-M resulteert in het verschijnen buiten de mitochondriën van citraat, de vetzuurprecursor. Dienovereenkomstig, met behulp van hoge-resolutie massaspectrometrie, l-lactaat opname in mitochondriën van HeLa en H460 cellen werd gevonden en bewezen te resulteren in lipide synthese; bovendien transmissie elektronenmicroscopie bevestigd dat LDH is gelokaliseerd in de mitochondriën (26). Verrassend genoeg is de anaplerotische rol van het mitochondriaal metabolisme van l-lactaat niet in aanmerking genomen toen het metabolisme van kanker werd “heronderzocht” (27).
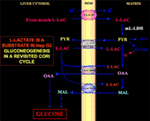
Figuur 1. Cori-cyclus opnieuw bekeken in Hep G2-cellen. Aangezien pyruvaat niet in Hep G2-M kan binnendringen, zoals aangetoond in Pizzuto et al. (21), bereikt het in de spieren geproduceerde l-lactaat de lever via de bloedstroom en komt het vanuit het cytosol in de mitochondriën terecht; in de matrix leidt het l-lactaatmetabolisme tot pyruvaat (PYR) via m-L-LDH en vervolgens tot oxaalacetaat (OAA) en malaat (MAL), die via drie vermoedelijke dragers uit de mitochondriën naar het cytosol worden geëxporteerd om te worden gebruikt voor de l-lactaat-pyruvaatshuttle en voor de gluconeogenese die plaatsvindt via een mechanisme dat vergelijkbaar is met dat wat reeds is aangetoond door de Bari et al. (6).
Wij zijn van mening dat de voorgestelde herziening van de Cori-cyclus, noodzakelijk voor Hep G2-cellen, ook moet worden overwogen in alle andere celtypen waar het mitochondriale metabolisme van l-lactaat actief is. Zo werd bijvoorbeeld een gedeeltelijke reconstructie van in vitro gluconeogenese als gevolg van mitochondriale l-lactaatopname/metabolisme aangetoond in afwezigheid van LDH buiten de mitochondriën (6).
De rol van het mitochondriale l-lactaatmetabolisme verdient nadere aandacht: gezien het feit dat de productie van waterstofperoxide in de tumormicro-omgeving de anabole groei van kankercellen aanwakkert (28), moet een mogelijke rol van het vermeende mitochondriale l-lactaatoxidase (LOX), dat waterstofperoxide genereert in rattenlever mitochondriën (29) worden onderzocht; het bestaan van LOX in Hep G2-M lijkt in overeenstemming te zijn met het bewijs dat rotenon, dat het zuurstofverbruik geïnduceerd door de toevoeging van malaat + glutamaat blokkeert, er niet in slaagt het zuurstofverbruik geïnduceerd door de toevoeging van l-lactaat te remmen.
Bijdragen van auteurs
SP bedacht dit advies, deelde het en schreef het artikel met AS.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
De recensent verklaarde een gedeelde affiliatie, zonder samenwerking, met een van de auteurs aan de behandelende redacteur.
1. Dianzani MU. Distribution of lactic acid oxidase in liver and kidney cells of normal rats and rats with fatty degeneration of the liver. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Duurtraining, expressie en fysiologie van LDH, MCT1, en MCT4 in menselijke skeletspieren. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-lactaat transport in rattenhart mitochondriën en reconstructie van de L-lactaat/pyruvate shuttle. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Partial reconstruction of in vitro gluconeogenesis arising from mitochondrial L-lactate uptake/metabolism and oxaloacetate export via novel L-lactate translocators. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Lactate, not pyruvate, is neuronal aerobic glycolysis end product: an in vitro electrophysiological study. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Evidence for a mitochondrial lactate oxidation complex in rat neurons: a crucial component for a brain lactate shuttle. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport en metabolisme van L-lactaat komen voor in mitochondria van cerebellaire granule cellen en worden gewijzigd in cellen die lage kalium afhankelijke apoptose ondergaan. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. De mitochondriale L-lactaat dehydrogenase affaire. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. In beren sperma capacitatie L-lactaat en succinaat, maar niet pyruvaat en citraat, dragen bij aan de mitochondriale membraanpotentiaal toename zoals gemonitord via safranine O fluorescentie. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lactaat metabolisme in aardappelknol mitochondriën. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Cell-cell and intracellular lactate shuttles. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Cerebrale glycolyse: een eeuw van hardnekkige misverstanden en misvattingen. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Lactaatmetabolisme: historische context, eerdere misinterpretaties, en huidig begrip. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-lactaatmetabolisme kan optreden in normale en kanker prostaatcellen via het nieuwe mitochondriale L-lactaatdehydrogenase. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. De rol van mitochondriaal transport in het energiemetabolisme. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitochondrial function in vivo evaluated by NADH fluorescence: from animal models to human studies. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-lactaat metabolisme in HEP G2 cel mitochondriën als gevolg van de L-lactaat dehydrogenase bepaalt het optreden van de lactaat/pyruvaat shuttle en de verschijning van oxaloacetaat, malaat en citraat buiten mitochondriën. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitochondriale en plasmamembraan lactaattransporter en lactaatdehydrogenase isovorm expressie in borstkanker cellijnen. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Establishment and characterization of a novel method for evaluating gluconeogenesis using hepatic cell lines, H4IIE and HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. Het Warburg-effect in tumorprogressie: mitochondriaal oxidatief metabolisme als anti-metastasemechanisme. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport van pyruvaat in mitochondria van verschillende tumorcellen. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Lactaatmetabolisme is geassocieerd met zoogdiermitochondriën. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Reexamining cancer metabolism: lactate production for carcinogenesis could be the purpose and explanation of the Warburg effect. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically “fertilize” the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-lactaat genereert waterstofperoxide in gezuiverde rattenlever mitochondria als gevolg van de putatieve L-lactaat oxidase gelokaliseerd in de intermembraan ruimte. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar