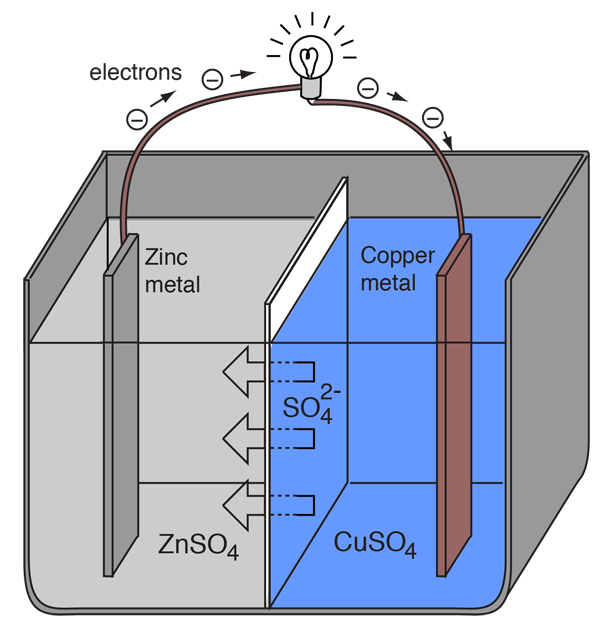
Eine elektrochemische Zelle, die einen externen elektrischen Stromfluss verursacht, kann mit zwei verschiedenen Metallen hergestellt werden, da die Metalle unterschiedlich dazu neigen, Elektronen zu verlieren. Zink verliert leichter Elektronen als Kupfer. Wenn man also Zink- und Kupfermetall in Lösungen ihrer Salze einbringt, können Elektronen durch einen externen Draht fließen, der vom Zink zum Kupfer führt.
Anmerkung zur Abbildung hinzufügen
Da ein Zinkatom die Elektronen abgibt, wird es zu einem positiven Ion und geht in wässrige Lösung über, wodurch die Masse der Zinkelektrode abnimmt. Auf der Kupferseite wandeln die beiden erhaltenen Elektronen ein Kupferion aus der Lösung in ein ungeladenes Kupferatom um, das sich an der Kupferelektrode ablagert und deren Masse erhöht. Die beiden Reaktionen werden in der Regel folgendermaßen geschrieben:
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Die Buchstaben in Klammern erinnern nur daran, dass das Zink aus einem Feststoff (s) in eine wässrige Lösung (aq) übergeht und umgekehrt das Kupfer. In der Sprache der Elektrochemie ist es üblich, diese beiden Vorgänge als „Halbreaktionen“ zu bezeichnen, die an den beiden Elektroden stattfinden.
Zn(s) -> Zn2+(aq) + 2e- |
Die „Halbreaktion“ des Zinks wird als Oxidation bezeichnet, da es Elektronen verliert. Der Pol, an dem die Oxidation stattfindet, wird „Anode“ genannt. Bei einer Batterie ist dies der Minuspol. |
|
Die Kupfer-„Halbreaktion“ wird als Reduktion eingestuft, da sie Elektronen gewinnt. Der Pol, an dem die Reduktion stattfindet, wird „Kathode“ genannt. Bei einer Batterie ist dies der positive Pol. |
Cu2+(aq) + 2e- -> Cu(s) |
Damit die galvanische Zelle weiterhin einen externen elektrischen Strom erzeugen kann, muss eine Bewegung der Sulfat-Ionen in der Lösung von rechts nach links stattfinden, um den Elektronenfluss im externen Kreislauf auszugleichen. Die Metallionen selbst müssen daran gehindert werden, sich zwischen den Elektroden zu bewegen, also muss eine Art poröse Membran oder ein anderer Mechanismus für die selektive Bewegung der negativen Ionen im Elektrolyten von rechts nach links sorgen.
Energie ist erforderlich, um die Elektronen zu zwingen, sich von der Zink- zur Kupferelektrode zu bewegen, und die Menge an Energie pro Ladungseinheit, die von der galvanischen Zelle zur Verfügung steht, wird als elektromotorische Kraft (emf) der Zelle bezeichnet. Die Energie pro Ladungseinheit wird in Volt ausgedrückt (1 Volt = 1 Joule/Coulomb).
Um Energie aus der Zelle zu gewinnen, muss mehr Energie aus der Oxidation des Zinks freigesetzt werden, als zur Reduktion des Kupfers nötig ist. Die Zelle kann eine endliche Menge an Energie aus diesem Prozess gewinnen, da der Prozess durch die Menge an verfügbarem Material entweder im Elektrolyten oder in den Metallelektroden begrenzt ist. Befindet sich beispielsweise ein Mol der Sulfat-Ionen SO42- auf der Kupferseite, so können nur zwei Mol Elektronen durch den äußeren Stromkreis übertragen werden. Die Menge an elektrischer Ladung, die in einem Mol Elektronen enthalten ist, wird als Faraday-Konstante bezeichnet und ist gleich der Avogadroschen Zahl mal der Elektronenladung:
Die Energieausbeute einer galvanischen Zelle ergibt sich aus der Zellspannung mal der Anzahl der übertragenen Elektronenmole mal der Faraday-Konstante.
Elektrischer Energieertrag = nFEcell
Die Zellen-EMK Ecell kann aus den Standardelektrodenpotentialen für die beiden Metalle vorhergesagt werden. Für die Zink-Kupfer-Zelle unter den Standardbedingungen beträgt das berechnete Zellpotential 1,1 Volt.
| Trockenzellen | Blei-Säure-Batterien |